恶性肿瘤患者自体CIK细胞的诱导培养及表型鉴定
喻皇飞,方 宁,章 涛,陈代雄,范振海,杨卫兵,宫黎明,刘金伟,余丽梅
(1.遵义医学院附属医院 贵州省细胞工程重点实验室,贵州遵义563003;2.肿瘤医院,贵州遵义563003)
细胞过继免疫治疗是将体外诱导的具有强大杀瘤活性的免疫细胞回输给患者的一种生物治疗方法,其不仅具有杀伤体内残存癌细胞的能力,同时可增强宿主的免疫力,已成为肿瘤生物治疗的重要手段之一。细胞因子诱导的杀伤(cytokine induced killer,CIK)细胞通常是将人外周血单个核细胞(peripheral blood mononuclear cells,PBMNCs)在体外经多种细胞因子共同培养刺激后所获得的一类异质细胞群,其主要表达CD3和CD56两种膜蛋白分子,兼有T淋巴细胞强大的抗肿瘤活性和非主要组织相容性复合物(MHC)限制性杀瘤的特点[1],因此,CIK细胞被认为是目前抗肿瘤细胞过继免疫治疗的首选方案[2]。本研究采集、分离恶性肿瘤患者PBMNCs,体外诱导培养CIK细胞,并监测了诱导前后细胞的形态学变化及免疫表型变化。
1 临床资料
42例恶性肿瘤患者,其中呼吸道肿瘤19例,消化道肿瘤10例,泌尿系肿瘤8例,妇科肿瘤4例,黑色素瘤1例,为我院肿瘤医院住院病人,男性32例,女性10例,年龄38~80岁,平均年龄57岁,经病理检查后诊断明确,均为化放疗后中晚期恶性肿瘤患者。经医院伦理委员会批准,患者知情同意后,采集PBMNCs。
2 材料与方法
2.1 主要试剂 BTN无血清培养基(北京博特纳生物科技有限公司);淋巴细胞分离液(天津太平洋科技有限公司);重组人白细胞介素2(rhIL-2)(山东泉港药业有限公司);重组干扰素(-IFN)(上海克隆生物高技术有限公司);抗人T细胞CD3单抗(武汉生物制品研究所);抗人CD3-PerCP、CD4-FITC、CD8-APC、CD56-FITC抗体及其同型对照均为美国BD公司产品。
2.2 外周血单个核细胞(PBMNCs)采集 使 用费森尤斯CEM.TEC血细胞分离机,按单个核细胞程序采集PBMNCs。采集前对患者进行血常规检测,依据患者身高、体重、外周血细胞比容(HCT)、白细胞计数(WBC)、血小板(PLT)等相关指标设置采集循环数(4~6个循环)。
2.3 CIK细胞诱导培养 采 集的PBMNCs按等体积加于密度梯度1.077淋巴细胞分离液层面之上,2000 rpm离心20 min,收集白膜层,加入生理盐水反复洗涤2次,1000 rpm离心5min后弃上清,细胞用含8 mL20%人血清白蛋白和终浓度为1000U/mL的rh IFN-的无血清培养基悬浮,调整细胞密度以2×106/mL种于175cm2培养瓶内,置于37℃、5%CO2、饱和湿度环境下培养。培养24 h后加入浓度为50 ng/mL的CD3McAb及400 U/mL的IL-2,以后每3天换液一次,并补充IL-2。
2.4 CIK细胞免疫表型分析 分别取诱导培养前PBMNCs悬液和诱导培养13 d的CIK细胞悬液,调整细胞浓度为5×106/mL,分别加入抗人CD3-PerCP、CD4-FITC、CD8-APC、CD56-FITC抗体及其同型对照,室温避光孵育20 min后,加入红细胞裂解液0.5mL,充分混匀,裂解红细胞,1000rpm离心5 min,2mlPBS洗涤,离心、弃上清,加入200L固定液,上机检测、分析。
3 统计学处理
4 结果
4.1 CIK细胞形态和细胞活力 CIK细胞形态似外周血淋巴细胞,培养3天后细胞明显增殖,呈簇生长,可观察到不规则形的细胞,胞质少,核大而圆,并可观察到细胞分裂相;培养11~13天时,胞体和胞核均增大,细胞团更大。台盼蓝拒染法检测,诱导后CIK细胞活力均大于95%。

图1 倒置相差显微镜下观察培养的CIK细胞形态。
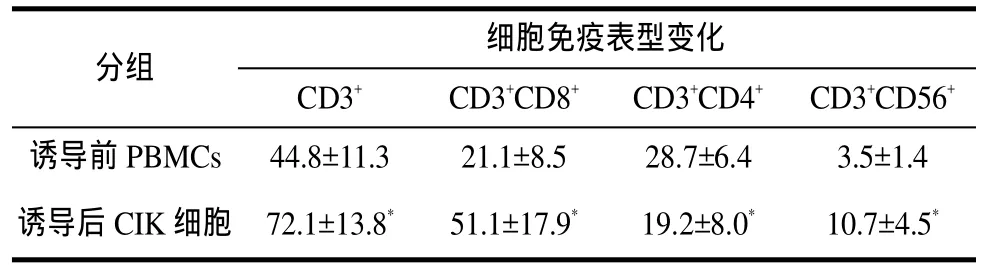
表1 恶性肿瘤患者PBMNCs诱导CIK细胞前后细胞表型变化( ± ,n=42)。
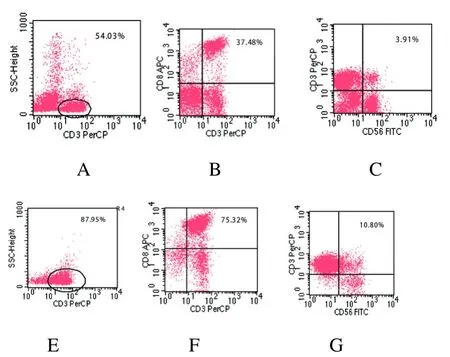
图2 流式细胞仪检测分析PBMNCs诱导CIK细胞前后表达CD3+、CD3+CD8+及CD3+CD56+细胞百分率变化的二维散点图。A-C为诱导前PBMNCs,D-F为诱导后的CIK细胞。
5 讨论
恶性肿瘤的发生、发展与机体的免疫功能密切关联。研究表明,多种肿瘤患者有T淋巴细胞亚群的状态异常和比例失调现象[3],免疫功能异常致使肿瘤免疫逃逸的发生,与肿瘤发展、扩散有显著相关性[4]。
CIK细胞主要由CD3+CD56+和CD3+CD8+亚群组成,其中CD3+CD56+T细胞也称自然杀伤活性T细胞(natural killer active T cell,NKT细胞),在正常人外周血中含量极少[5]。CD3+CD8+T淋巴细胞为细胞毒性T细胞(cytotoxicity t lymphocyte,CTL),是体内执行细胞免疫功能的主要效应细胞,具有抗肿瘤活性。本研究所用CIK细胞诱导体系中,抗CD3Mc Ab作为一种有丝分裂促进剂,能够模拟T细胞表面受体(TCR)的生理配体促进细胞增殖[6]。而IL-2作为机体细胞免疫应答的核心物质,通过T淋巴细胞的自分泌或旁分泌作用,在激活静止T细胞并维持其持续增殖的过程中起着关键作用[7]。IFN-则可经过多种途径直接或间接增加自然杀伤细胞(NK),巨噬细胞(M )及细胞的杀伤毒性[8]。本研究采用上述三种细胞因子联合诱导CIK细胞,结果显示,恶性肿瘤患者PBMNCs经体外培养多种细胞因子诱导后,CIK细胞中具有肿瘤杀伤活性的T淋巴细胞(NKT、CTL)比例明显增高,数量也显著增加,而CD3+CD4+的抑制性T细胞亚群比例则明显减少,表明该体系可成功诱导出用于临床治疗的较好质量的自体CIK细胞。另一方面,通过流式细胞术检测诱导前后细胞免疫表型的变化,监测 CD3+、CD4+、CD8+和 CD56+细胞比例的变化也是评价CIK细胞质量的重要指标,为其有效治疗恶性肿瘤提供重要的免疫学基础。
研究中所制备的自体CIK细胞,经质检合格后,给患者回输,也产生了不同程度的抗肿瘤效应和患者免疫功能的改善,且明显改善患者生活质量,与国内外诸多的研究报道一致[9~12],进一步证明回输自体CIK细胞,可通过改善肿瘤患者免疫功能,促进微小残留病灶的清除等,一定程度的控制肿瘤进展,但其机体损伤极小,所用患者回输过程中未发生严重不良反应。
[1] Schmidt-Wolf IG,Lefterova P,Mehta BA,et al.Phenotypic characterization and identification of effector cells involved in tumor cell recognition of cytokine-induced killer cells[J].Exp Hematol,1993,21(13):1673-1676.
[2] Linn YC,Hui KM.Cytokine-induced NK-like T cells:from bench to bedside[J].J Biomed Biotechnol,2010,435-437.
[3] Ito N,Suzuki Y,Taniguchi Y,et al.Prognostic significance of T helper 1 and 2 and T cytotoxic 1 and 2 cells in patients with non-small cell lung cancer[J].Anticancer Res,2005,25(3B):2027-2031.
[4] Kuss I,Hathaway B,Ferris RL,et al.Decreased absolute counts of T lymphocyte subsets and their relation to disease in squamous cell carcinoma of the head and neck[J].Clin Cancer Res,2004,10(11):3755-3762.
[5] Sangiolo D.Cytokine induced killer cells as promising immunotherapy for solid tumors[J].J Cancer,2011,2:363-368.
[6] Chen FX,Liu JQ,Zhang NZ,et al.Clinical observation on adoptive immunotherapy with autologous cytokine-induced killer cells for advanced malignant tumor[J].Ai Zheng,2002,21(7):797-801.
[7]Zoll B,Lefterova P,Ebert O,et al.Modulation of cell surface markers on NK-like T lymphocytes by using IL-2,IL-7 or IL-12 in vitro stimulation[J].Cytokine,2000,12(9):1385-1390.
[8] Weng D,Song B,Durfee J,et al.Induction of cytotoxic T lymphocytes against ovarian cancer-initiating cells[J].Int J Cancer,2010.
[9] Sangiolo D,Mesiano G,Carnevale-Schianca F,et al.Cytokine induced killer cells as adoptive immunotherapy strategy to augmentgraftversus tumor after hematopoietic cell transplantation[J].Expert Opin Biol Ther,2009,9(7):831-840.
[10]Jiang JT,Shen YP,Wu CP,etal.Increasing the frequency of CIK cells adoptive immunotherapy may decrease risk of death in gastric cancer patients[J].World J Gastroenterol,2010,16(48):6155-6162.
[11] Jin J,Joo KM,Lee SJ,et al.Synergistic therapeutic effects of cytokine-induced killer cells and temozolomide against glioblastoma[J].Oncol Rep,2011,25(1):33-39.
[12] 施明,张冰,雷周云,等.自体CIK细胞治疗肝癌的安全性和有效性评价[J].解放军医学杂志,2004,(04):333-335.

