pH响应型P(HEMA/MAA)纳米微凝胶分散液的凝胶化行为和流变性能
申迎华 刘慧敏 李国卿 翟志国 树学峰 台秀梅
(1太原理工大学化学化工学院,太原030024;2太原理工大学应用力学与生物医学工程研究所,太原030024; 3中国日用化学工业研究院,太原030001)
pH响应型P(HEMA/MAA)纳米微凝胶分散液的凝胶化行为和流变性能
申迎华1,*刘慧敏1李国卿1翟志国1树学峰2台秀梅3
(1太原理工大学化学化工学院,太原030024;2太原理工大学应用力学与生物医学工程研究所,太原030024;3中国日用化学工业研究院,太原030001)
制备了在修复受损组织方面有应用潜能的纳米级聚(甲基丙烯酸羟乙酯/甲基丙烯酸)(P(HEMA/MAA))微凝胶;采用试管倒转法对不同pH值和浓度的P(HEMA/MAA)微凝胶分散液的凝胶化相转变行为进行了研究;借助椎板流变仪考察了低浓度和高浓度微凝胶分散液的流变性能,并对pH触发物理凝胶化相转变机理进行了推测.结果表明:在生理pH值环境下,一定浓度的P(HEMA/MAA)微凝胶分散液可以发生凝胶化相转变形成凝胶态,pH=7时,HEMA/MAA进料摩尔比为8/2的微凝胶分散液凝胶化后得到的凝胶力学性能最佳,最大弹性模量(Gʹ)可达7.58×103Pa;P(HEMA/MAA)微凝胶颗粒在不同条件下具有不同的溶胀效果,导致低浓度分散液的表观粘度发生相应的变化,并由此推测出微凝胶颗粒的溶胀过程由外及内,分为三个阶段;高浓度微凝胶分散液发生凝胶化相转变主要是由颗粒间或颗粒与分散介质间形成的空间静电稳定作用和氢键共同作用引起的.
*Corresponding author.Email:shenyinghua@tyut.edu.cn;Tel:+86-351-6018554.
The project was supported by the Natural Science Foundation of Shanxi Province,China(2010011032-2)and Outstanding Innovative Program for Graduates of Shanxi Province,China(20103036).
山西省自然科学基金(2010011032-2)和山西省研究生优秀创新项目(20103036)资助
凝胶化;P(HEMA/MAA)微凝胶;pH响应性;分散液浓度;弹性模量
1 引言
微凝胶是一种分子内高度交联且具有胶体尺寸(1-1000 nm)的聚合物粒子.1受到温度、2pH值、3离子强度、4特定溶剂5和外界电磁场6等外界因素的变化刺激,能发生体积收缩或膨胀,从而引起流变、孔隙度等性能变化的微凝胶称为智能微凝胶.智能微凝胶分散液体系黏度低、流动性好、可填充微小空隙,在一定条件下可发生凝胶化相转变形成具有一定力学强度的凝胶,故在药物控制释放、7固定化酶、8分离蛋白质9以及外科重建和受损组织器官的修复10等方面有广阔的应用前景.目前研究较多的是温度响应型微凝胶,11且多是应用于药物释放.12由于温度响应型微凝胶是通过收缩失水成胶,导致其亲水性降低,且挤出的水若不能及时排除容易引起炎症,使其在组织工程应用中受限.pH响应型微凝胶分散液则可克服上述不足.Saunders等13采用种子乳液聚合法合成了pH响应型聚(丙烯酸乙酯/甲基丙烯酸/丁二醇二丙烯酸酯)(P(EA/MAA/ BDDA))微凝胶,并将高浓度的微凝胶分散液注射到受损椎间盘模型内,通过注射NaOH溶液调节体系的pH值使微凝胶颗粒溶胀并凝胶化,从而达到修复受损组织的目的.
本文选用已被广泛用于生物医学研究领域的水溶性单体甲基丙烯酸羟乙酯(HEMA)14和甲基丙烯酸(MAA)15,16作为共聚单体,通过反相微乳液聚合制得P(HEMA/MAA)纳米微凝胶.HEMA具有极好的生物相容性和血液相容性,17,18与丙烯酸乙酯(EA)类单体相比,HEMA侧链上带有亲水性的功能基团羟基,增加了氢键结合点,利于降低分散液凝胶化所需最小浓度和能提高物理交联凝胶的力学性能; MAA侧链上带有羧基,可以使微凝胶具有pH响应性,且通过调节两种单体的进料摩尔比可以控制微凝胶分散液在生理pH条件下实现凝胶化相转变,同时兼顾凝胶具有理想的力学强度.本文重点考察P(HEMA/MAA)微凝胶分散液的相转变,通过对凝胶粘弹性能的测定间接考察了其力学性能,并推测了P(HEMA/MAA)微凝胶颗粒的溶胀过程及其分散液的凝胶化机理,旨在进一步揭示pH响应型微凝胶的结构与性能的关系,为此类型的可注射型微凝胶在组织工程中的应用提供理论指导.
2 实验部分
2.1 试剂与仪器
甲基丙烯酸(天津市博迪化工有限公司)和甲基丙烯酸羟乙酯(上海嘉辰化工有限公司),减压蒸馏后使用;N,Nʹ-亚甲基双丙烯酰胺(MBA)(天津市大茂化学试剂厂),过硫酸铵((NH4)2S2O8)(天津市化学试剂三厂),亚硫酸氢钠(NaHSO3)(中国医药集团上海化学试剂厂).所有药品均为分析纯;JEM-1011透射电镜,日本电子公司;ZDT-4A自动电位滴定仪,上海精密科学仪器有限公司.Zetasizer 3000激光粒度分析仪,英国Malvern公司;RS-75椎板流变仪,转子:C 35/2°,德国HAKKE公司.
2.2 实验过程
2.2.1 微凝胶的制备
由异辛烷和复配乳化剂Span80/Tween80组成均一的油相;基于单体总质量的1%的交联剂MBA、一定配比的单体HEMA/MAA和水组成均一的水相;将油相和水相以质量比为3:1混匀,基于单体总质量的1%的(NH4)2S2O8和NaHSO3为引发剂,采用反相微乳液法19制备一系列单体摩尔比不同的P(HEMA/MAA)微凝胶,将粗产物乳液用丙酮沉淀、反复洗涤以除去微凝胶表面的乳化剂、未反应的单体和引发剂,再用蒸馏水透析一周,干燥后即得白色微凝胶粉末.同法分别制备得到微凝胶-1(nHEMA/ nMAA=3/7)、微凝胶-2(nHEMA/nMAA=5/5)、微凝胶-3(nHEMA/ nMAA=8/2).
2.2.2 微凝胶的表征
将微凝胶粉末分散到pH=3.0的蒸馏水中,超声分散30 min,吸取上清液滴到铜网上,自然晾干后用质量分数为2.0%的醋酸双氧铀溶液染15 min,干燥后用透射电镜观察.配制质量分数为0.02%的微凝胶分散液,恒温(25°C)下用0.01 mol·L-1NaOH溶液进行酸碱中和滴定,相同条件下重复3次实验,并绘制了滴定曲线.配制一系列不同pH值,质量分数为0.02%的微凝胶分散液,用动态光散射仪测定微凝胶粒子的流体力学直径(d);测量角度:90°,测量波长:632.8 nm,并由公式q=(d/dc)3,计算得到溶胀率q,式中dc为微凝胶收缩态粒径.
2.2.3 微凝胶分散液的凝胶化相转变及流变性能
试管倒转法确定凝胶化相图.在25°C下,于一系列具塞瓶中配制浓度固定而pH值不同的微凝胶分散液,翻转具塞瓶10次并静置10 min;在某一pH值下,分散液失去流动性,即发生凝胶化,此pH值即为该浓度下凝胶化临界最小值pH(pHc,min);增大pH值,分散液恢复流动,此时pH值为该浓度下凝胶化临界最大pH值(pHc,max);以相同方法考察不同浓度微凝胶分散液的pHc,min与pHc,max;将各浓度的pHc,min和pHc,max连起来形成封闭区域即为凝胶化区域.
低浓度微凝胶分散液的表观粘度测定.分别配制一系列不同pH值、质量分数为0.5%的微凝胶分散液,溶胀15 h后进行表观粘度测试;测试条件,剪切力:0.12-1 Pa,温度:(25.0±0.5)°C;相同测试方法和实验条件下测试pH值为5.5、浓度不同的一系列微凝胶分散液的表观粘度.
高浓度分散液的流变测试.分别配制一系列pH=6.5、浓度不同的微凝胶分散液,凝胶化15 h,取适量样品放置在流变仪的样品放置板上进行测试,扫描频率ω范围:0.01-15.9 Hz,扫描应力τ范围: 0.1-1000 Pa,温度:(25.0±0.5)°C;相同测试方法和实验条件下对一系列不同pH值、质量分数为14%的微凝胶分散液进行频率扫描.
3 结果与讨论
3.1 微凝胶的形貌表征及pKa值的确定
为了得到收缩态微凝胶的粒径,将P(HEMA/ MAA)微凝胶粉末均匀分散到pH=3的水中进行电镜表征,图1结果表明:微凝胶粒径约为48 nm,且呈较规则的球形.
对于pH响应型微凝胶,当环境pH达到其pKa值,颗粒开始溶胀,从而引起分散液各种性能的变化.下面通过酸碱滴定实验结果绘制了滴定曲线并由此计算了微凝胶的pKa值.

图1 微凝胶颗粒的TEM图Fig.1 TEM image of microgel particles nHEMA/nMAA=8/2
根据文献8可知,,当中和度为50%时对应的pH即为该微凝胶的pKa值,结合图2可分别计算出pKa值,微凝胶-1:5.71,微凝胶-2:5.73,微凝胶-3:5.83.
3.2 微凝胶分散液的凝胶化相转变行为
在一定pH值和浓度下,pH响应型微凝胶分散液可以发生多点物理缔合,从而实现凝胶化相转变.Limain等20把诱导这种智能凝胶材料发生形态及性能变化的作用力归纳为四类:氢键、静电作用力、范德华力和水的溶剂化作用,随外界环境的变化,这四种力相互竞争起主导作用从而引起其性能的改变.
本文采用试管倒转法对三种微凝胶分散液的凝胶化相转变行为进行了研究.图3展示了以微凝胶-3为代表的凝胶化过程实物图,其凝胶化相图见图4.

图2 不同单体摩尔比微凝胶的酸碱滴定曲线Fig2 Titration curve for microgels with different monomer molar ratiosCp:mass fraction of microgels;nHEMA/nMAA:microgel-1,3/7; microgel-2,5/5;microgel-3,8/2

图3 微凝胶-3分散液凝胶化相转变实物图Fig.3 Photograph of gelation transition for the microgel-3 dispersion Cp=6%
从图3中可知,微凝胶分散液相转变过程大致分为四个阶段:收缩、溶胀、凝胶化和消溶胀;pH为5.8时分散液呈半透明状,这是因为达到了微凝胶的pKa值,部分羧基的解离使得收缩的颗粒开始溶胀; pH大于6.8时颗粒充分溶胀,分散液发生了相转变,呈凝胶状态;pH大于12.8,碱过量导致颗粒与分散介质水之间的氢键被破坏,分散液恢复流动性.
从图4中可知,不同单体摩尔比的P(HEMA/ MAA)微凝胶分散液发生凝胶化相转变的范围有所不同,微凝胶-3发生凝胶化所需pHc,min最大,这是由于其pKa值(5.83)最大,羧基开始解离所需的pH值也相应增大;而且微凝胶-3中羧基含量最少,所以微凝胶颗粒溶胀程度最小,使得凝胶化所需分散液浓度也随之增大.
由凝胶化相图可知P(HEMA/MAA)微凝胶分散液在不同条件下会呈现流动的分散液和高浓度的凝胶两种状态,下面分别对这两种状态下分散液的流变性能进行深入研究.
3.3 低浓度微凝胶分散液的流变性能
3.3.1 pH值对分散液表观粘度的影响
pH值响应微凝胶分散液的流变性能主要受颗粒表面电荷、颗粒结构及浓度等因素影响.21

图4 不同单体摩尔比的微凝胶分散液凝胶化相图Fig.4 Dispersion-to-phase diagrams of microgels withdifferent monomer molar ratios
图5为不同pH值下的表观粘度变化曲线,做τ为0.12-0.4 Pa之间的平均表观粘度ηave随pH值的变化曲线,并与溶胀率q-pH曲线进行对比,见图6.从图中可知,在pH=5.5-6之间ηave值发生了突增,溶胀率q也在pH约为6时开始增大.这是由于此时pH达到P(HEMA/MAA)微凝胶的pKa,颗粒外层的-COOH开始解离,静电斥力增大,外层链段伸展,水分子进入颗粒外层结构中,假想此时形成了如图7所示的“内硬外软”颗粒,颗粒呈三层结构,由内至外分别为硬球、软层和带电层,外层伸展出部分链段,使得颗粒对流动的分散介质的阻力增大,从而引起分散液表观粘度增大;随pH值继续增大,颗粒内部的-COOH也开始解离,使整个颗粒的网络结构充分伸展,水分子由外向内扩散到颗粒内层,使其从外至内呈均一的软球结构,微凝胶颗粒自身体积继续胀大,含水量进一步增加,剪切外力使使颗粒无法保持其形态上的完整性,发生破碎,形成极易随分散介质流动的不规则的小颗粒,此时微凝胶分散液的表观粘度再度下降.21-23

图5 不同pH值的微凝胶-3分散液粘度曲线Fig.5 Viscosity of microgel-3 dispersion as a function of pH values
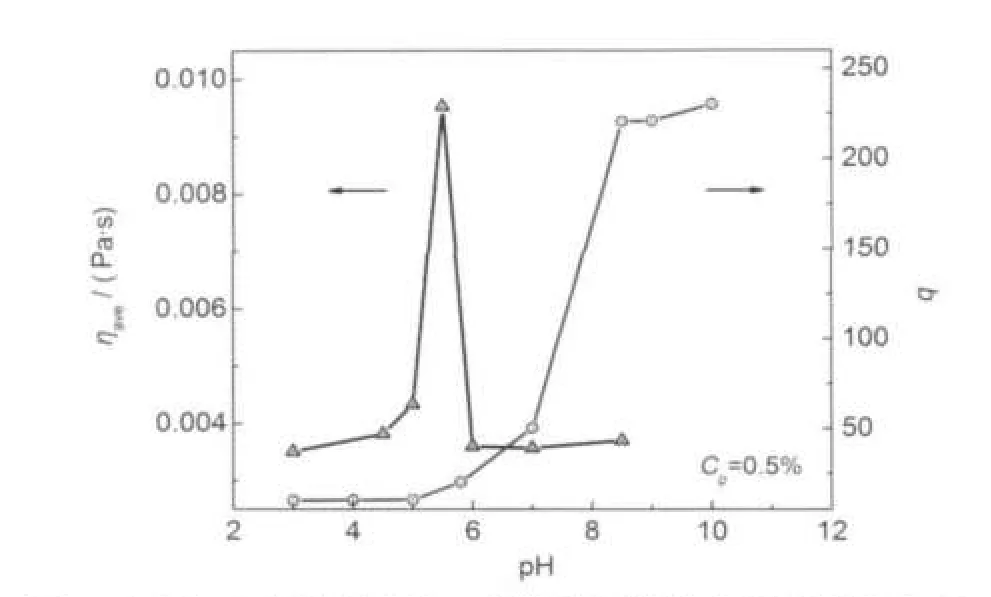
图6 不同pH值的微凝胶-3分散液平均粘度及溶胀率曲线Fig.6 Average viscosity and swelling ratio of microgel-3 dispersion as a function of pH values
3.3.2 浓度对分散液表观粘度的影响
图8是相同pH值下不同浓度微凝胶分散液的η-τ的变化曲线,由于分散液浓度较小,η变化不明显.为清晰起见,取τ为0.1-0.2 Pa之间η的平均值,作ηave
-Cp的变化曲线,如图8中插图所示.ηave随分散液浓度增加而增加,是由于在相同pH下颗粒的溶胀程度相似,ηave只随颗粒数目的增多而增大.
3.4 高浓度微凝胶分散液的流变性能
下面通过对凝胶粘弹性能的测定间接考察其力学性能,对较高浓度微凝胶分散液中颗粒之间和颗粒与分散介质间的作用关系进行研究,进一步推测P(HEMA/MAA)微凝胶分散液发生凝胶化相转变的机理.
3.4.1 pH值对凝胶力学性能的影响
对Cp=14%不同pH值的胶态微凝胶进行频率扫描,得到Gʹ-ω曲线.取不同ω下的Gʹ平均值,然后绘制Gʹave
-pH关系曲线,见图9.
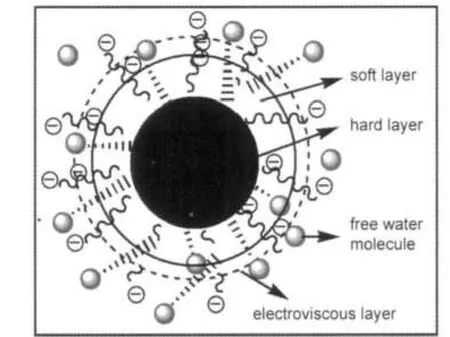
图7 pH≈pKa时微凝胶颗粒的溶胀示意图Fig.7 Pictorial representation of swollen microgel particle at pH≈pKa

图8 不同质量分数的微凝胶-3分散液粘度曲线Fig.8 Viscosity of microgel-3 dispersion as a function of τ and Cp
如图9所示,pH为7.0时凝胶的Gʹ值达到最大,约7.58×103Pa,而随pH值继续增加Gʹ值减小.这是由于随pH值增大到7.0,颗粒外层有更多的-COOH解离,颗粒外层之间、颗粒与溶剂分散介质之间作用力增强,即呈“内硬外软”状态;此时力学强度较好,随着pH值继续增加至7.5,内部的-COOH开始解离,颗粒充分溶胀,即呈“软颗粒”状态,使得力学强度有所下降.
此外,对比图9和图5不难发现,在低浓度的微凝胶分散液中,pH值约为6时微凝胶颗粒即可充分溶胀成“软颗粒”,高浓度分散液中颗粒充分溶胀稍有滞后.
3.4.2 浓度对凝胶力学性能的影响
临界剪切力τc是指凝胶网络结构被破坏的最大应力,即图10中Gʹ值开始急剧下降时对应的剪切应力.24从图10中可知,分散液浓度越大τc值越大,且剪切力超过τc后,Gʹ值急剧下降.这是由于分散液的浓度越大,颗粒间距越小,颗粒间静电斥力的稳定作用越强,且引入的羟基增多,形成了更多的氢键,使网络结构更稳定,故τc越大;逐渐增大的剪切力τ破坏了部分氢键,而体系具有自我修复被破坏氢键而重新达到平衡状态的能力,随浓度的增大自我修复能力增强;当达到τc时,氢键修复的速度远小于被破坏的速度,宏观交联网络被破坏的同时,束缚在其中的溶剂水被释放出来,体系重新恢复流动性,故Gʹ急剧下降.

图9 不同pH值胶态微凝胶-3的平均弹性模量变化曲线Fig.9 Average Gʹof microgel-3 as a function of pH values

图10 不同质量分数微凝胶-3分散液弹性模量随剪切力的变化Fig.10 Gʹof microgel-3 as a function of τ and Cp

图11 不同质量分数微凝胶-3分散液弹性模量随角速度的变化Fig.11 Gʹof microgel-3 as a function of ω and Cp
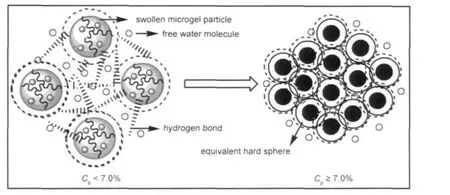
图12 不同浓度分散液微凝胶颗粒的变化示意图Fig.12 Apictorial representation of the changes for the microgel particles at different concentration regimes
由图11可知,对于已经完成凝胶化相转变的高浓度微凝胶分散液,其浓度越高Gʹ越大,说明力学强度越好.这是由于随微凝胶颗粒的增多,一方面更多的羧根使得作用点之间空间制约力增强,另一方面更多的羟基使得颗粒间、颗粒与水分子间氢键增多,25两方面作用使得网络结构力学强度增强;从图11中还可知,分散液质量分数为7.0%时Gʹ增加的幅度变大,随后又平缓增加,由图10也可以看出质量分数为7.0%时τc有轻微的突增现象,说明此时分散介质中反离子浓度明显增大,导致颗粒收缩,趋近于“硬球”,21-23,25,26导致网络结构的力学强度突然加强;随浓度继续增大,多余的颗粒在稳定的网络结构上继续加强力学强度,但是影响变缓,此过程如图12所示.
4 结论
(1)在生理pH值环境下,一定浓度的P(HEMA/ MAA)微凝胶分散液可以发生凝胶化相转变形成凝胶态,微凝胶颗粒的溶胀率越大,凝胶的力学强度就越差,根据实验结果可知,pH值约为7时,P(HEMA/ MAA)微凝胶(nHEMA/nMAA=8/2)分散液凝胶化后的胶态力学性能最佳,最大弹性模量可达7.58×103Pa.
(2)结合低浓度微凝胶分散液的粘度测试和高浓度分散液凝胶化的凝胶力学性能的测试结果可以推测出:P(HEMA/MAA)微凝胶分散液凝胶化过程是功能基团羧基解离引起的空间静电稳定作用和羟基形成的氢键共同作用的结果.在分散液凝胶化的初始阶段,静电斥力为主导力,颗粒溶胀体积随pH值的增大而越大,利于形成最初的宏观网络结构,且在此阶段中,当pH值达到微凝胶的pKa值时,溶液性能变化有一个突变转折点;当分散液发生相转变后,氢键起主导作用,即分散液浓度对加强宏观网络结构力学性能的影响较大,此阶段溶液性能变化也出现一个突变转折点,即分散液质量分数为7.0%时.
(1) Bradley,M.;Ramos,J.;Vincent,B.Langmuir 2005,21,1209.
(2) Martina,K.;Jan,S.P.;Walter,R.J.Am.Chem.Soc.2009,131, 3093.
(3) Shen,Y.H.;Zhang,X.Y.;Lu,J.J.;Zhang,A.Q.;Chen,K.;Li, X.Q.Colloids and Surfaces A:Physicochem.Eng.Aspects 2009,350,87.
(4)Amalvy,J.I.;Wanless,E.J.;Li,Y.Langmuir 2004,20,8992.
(5) Neyret,S.;Vincent,B.Polymer 1997,38,6129.
(6) Kaneda,I.;Vincent,B.J.Colloid Interface Sci.2004,274,49.
(7) Oh,J.K.;Drumright,R.;Siegwart,D.J.;Siegwart,K.M.Prog. Polym.Sci.2008,33,448.
(8) Sirpal,S.;Gattas-Asfura,K.M.;Leblanc,R.M.Colloids Surf. B 2007,58,116.
(9) Nolan,C.M.;Reyes,C.D.;Debord,J.D.;Garcia,A.J.;Lyon, L.A.Biomacromolecules 2005,6,2032.
(10) Jia,X.Q.;Yeo,Y.;Clifton,R.J.;Jia,X.;Yeo,Y.;Clifton,R.J.; Jiao,T.;Kohane,D.S.;Kobler,J.B.;Zeitels,S.M.;Langer,R. Biomacromolecules 2006,7,3336.
(11) Shivkumar,V.G.;Ester,C.;Mark,T.F.T.;Antonio,D.;Yuri, G.;Joachim,W.;Gaio,P.J.Phys.Chem.B 2010,114,10285.
(12) Shaun,C.H.;Craig,V.S.J.;Paul,A.;Fitz,G.;Erica,J.W. Langmuir 2010,26,14615.
(13) Saunders,B.R.;Saunders,J.M.;Tong,T.Soft Matter 2007,3, 486.
(14)Kapoor,Y.;Thomas,J.C.;Tan,G.;John,V.T.;Chauhan,A. Biomaterials 2009,30,867.
(15) Kim,B.;Peppas,N.A.J.Biomater.Sci.Polym.Edit.2002,13, 1271.
(16) Sarah,L.;Paul,M.;Christine,L.L.;Tony,J.F.;Brian,R.S. J.Colloid Interface Sci.2007,316,367.
(17) Seifert,L.M.;Green,R.T.J.Biomed.Mater.Res.1985,9,1043.
(18) Okano,T.;Aoyagi,T.;Kataoka,K.;Abe,K.;Sakurai,Y.; Shimadada,M.;Shinohara,I.J.Biomed.Mater.Res.1986,20, 919.
(19)Shen,Y.H.;Zhang,X.Y.;Li,X.Q.;Wu,L.W.;Zhao,Y.S.; Guo,J.Acta Polym.Sin.2009,No.9,917.[申迎华,张向英,李晓琴,武六旺,赵彦生,郭 健.高分子学报,2009,No.9, 917.]
(20) Limain,F.;Tanaka,T.;Kokufuta,E.Nature 1991,349,400.
(21) Tan,B.H.K.;Tam,K.C.Adv.Colloid Interface Sci.2008,136, 25.
(22)Tan,B.H.K.;Tam,K.C.;Lam,Y.C.;Tan,C.B.J.Rheol. 2004,48,915.
(23)Tan,B.H.K.;Tam,K.C.;Lam,Y.C.;Tan,C.B.Polymer 2004, 45,5515.
(24)An,Y.;Xu,J.;Zhang,J.;Hu,C.G.;Li,G.Z.;Wang,Z.N.; Wang,Z.N.;Zhang,X.Y.;Zheng,L.Q.Sci.China B Chem. 2006,36(3),234.[安 娅,徐 军,张 晋,胡长刚,李干佐,王志宁,王仲妮,张笑一,郑利强.中国科学B化学,2006,36
(3),234.]
(25) Zhang,J.H.Acta Phys.-Chim.Sin.2003,19(1),90. [张建合.物理化学学报,2003,19(1),90.]
(26)Andrew,M.;Howe,S.;Desrousseaux,L.S.;Lunel,J.T.Adv. Colloid Interface Sci.2009,147,124.
March 7,2011;Revised:June 2,2011;Published on Web:June 17,2011.
Rheological Properties and Gelation of pH-Responsive P(HEMA/MAA) Nano-Microgel Dispersions
SHEN Ying-Hua1,*LIU Hui-Min1LI Guo-Qing1ZHAI Zhi-Guo1SHU Xue-Feng2TAI Xiu-Mei3
(1College of Chemistry and Chemical Engineering,Taiyuan University of Technology,Taiyuan 030024,P.R.China;
2Institute of Applied Mechanics&Biomedical Engineering,Taiyuan University of Technology,Taiyuan 030024,P.R.China;3China Research Institute of Daily Chemical Industry,Taiyuan 030024,P.R.China)
Poly((2-hydroxyethyl methacrylate)-co-(methacrylic acid))(P(HEMA/MAA))microgels with potential application in the restoration of damaged tissue were prepared.The phase transition behavior of P(HEMA/MAA)microgel dispersions at different pH values and concentrations as well as rheological properties of diluent and concentrated dispersions were investigated by tube inversion measurements and rheometry,respectively.The mechanism of the pH-induced physical gel phase transition was discussed. The results indicate that P(HEMA/MAA)microgel dispersions at a given concentration can be transformed into a macroscopic gel for gelation at a physiological pH.The mechanical strength of the P(HEMA-co-MAA) macroscopic gel(nHEMA/nMAA=8/2,pH=7.0)is the best and the elastic modulus(Gʹ)value can reach 7.58×103Pa.The swelling effects of the P(HEMA/MAA)microgel are different under different conditions,which results in a variety of apparent viscosities for the diluent dispersions.We deduce that the swelling behavior of the microgel particles can be divided into three stages from the outer parts of the particles to the inner parts.The gelation transitions of the concentrated dispersions are caused synergistically by space electrostatic interactions and hydrogen bonds of the neighboring microgel particles or between microgel particles and water molecules.
Gelation;P(HEMA/MAA)microgel;pH-responsive;Concentration of dispersion; Elastic modulus
O648

