十字花科根肿病研究进展
王 靖, 黄 云, 李小兰, 黎怀忠
(1.四川农业大学植物病理系,成都 611130; 2.河套大学农牧与生化工程学院,巴彦淖尔 015000;3.四川省成都市郫县植保植检站,611730)
十字花科根肿病最早于1737年在英国地中海西岸和欧洲南部发现,现广泛分布于欧洲、北美、日本及中国的辽宁、吉林、新疆、北京、山东、上海、江苏、浙江、安徽、湖北、湖南、四川、重庆、江西、云南、西藏、广东、广西、福建、台湾等省(市)自治区[1]。随着十字花科作物栽培种类增加及面积的扩大、商品种子和南北菜的相互交流调运、土壤的酸化、全球气候的逐年变暖,近年来我国十字花科根肿病的发生面积逐年扩大,严重程度逐年加重,已成为十字花科植物重要病害之一。根肿病不仅仅危害十字花科蔬菜,还危害油菜及十字花科作物、杂草等。根肿病是世界范围内的毁灭性土传植物病害,可造成20%~90%的严重减产。休眠孢子在无感病寄主植物的土壤中存活可达20年之久,土壤一旦污染,将不再适宜十字花科植物的栽培[2];此外,引起根肿病的原生动物——芸苔根肿菌(Pl asmodiophor a br assicae Wor on)专性寄生,不能在人工培养基上生长,传染性强、传播速度快、传播途径多、防治难度大,因此国际上目前非常重视该病并进行了大量研究。本文概述了国内外根肿病的研究进展,期望能对我国根肿病的整体研究有所借鉴和帮助。
1 根肿病的寄主和危害
1.1 寄主范围
根肿病主要危害十字花科植物,如油菜、白菜、青菜、甘蓝、抱子芥、榨菜、萝卜、芜菁等。一些花园植物如香雪球、庭荠、缎花、胡椒草、紫罗兰、糖芥等有时也被感染。绝大多数野生十字花科植物包括野芥子、菥蓂、野芥菜、野萝卜、黄花山芥菜、山芥等易被侵染。木犀草(木犀草科)、虞美人(罂粟科)、红三叶草(豆科)和草地生黑麦草(禾本科)等非十字花科植物在人工接种时也可被侵染[3]。
1.2 症状及危害
根肿病主要危害植物根部,形成形状及大小不一的肿瘤,后期肿根易被杂菌侵入造成腐烂[4]。植株整个生育期均可发病,受侵愈早,发病愈重。发病初期,地上部症状不明显。随着受害根部的逐渐膨大,病株叶片淡绿、生长缓慢。基部叶片在晴天中午常萎蔫,早晚恢复,严重者整株枯死。
根肿病会导致十字花科作物产量和品质严重下降[5],且土壤将长期带菌而导致部分蔬菜和油菜基地被迫改种其他作物。在我国,根肿病常年危害面积约320~400万h m2,占十字花科作物种植面积的1/3以上,大流行年份发生与危害面积可达900万h m2,平均产量损失达20%~30%,严重田块直接产量损失达60%以上。
2 根肿病的病原
芸苔根肿菌(P.br assicae)的分类地位仍存在争议。目前公认的观点是将根肿病菌归到原生动物界、根肿菌门(Plasmodiophoromycota)中(因为其生活史中存在原生质团阶段)[6]。
根肿病菌的休眠孢子囊在寄主根部薄壁组织细胞内形成,球形或扁圆形、单胞、无色或略带灰色,大小1.6~4.6μm,常密集呈鱼卵状。将休眠孢子悬浮液的沉淀经戊二醛固定、乙醛逐步脱水、醋酸异戊酯置换、离子溅射镀金后,于扫描电镜下观察发现不同寄主上根肿病菌休眠孢子的形态和大小略有不同(表1)[7]。由于根肿病菌休眠孢子囊萌发时只释放1个游动孢子,因此它的休眠孢子囊通常称为休眠孢子。
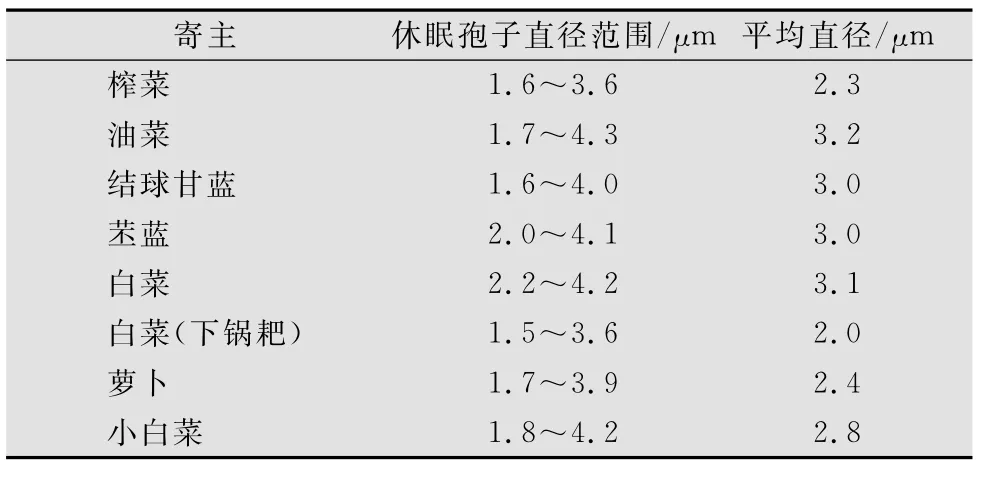
表1 不同寄主来源根肿病菌休眠孢子的大小
条件适宜时休眠孢子萌发释放出1个具有一长一短2条鞭毛的游动孢子,肾形或椭圆形、近球形。游动孢子经过一段时间后鞭毛脱落而囊化形成休止孢。休止孢萌发形成一管状结构穿透寄主细胞壁,将原生质注入寄主细胞内,发育成原质团。黄云等人在电镜下观察到了油菜根肿病菌休眠孢子至管腔的过程[8]。
2.1 致病性分化
目前国际上通用的鉴别体系是Willia ms系列和ECD系列。Willia ms根据被侵染的4种十字花科植物 品 种 ‘Jersey Queen’、‘Badger Shipper’、‘Laurentian’和‘Wilhel msburger’的反应类型制定了一个标示根肿病菌生理小种的系统。
Williams系列包括 ‘Jersey Queen’、‘Badger Shipper’、‘Laurentian’和‘Wilhel msburger’4种十字花科植物[9];欧洲鉴别寄主ECD系列共含有15个十字花科品种,其中同样含有‘Jersey Queen’、‘Badger Shipper’和‘Wilhel msburger’[10]。Jone等进行单孢接种后利用ECD系列获得了4个生理小种[11]。沈向群等人采用Williams系列进行鉴定,认为目前国内根肿病菌的优势生理小种是4号(主要分布在平原大白菜主产区)[12]。
2.2 分离与保存
根肿病菌休眠孢子的常规分离是将根肿组织进行研磨、过滤、反复离心,但该法不利于休眠孢子的长期保存(因为休眠孢子悬浮液中含有多种微生物)[13]。Castlebur y等将常规分离法进行了改进,在离心过程中加入消毒灭菌剂(40%二氧化硅溶于Na OH,p H9.8)以排除其他微生物[14]。
肖崇刚等[15]选用10%次氯酸钠溶液(有效氯0.52%)作为消毒灭菌剂,减少了离心次数。杨佩文等[16]用50%蔗糖溶液对休眠孢子粗提液进行悬浮,以除去淀粉、土壤颗粒等杂质。邓洁等人[17]在p H5.5左右、添加0.5%的二甲基亚砜、孢子浓度约为7×108、345 W功率下超声波处理50 min后,孢子破碎率稳定地达到90%以上,除菌率达99%以上。
根肿病菌不能在人工合成培养基上进行离体培养,使得长期保存非常困难。根肿病菌常用的保存方法是活体或低温保存,活体保存法(把根肿病菌接种在健康的植株上作为菌株保存)费时、劳动强度大。Castlebury等认为根肿组织冷冻数年后休眠孢子仍具有活性,而Miller却认为冷冻保存3个月后休眠孢子的活性会减弱[18]。
2.3 检测
利用酶联免疫法 ELISA (enzy me-liked i mmunosor bent assay)、斑点免疫法 DIBA (dot i mmunobinding assay)和组织免疫印迹 TBIA (tissue-bl ot i mmunoassay)等方法可以检测人工接种土壤及根肿组织中的休眠孢子[19-20];采用荧光显微技术也可以估测土壤中根肿病菌休眠孢子的含量[21];不过这些方法的应用因需要专用设备而受到了限制。血清学技术也可用于检测,虽然便宜,但需要制备单克隆抗体,因此也不实用。
PCR技术在检测根肿病菌方面显示了巨大潜力[22]。Ito等将PCR技术应用到根肿病的检测中[23]。Faggian等获得了专一性PCR引物来检测根肿病菌[24]。Mananares等绘制了不同根肿病菌单孢分离菌群的RAPD图谱[25],发现同属某一特殊类型的病原菌(P1)有共同的分子标记——OPL14(1200),同时设计出了扩增引物。杨佩文等应用ITS区段通用引物ITS1和ITS4对根肿病菌进行PCR,并将得到的目的片段克隆到p GEM-T载体上,设计了一对根肿病菌特异性寡聚核苷酸引物[26]。尹全等根据Gen Bank中根肿病菌的保守序列设计了一对引物,该引物能从供试的根肿病菌根组织中特异性扩增出一条498 bp的预期条带,且能检测出土壤根肿病菌孢子含量大于104个/g土的带菌土壤[27]。
2.4 生物学特性
Chupp和Honig认为光抑制休眠孢子萌发。肖崇刚、黄云等认为根肿病菌休眠孢子萌发适温为24℃,最适p H为6.0~6.7,肿根腐烂处理促进萌发,光不利于萌发。肖崇刚等发现甘蓝根肿病菌休眠孢子的致死温度为45℃,番茄、抗感根肿病甘蓝的根分泌物均能促进休眠孢子萌发;而黄云等发现油菜根肿病菌休眠孢子的致死温度为48℃,寄主植物白菜、抗感根肿病油菜的根分泌物促进休眠孢子萌发,非寄主植物水稻的根分泌物抑制休眠孢子的萌发[18,28]。上述分歧可能与病菌、寄主及非寄主的选择有关。
3 病害发生规律
根肿病菌以休眠孢子黏附在种子上或在带有病残体的土壤及未腐熟的厩肥中越冬。休眠孢子既可在田间近距离传播(主要借助线虫、昆虫活动、土壤中水分、农事操作等),又可进行远距离传播(带菌泥土的转移、带病苗及病株的调运)[29-30]。种子带菌与否目前存在争议。根毛或幼根一般先被入侵(不表现症状),当根肿病菌进入寄主根部的形成层及皮层组织后,薄壁细胞受刺激而加速分裂,且体积增大,从而导致根部长出肿瘤(约需10 d)。当病根腐烂后,其内大量的休眠孢子又随病残体落在土壤或堆肥中,进行再侵染或休眠。
温暖(土温10~30℃,适温19~25℃)、湿润(相对含水量60%~98%)的弱酸性土壤最利于根肿病的发生,p H 4.8~7.6的田块均可发病,发病的早晚、轻重与当年的温度、降雨和土壤等因素有关。播种后第2、3周的光照水平(最佳光照600 W/h m2·d)和温度(最适日均温≥19.5℃)对根肿病发生的严重程度影响最大[31]。条件适宜时,十字花科作物在2叶1心至6叶1心期,根肿病发生发展速度快,6叶1心后发展速度有所减慢。2叶期是防治根肿病的关键。
4 根肿病的防治
4.1 农业措施
4.1.1 改良土壤,恶化根肿病菌的生存环境
利用石灰及其他形式的钙盐在一定程度上可以调节土壤pH。钙盐处理既可以调节土壤的p H,又可以增加土壤中可交换Ca2+的浓度从而减轻病害的危害[32]。一旦发病可撒施熟石灰(100~150 kg/667 m2)或草木灰(30~50 kg/667 m2)[33]。通过施用石灰调节土壤p H来降低根肿病发病率虽有一定的防治效果,但成本高,且长期使用石灰对土壤结构、生理生化性状都会造成不良影响,因此不可长期使用。
戴玉华等[34]推荐了生产上可使用的有效技术:用腐熟农家肥做底肥 → 播种后发芽前用1%石灰液浇穴 → 出苗后2叶、4叶和6叶期各灌根1次 →病情严重的地块团棵期再浇施1%石灰液1次。该法成本低、用量少、流失快,对土壤理化性状影响小。
4.1.2 加强田间管理,营造良好的土壤环境
采用无菌土育苗;田间开沟、及时除草,尽量降低湿度;一旦发现病株立即拔出并烧毁(且用石灰水对病窝消毒);菜收完后,应彻底清除田间病残体(可将根茬全部挖出,运到50~70 c m深的坑内,撒石灰后盖土,让根茬腐烂)。需将病残体煮熟后,再喂牲畜,决不能用病残体沤肥。另外,将常规播种期延后5~10 d播种,可在一定程度上减轻根肿病的发生。
4.2 化学防治
化学防治是目前普遍采用的防治方法,据报道多菌灵、百菌清、五氯硝基苯、氟啶胺、氰霜唑等对根肿菌具有一定的防效[35-36]。张日 波[37]在室内进行了药剂抑制孢子萌发的筛选试验,发现12种药剂对白菜根肿病菌的孢子抑制率大小顺序依次为:氰霜唑>噻菌铜>多抗霉素B>氟啶胺>百菌清>乙铝·锰锌>代森锌>甲基硫菌灵>烯酰吗啉>多菌灵>丙森锌>甲霜·锰锌。但在大田却只有50%氟啶胺和10%氰霜唑对白菜根肿病具有较好防治效果。孙道旺等[38]发现在苗期应用75%百菌清灌根2次对根肿病有效,且农药残留量未超标。
4.2.1 严格种子处理及苗床消毒,培育抗病壮苗
播前晒种并去掉弱病粒;播种前用55℃的温水浸种15 min,再用10%氰霜唑悬浮剂2 000~3 000倍液浸种10 min或福尔马林100倍液浸种20~30 min,用水洗净后播种;使用福尔马林50倍液或敌磺钠500倍液或10%氰霜唑1 500~2 000倍液对苗床进行泼地消毒(淋土深度15 c m左右)。移栽时需药液(石灰水:每桶水加0.1~0.2 kg石灰粉;10%氰霜唑1 500~2 000倍液)浸根或用作定根水。
4.2.2 土壤处理
播种或移栽前用氰氨化钙或氟啶胺进行土壤处理。氟啶胺在土壤中药效稳定,但在较高浓度下对幼苗根系生长有抑制作用,只适宜在移栽大田时进行土壤处理。
4.2.3 药剂防治
田间防治时,可用75%百菌清500倍液或10%氰霜唑1 500~2 000倍液对植株进行灌根,每15 d左右一次。
4.3 抗病品种的选育
国外,特别是韩国和日本,对抗根肿病育种的研究做了大量工作。Bradshaw等利用四倍体杂交法培育出了对根肿病有抗性的芜菁、甘蓝[39];Masashi Hiral等培养出了抗根肿病的大白菜(将欧洲饲用萝卜的抗病基因转移到大白菜上)[40]。
国内,孙保亚等人从国外引进的大白菜中分离出大白菜抗根肿病自交系48个[41],但在我国白菜中还没有发现抗根肿病的材料。刘勇等在成都根肿病重发病区对四川主栽的38个油菜品种和8个德国新引进的油菜品种进行了根肿病抗性研究,结果表明四川主栽油菜品种全部感病[42]。司军等对19份甘蓝材料的抗性进行了鉴定及综合评价,发现‘日本甘蓝’、‘皱叶甘蓝’、‘大楠木’3份材料对根肿病表现为抗病,可以作为抗病育种的材料[43]。胡靖锋等采用菌土接种法鉴定了云南地区110份十字花科作物对根肿病的抗性,发现芜菁材料‘TS04’为高抗材料[44]。
4.4 生物防治
4.4.1 诱饵法
通过种植根肿病菌寄主植物或非寄主植物来促进休眠孢子萌发,减少土壤里休眠孢子的数量,然后在随后种植十字花科作物时便可减轻根肿病的发生。国外在这方面已经进行了大量研究,并且证明了该方法的有效性[45-46]。
4.4.2 从自然界分离拮抗微生物防治根肿病
Narisawa等[47-48]从小麦、油菜、大白菜和象草地里生长的大白菜根中分离根殖真菌,在消毒土壤中,其中16个菌株可以完全抑制根肿病菌,2株根部内生菌Heteroconiu m chaetospir a在自然土中也可减轻根肿病的发生。
Arie等报道利用Phoma gl omer ata JCM 9972可以抑制根肿病菌休眠孢子的萌发并有效控制根肿病的发生[49],其主要抑菌物质为顶环氧菌素(N-[3-氯-5-(三氟甲基)-2-吡啶基]-3-氯-4-(三氟甲基)-2,6-二硝基苯胺),且250μg/mL顶环氧菌素能完全抑制休眠孢子的萌发。
在田间试验中,产生几丁质酶的放线菌(Streptomyces sp.)AC-3与有机肥按2%的比例混合,可将根肿病危害减轻50%,明显好于单用有机肥的效果[50]。Cheah等通过温室和田间试验发现,3个木霉菌株(TC32、TC45和TC63)和1个链霉菌菌株(S99)可以显著减轻新西兰十字花科根肿病的发生[51]。Lee等从韩国大白菜根部分离到81株内生放线菌,其中有3株在室内对十字花科根肿病有较好防效[52]。2株 Microbispor a rosea subsp.rosea防效分别为58%和33%,1株Streptomyces olivochromogenes防效达42%。
何月秋等从大白菜根际土壤中成功分离到一株枯草芽胞杆菌(Bacill us subtilis)XF-1(保藏号为CGMCC NO.2357)来防治根肿病[1,53]。XF-1菌株室内防治效果达85%,田间防效68.6%~84.8%。
5 展望
日本19世纪30年代开始发生根肿病,由于土地面积小,很快无法生产,日本政府投入巨资建立根肿病的专门研究机构,研究根肿病的发生发展规律性,特别是开展病菌的收集整理工作,筛选抗源。我国土地面积大,存在不同的气温土壤等条件,因此可能存在多个生理小种。为防止十字花科根肿病在我国大流行,应尽快开展广泛研究,主要包括:
1)开展全国性的根肿病调查工作,尽快搞清各地小种的分布情况,为筛选专化抗性品种创造前提条件。
2)探索分子标记的利用,建立快速进行抗性品种鉴定的技术。
3)进行抗源的收集和整理,并通过传统的育种方法或分子技术育出抗病或耐病的品种。
4)分离并快速筛选土壤拮抗微生物和内生菌,寻找高效的根肿病拮抗菌株,同时进行提高生防菌株防效的试验并摸索工业化生产条件。
由于根肿病菌的休眠孢子可在土壤中存活20年,且该病发生初期地上部症状不明显,不易检测,因此,应通过耕作、栽培措施,并结合化学防治及生物防治,形成综合防治体系,在注重经济效益、生态效益、社会效益的同时将根肿病的损失降到最低。
[1] 黄云.植物病害生物防治学[M].北京:科学出版社,2010:291-292.
[2] Howard R J,Strel kov S E,Harding M W.Clubroot of cruciferous crops-new perspectives on an old disease[J].Can J Plant Pat hol,2010,32(1):43-57.
[3] Ludwig-Muller J,Bennett R N,Kiddle G,et al.The host range of Pl asmodiophor a br assicae and its relationship to endogenous gl ucosinolate content[J].New Phytologist,1999,141(3):443-458.
[4] Devos S,Vissenberg K,Ver belen J P,et al.Infection of Chinese cabbage by Plasmodiophor a brassicae leads to a sti mulation of plant growth:i mpacts on cell wall metabolism and hormone balance[J].New Phytologist,2005,166:241-250.
[5] 王靖,黄云,胡晓玲,等.油菜根肿病症状、病原形态及产量损失研究[J].中国油料作物学报,2008,30(1):112-115.
[6] Ainsworth G C.Ainsworth and Bisby’s dictionary of the f ungi[M].London:Commonwealth Mycological Institute,1995.
[7] 杨文强.小白菜根肿病发生规律、发病条件及病菌生物学特性研究[D].雅安:四川农业大学,2009.
[8] 黄云,马淑青,李晓琴,等.油菜根肿病菌的形态和休眠孢子的生物学特性[J].中国农业科学,2007,40(7):1388-1394.
[9] Williams P H.A system f or the deter mination of races of Pl asmodiophor a br assicae t hat infect cabbage and r utabaga[J].Phyt opat hology,1966,56(5):624-626.
[10]Buczacki S T,Toxopeus H,Matt usch P,et al.St udy of physiologic specialization in Pl asmodiophor a br assicae:Proposals for attempted rationalization through an international approach[J].Trans Br Mycol Soc,1975,65:295-303.
[11]Jones D R,Ingra m D S,Dixon G R.Factors affecting tests for differential pathogenicity in populations of Plasmodiophor a br assicae[J].Plant Pat hology,1982,31:229-238.
[12]沈向群,聂凯,吴琼,等.大白菜根肿病主要生理小种种群分化鉴定初报[J].中国蔬菜,2009(8):59-62.
[13]Mac Farlane I.A sol ution cult ure technique for obtaining r oothair or pri mary infection by Pl asmodiophor a br assicae[J].J Gen Myco Soc,1958,18:720-732.
[14]Castlebury L A,Maddox J V,Glawe D A.A technique f or t he extraction and purification of viable Pl asmodiophora brassicae resting spores fr o m host r oot tissue[J].Mycologia,1994,86(3):458-460.
[15]肖崇刚,郭向华.甘蓝根肿病菌的生物学特性研究[J].菌物系统,2002,21(4):597-603.
[16]杨佩文,李家瑞,杨勤忠,等.十字花科蔬菜根肿病菌休眠孢子的分离与检测[J].云南农业大学学报,2002,17(3):301-306.
[17]邓洁,程龙,刘谊,等.根肿(Plasmodiophor a br assicae)休眠孢子的纯化和超声波破碎方法研究[J].应用与环境生物学报,2006,12(2):269-272.
[18]Castlebury L A,Glawe D A.A comparison of three techniques for inoculating Chinese cabbage wit h Plasmodiophor a br assicae[J].Mycologia,1993,85(5):8666-8671.
[19]Wakeham A J,White J G.Ser ological detection in soil Pl asmodiophor a br assicae resting spores[J].Physiol Mol Plant Pat hol,1996,48:289-303.
[20]Shoko O,Takashi Y.Detection of resting spores of Pl asmodiophor a br assicae fro m soil and plant tissus by enzy me i mmu-noassay[J].Ann Phytopathol Soc Jpn,1998,64:569-577.
[21]Takahashi K,Yamaguehi T.Assessment of pathogenicity of resting spores of Pl asmodiophor a br assicae in soil by fl uorescence microscopy[J].Ann Phytopathol Soc Japan,1989,55:621-628.
[22]Cao T,Tewari J,Strel kov S E.Molecular detection of Pl asmodiophor a br assicae,causal agent of clubroot of cr ucifers,in plant and soil[J].Plant Dis,2007,91:60-87.
[23]Ito S,Mat hara T,Marund E,et al.Develop ment of a PCR-based assay f or the detection of Pl asmodiophor a brassicae in soil[J].Jour nal of Phytopat hology,1999,147:83-88.
[24]Faggian R,Bul man S R,Lawrie A C,et al.Specific poly merase chain reaction pri mers f or the detection of Pl asmodiophora br assicae in soil and water[J].Phytopat hology,1999,89:392-397.
[25]Manzanares-Dauleux M J,Divaret I,Bar on F,et al.Assessment of biological and molecular variability bet ween and wit hin field isolates of Pl asmodiophor a br assicae[J].Plant Pat hology,2001,50:165-173.
[26]杨佩文,李家瑞,杨勤忠,等.根肿病菌核糖体基因ITS区段的克隆测序及其在检测中的应用[J].云南农业大学学报,2003,18(3):228-233.
[27]尹全,宋君,刘勇,等.土壤根肿病菌休眠孢子PCR快速检测方法的建立[J].西南农业学报,2010,23(2):390-392.
[28]马淑青,黄云,王铮一,等.油菜根肿病菌形态及生物学特性研究[J].四川农业大学学报,2006,24(2):161-165.
[29]Kole A P.So me observations on t he zoospores fro m t he zoosporangia of Plasmodiophor a br assicae Woron[J].Tijdschr PL Ziekt,1955,61:159-162.
[30]李金萍,朱玉芹,李宝聚.十字花科蔬菜根肿病的传播途径[J].中国蔬菜,2010(5):21-22.
[31]Buczacki S T,Ockendon J B,Freeman G H.An analysis of some effects of light and soil temperature on cl ubroot disease[J].Ann Appl Biol,1978,88(2):229-238.
[32]Niwa R,Ku mei T,No mura Y,et al.Increase in soil p H due to Ca-rich organic matter application causes suppression of t he cl ubroot disease of cr ucifers[J].Soil Biology and Biochemistry,2007,39(3):778-785.
[33]Murakami H,Tsushi ma S,Kuroyanagi Y,et al.Reduction of resting spore density of Plasmodiophor a br assicae and clubr oot disease severity by li ming[J].Soil Science and Plant Nutrition,2002,48(5):685-691.
[34]戴玉华,杨莲,李顺德,等.调节土壤p H防治白菜根肿病技术探索[J].中国植保导刊,2004,24(8):20-22.
[35]李妍,谢学文,石延霞,等.防治白菜根肿病的药剂筛选[J].农药学学报,2010,12(1):93-96.
[36]杨佩文,尚慧,董丽英,等.大白菜根肿病发病因素分析与防治技术[J].西南农业学报,2009,22(3):663-666.
[37]张日波.成都市十字花科根肿病调查及防治药剂筛选[D].雅安:四川农业大学,2010.
[38]孙道旺,杨家莺,杨明英,等.75%达克宁防治白菜根肿病产量损失测定及残留分析[J].西南农业学报,2002,17(2):189-191.
[39]Brabshaw J E,Gemell D J,Wilson R N.Transfer of resistance to clubroot(Pl asmodiophora br assicae)to Swedes(Br assica napus L.var.napobr assica Peter m)fro m B.r apa[J].Ann Appl Biol,1997,130:337-348.
[40]Manzanares-Dauleux M J,Delour me R,Baron F,et al.Mapping of one major gene and of QTLs involved in resistance to clubroot in Br assica napus[J].Theoretical and Applied Genetics,2000,101:5-6.
[41]孙保亚,沈向群,郭海风,等.大白菜抗根肿病遗传规律初探[J].中国蔬菜,2005(6):15-17.
[42]刘勇,黄小琴,柯绍英,等.四川主栽油菜品种根肿病抗性研究[J].中国油料作物学报,2009,31(12):90-93.
[43]司军,李成琼,宋洪元,等.结球甘蓝对根肿病的抗性鉴定与评价[J].西南大学学报,2009,31(6):26-30.
[44]胡靖锋,吴丽艳,林良斌,等.用菌土接种法鉴定云南省主要十字花科作物对根肿病的抗性[J].中国蔬菜,2010(14):71-74.
[45]Mac Farlane I.Ger mination of resting spores of Plasmodiophor a br assicae[J].Trans Br Mycol Soc,1970,55:97-112.
[46]Friberg H,Lagerlof J,Ramert B.Usef ulness of nonhost plants in managing Plasmodiophor a br assicae[J].Plant Pat hol,2006,55:690-695.
[47]Narisawa K,Toku masu S,Hashiba T.Suppression of clubroot f or mation in Chinese cabbage by t he r oot endophytic f ungus,Heteroconiu m chaetospir a[J].Plant Pat hology,1998,47(2):206-210.
[48]Narisawa K,Ohki K T,Hashiba T.Suppression of clubroot and Verticillium yellows in Chinese cabbage in the field by the root endophytic f ungus,Heter oconiu m chaetospir a[J].Plant Pathology,2000,49(1):141-146.
[49]Arie T,Kobayashi Y,Okada G,et al.Control of soil borne clubroot disease of cr ucifer ous plants by epoxydon fro m Phoma glomer ata[J].Plant Pat hology,1998,47(6):743-748.
[50]Joo G J,Ki m Y M,Ki m J W,et al.Biocontrol of cabbage clubroot by t he organic fertilizer using Streptomyces sp.AC-3[J].Korean Jour nal of Micr obiology and Biotechnology,2004,32(2):172-178.
[51]Cheah L H,Veerakone S,Kent G.Biological control of clubroot on cauliflower with Trichoder ma and Streptomyces spp.[J].New Zealand Plant Pr otection,2000,53:18-21.
[52]Lee S O,Choi G J,Choi Y H,et al.Isolation and characterization of endophytic actino mycetes fro m Chinese cabbage r oots as antagonists to Plasmodiophor a br assicae[J].J Micr obiol Biotechnol,2008,18(11):1741-1746.
[53]何月秋,熊国如,范成明.防治十字花科根肿病的生物制剂及其应用:中国,200810058919.0[P].2008-9-12.

