Bt抗性和敏感棉铃虫钙黏蛋白及氨肽酶N1表达量的比较
张 涛, 魏纪珍, 张丽丽, 陆 琼, 梁革梅*, 杨 朗
(1.广西大学农学院,南宁 530004; 2.中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193; 3.广西农业科学院植物保护研究所,南宁 530007)
Bt毒蛋白与昆虫中肠上皮细胞的刷状缘膜囊泡(br ush bor der membrane vesicles,BBMV)上的一个或多个受体结合是其发挥毒性的关键[1]。已经报道的受体蛋白主要有钙黏蛋白(cadherin,CAD)、氨肽酶N(aminopeptidase N,APN)、糖脂类碳水化合物、肌动蛋白、碱性磷酸酯酶和V-ATP酶亚基A等,昆虫对Bt产生抗性与其中肠的受体蛋白直接相关,受体蛋白的突变、表达量、结合能力的改变等是昆虫对Bt毒素产生抗性的主要原因[2]。
APN是第一个被发现的、在Bt毒素杀虫机制中起作用的毒素受体蛋白。2002年Gill等采用显微注射法获得了含烟草天蛾(Manduca sexta)APN基因的转基因黑尾果蝇(Drosophila mel anogaster)品系,APN在非敏感宿主果蝇中肠和中胚层获得了表达,这种转基因品系果蝇对Cry1 Ac毒素变得很敏感,该研究首次从虫体水平证实APN可作为Cry1Ac毒蛋白的功能性受体[3]。Rajagopal等利用RNA干扰技术(RNAi)抑制斜纹夜蛾(Spodoptera litura)幼虫中肠APN的表达,发现可降低斜纹夜蛾对Bt的敏感性,证明APN是Bt毒素的受体,并与毒素蛋白发挥毒力有关[4]。
Vadla mudi等[5]首次报道了钙黏蛋白是烟草天蛾中肠上皮组织中一种Cry1A的受体(BT-R1),能特异性地与Cry1 Ab结合。Nagamatsu等[6]将家蚕钙黏蛋白BtR175在Sf9细胞系中进行表达,发现Bt R175的表达导致了膜对Cry1Aa渗透量的改变,进一步证实了类钙黏蛋白是Cry1Aa的一种受体。随后的研究还表明,钙黏蛋白不仅是毒素在鳞翅目昆虫中肠上皮细胞上的特异性受体,还参与了启动胞内信号转导途径[2,7-9]。
随着转Bt基因棉花在我国的大面积商业化种植,棉铃虫(Helicover paar migera)的危害得到了很好的控制[10]。但由于转入的Bt基因在作物体内持续表达,使得害虫在整个生长周期都受到Bt杀虫蛋白的高压选择,因而棉铃虫对Bt的抗性问题是影响未来转基因棉花发展的关键因素。关于棉铃虫APN和CAD基因克隆、表达、及突变、缺失等变化与抗性的关系已经进行了一些研究,本文主要是利用实时荧光定量PCR技术,比较Bt抗性和敏感棉铃虫中肠两种主要受体蛋白—钙黏蛋白和氨肽酶N的表达量变化,分析受体蛋白表达量变化与抗性的关系,进一步明确棉铃虫对Bt的抗性机制,为抗性治理策略的制定提供理论依据。
1 材料与方法
1.1 棉铃虫品系
敏感品系(96S):1996年采自河南省新乡棉田、在室内用人工饲料饲养至今,期间未接触任何杀虫剂。
抗性品系(Bt R):用Cry1Ac毒蛋白在室内筛选了175代,相对抗性倍数为3 536.5倍。筛选方法见梁革梅等[11]。
棉铃虫在温度(27±2)℃,相对湿度(75±10)%,光周期L∥D=14 h∥10 h的条件下饲养。幼虫在指形管中用人工饲料饲养,人工饲料配方参照梁革梅等[12]方法,成虫在产卵笼中用10%糖水补充营养。
1.2 试剂和仪器设备
主要试剂:RNA分离试剂(Trizol)、DNA酶试剂盒和c DNA合成试剂盒购自美国Invitrogen公司;实时荧光定量PCR及常规PCR试剂购自大连宝生物公司(Ta Ka Ra)。其他试剂均为国产分析纯。
主要仪器:7500 Fast实时荧光定量PCR仪,美国应用生物系统公司(Applied Biosystems Incorporation,ABI)公司;凝胶成像系统,美国伯乐公司(BIO-RAD Corporation);5417R 冷冻离心机,德国艾本德(Eppendorf Cor poration)公司。
1.3 试验方法
1.3.1 棉铃虫总RNA的提取
由于1、2、3龄棉铃虫的虫体较小,取整头幼虫备用;解剖4、5龄棉铃虫幼虫,截取中肠,用生理盐水(0.7%)冲洗干净后,用吸水纸将液体吸干。所有样品立即放入液氮中,之后置-80℃冰箱保存备用。采用多头提取方法,每个龄期棉铃虫所用幼虫头数分别为:1龄80头,2龄40头,3龄15头,4龄15头,5龄10头。试验重复3次。
用Invitrogen公司的Trizol试剂盒提取棉铃虫总RNA,经琼脂糖凝胶电泳检测其质量,用分光光度计检测其纯度并定量,-80℃保存。
1.3.2 cDNA的合成
先用DNaseⅠ去除RNA中的基因组DNA,再根据Invitrogen公司的Super ScriptⅢFirst-Strand试剂盒操作说明合成c DNA。
1.3.3 常规PCR模板检测
取经过消化后的RNA和反转录得到的c DNA分别用Actin引物进行常规PCR,以证明RNA中无基因组DNA污染和反转录得到的c DNA符合试验要求。
Actin-F:5′-CATCTACGAGGGTTACGC-3′,Tm 50.8℃;
Actin-R:5′-CATCTGTTGGAAGGTGGA-3′,Tm 50.8℃。
扩增长度574 bp,由Invitr ogen公司合成。
PCR反应:模板1μL,加入10×Ex Taq缓冲液5μL(含 Mg2+),正向和反向引物各1μL(10μmol/L),d NTP 4μL(2.5 mmol/L),Ex Taq DNA 聚合酶0.25μL(5 U/μL),加水至50μL,混匀。反应程序:94℃预变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min,共30个循环;72℃保温10 min。1%琼脂糖凝胶电泳查看结果。
1.3.4 实时荧光定量 PCR(real-ti me quantitative PCR,Rq-PCR)
引物及探针合成:参考Gen Bank登录号分别为AF519180、AF441377和X97615的CAD、APN1和actin基因全长设计引物。以actin为内参基因。采用Taq Man技术进行荧光定量PCR。探针5′端为FA M标记,探针3′端为Eclipse标记。q RT-PCR上游引 物 (f or war d pri mer-F)、下 游 引 物 (reverse pri mer-R)、探针(probe-P)设计序列见表1。所需引物及探针由大连宝生物公司合成。
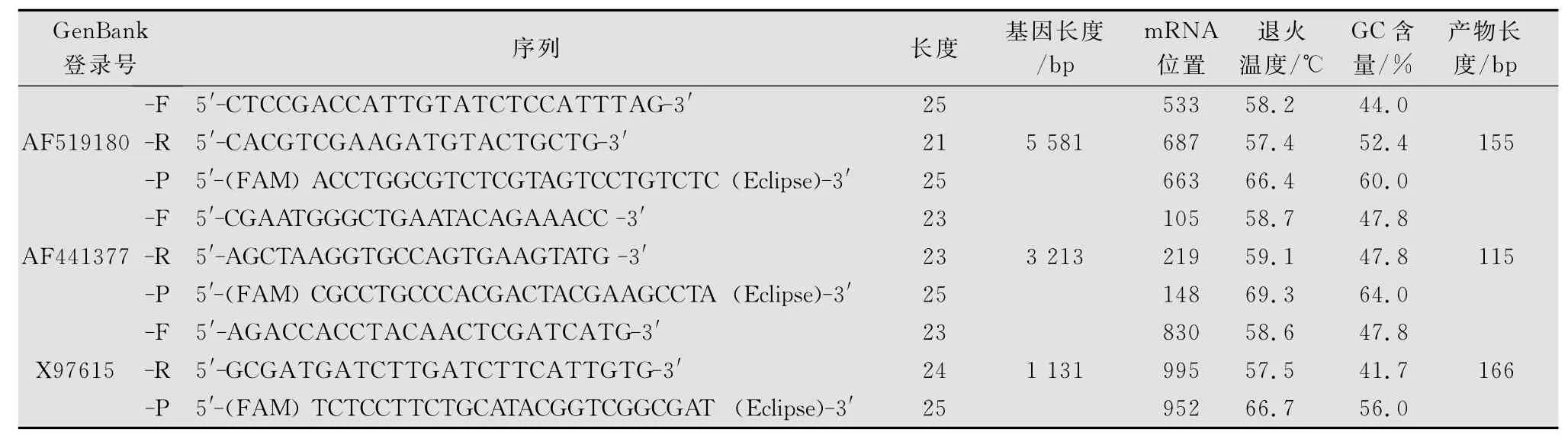
表1 实时荧光定量PCR引物及探针序列
Rq PCR反应体系:在冰上配制25μL反应体系,包括Premix Ex Taq 12.5μL,灭菌蒸馏水(dd H2O)8.7μL,正向和反向引物各1μL(10μmol/L),ROX Reference DyeⅡ(50×)0.4μL,荧光探针溶液0.4μL,c DNA 1μL,振荡器混匀。每个样品设3个重复,每个探针设3个空白对照。试验重复3次。
RqPCR反应程序:95℃预变性1 min;95℃5 s,60℃25 s,40个循环;60℃25 s期间收集荧光信号。
RqPCR引物扩增效率检验:以96S的c DNA为模板,初始浓度定为1,加水稀释5、10、50、100、500、1 000倍,得到浓度分别为0.2、0.1、0.02、0.01、0.002、0.001,加上初始浓度,共7个不同浓度的c DNA模板。以此c DNA模板,按照上述实时荧光定量PCR反应体系和程序配制反应液,每个模板设4个重复,每个基因设4个空白对照。
1.4 数据分析
表达量的计算参考Livak和Schmittgen[13]的方法,即2-△△CT法:首先,对所有测试样本和校正样本,用目的基因的CT值减去内参基因的CT值,△CT=目的基因CT-内参基因CT。然后,用校正样本的△CT值归一试验样本的△CT值,△△CT=样本的△CT-参照的△CT。最后,计算基因表达量比率,2-△△CT=样本表达量比值。分别以96S品系1龄幼虫的CAD和APN1的表达量为1进行比较。同一龄期抗、感棉铃虫表达量的差异比较采用t测验;同一品系、不同龄期间的比较采用两因素方差分析,用LSD法进行多重比较。用DPS软件对数据进行分析。
2 结果与分析
2.1 探针可靠性验证
根据反应导出的数据,以△CT(目的基因CAD\APN1的CT值减去内参基因actin的CT值)为Y轴,以不同稀释浓度的c DNA模板的-lg值为X轴作图,“C”为c DNA的相对浓度,进行探针可靠性验证。结果表明:CAD(-0.002 8)和APN1(0.020 5)的方程
斜率的绝对值都小于0.1,符合试验要求,证明试验所 设计的探针符合荧光定量PCR试验要求(图1)。

图1 CAD、APN1与β-actin探针可靠性验证
2.2 不同龄期抗、感棉铃虫CAD表达量的比较
图2显示了抗、感棉铃虫CAD的相对表达量,结果表明:与敏感品系相比,抗性品系的1龄、2龄棉铃虫CAD表达量明显降低(p值分别为0.002、0.007 3),差异达到极显著水平;但抗、感品系3龄、5龄幼虫CAD的表达量差异不显著(p值分别为0.92、0.53);抗性品系4龄幼虫的CAD表达量反而略高于敏感品系,差异达到显著水平(p=0.022)。但整体比较抗、感品系棉铃虫幼虫的CAD表达量,抗性品系幼虫的CAD表达量显著降低,差异极显著(p<0.001)。
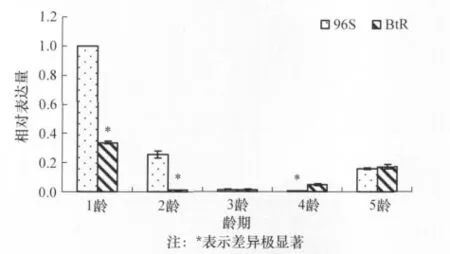
图2 抗、感品系棉铃虫的CAD相对表达量
不同龄期的棉铃虫幼虫CAD表达量差异也极显著(表2)。在敏感品系96S中,1龄幼虫CAD的表达量最高,其次是2龄、5龄幼虫,3龄、4龄幼虫的表达量最低;而在抗性品系中各龄期幼虫CAD表达量由高到低的顺序为:1龄>5龄>4龄>3龄>2龄,其中4龄、3龄、2龄间差异不显著。
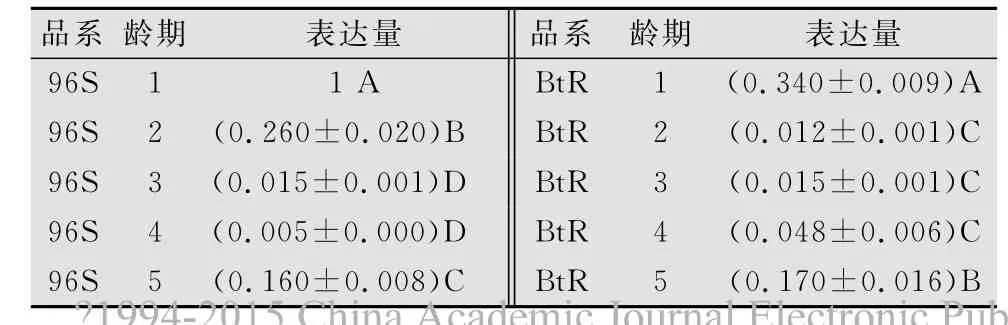
表2 不同龄期棉铃虫幼虫CAD表达量的比较1)
2.3 不同龄期抗、感棉铃虫APN1表达量的比较
抗、感棉铃虫APN1的相对表达量如图3所示,结果表明:与敏感品系相比,抗性品系的2龄棉铃虫APN1表达量明显降低(p=0.003 6),差异达到极显著水平;但抗、感品系1龄、3龄、5龄幼虫APN1的表达量差异不显著(p值分别为0.057、0.996 8、0.647 9);抗性品系4龄幼虫的 APN1表达量反而略高于敏感品系,差异达到显著水平(p=0.012)。但比较抗、感品系1龄~5龄棉铃虫幼虫整体APN1的表达量,抗性品系幼虫的APN1表达量显著低于敏感品系,差异达到极显著(p<0.001)。
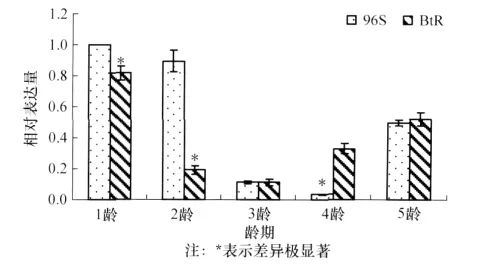
图3 抗、感品系棉铃虫的APN1相对表达量
不同龄期的棉铃虫幼虫APN1表达量差异也极显著(表3)。在敏感品系96S中,1龄、2龄幼虫APN1的表达量明显高于其他龄期幼虫,其次是5龄幼虫,3、4龄幼虫的表达量最低;而在抗性品系中各龄期幼虫APN1表达量由高到低的顺序为:1龄>5龄>4龄>2龄>3龄,各龄期间差异都达到极显著。
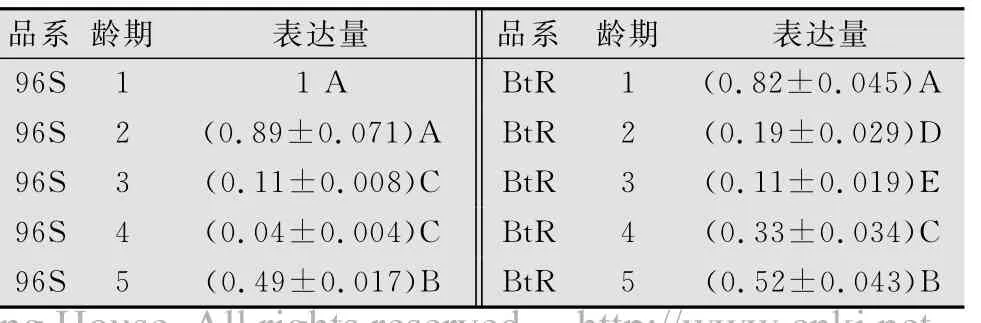
表3 不同龄期棉铃虫幼虫APN1表达量的比较1)
3 讨论
CAD的表达量及其分布在不同昆虫、不同时期是不同的,而且由于抗性的产生可能会造成表达量的不稳定。如Midboe等发现,BT-R(钙黏蛋白)只在烟草天蛾幼虫期表达,在卵和成虫期不表达,幼虫的不同发育时期表达量也不同,表达量随着幼虫虫龄增长而增加[18];王桂荣等运用RT-PCR技术,分析了钙黏蛋白基因在棉铃虫敏感品系不同组织中的表达情况,发现钙黏蛋白主要在棉铃虫中肠表达,在前、后肠表达量很低,在肠道以外的组织中不表达[19];Carriére等利用实时荧光定量PCR技术分析棉红铃虫[Pectinophor a gossy piell a (Saunders)]的钙黏蛋白基因表达量,发现钙黏蛋白在幼虫期表达量最高,在成虫和胚胎中也都表达,在敏感棉红铃虫所有时期的表达都比较稳定,但抗性品系Bt R 1龄~3龄幼虫的表达量最高,其次是4龄幼虫和成虫,在蛹和胚胎中表达量最低,且4龄幼虫前肠和中肠表达量最高[20]。作者的试验结果显示,不仅抗性棉铃虫的CAD表达量不稳定,而且敏感品系棉铃虫的CAD表达量也不稳定,1龄幼虫的表达量最高,其次是2龄、5龄幼虫,3龄、4龄表达量最低,抗性品系还表现为表达量提前降低。这进一步说明了不同龄期幼虫CAD表达量的变化趋势在不同昆虫间差异较大。
APNs在不同昆虫、不同时期体内的分布及其表达量也是不同的,如苹浅褐卷蛾(Epip hyas postvittana)已被分离的5个APN基因在整个幼虫期都表达,表达量随龄期的增大而增加,且中肠中的表达量最高[14];Angelucci等测量了棉铃虫中肠APN的表达量,发现APN1-APN4也在棉铃虫的整个幼虫期都表达[15];Crava等测定了欧洲玉米螟(Ostrinia nubilalis)幼虫期 APN的mRNA表达量,发现APN在幼虫各个龄期都表达,5龄幼虫中APNs主要在中肠表达[16]。本研究通过实时荧光定量PCR的方法,比较了不同龄期棉铃虫幼虫的APN1表达量,也发现APN1在敏感品系1龄~5龄幼虫期都表达,但表达量随龄期的增加呈现“V”字形变化,1龄、2龄幼虫的表达量最高,3龄、4龄时显著降低,到5龄时表达量又有所增加。造成这种结果的原因还需要进一步分析。
虽然抗性品系不同龄期棉铃虫的APN1表达量变化趋势与敏感品系相近,但表现为表达量提前降低,与1龄幼虫相比,2龄幼虫的表达量显著降低,2龄、3龄幼虫的表达量最低,4龄、5龄又逐渐升高。Chougule等曾报道,取食不同饲料会造成棉铃虫APNs表达量的差异[17],所以我们分析抗性品系棉铃虫一直取食含Bt毒蛋白的饲料,可能是造成APN1表达量提前降低的主要原因。
钙黏蛋白和APNs的表达量与抗性存在明显相关性,已先后通过PCR、Norther n blot、RNAi等技术在不同昆虫中得到了证实。如王桂荣等利用RTPCR技术比较了抗、感棉铃虫CAD的表达,发现棉铃虫对Cr y1 Ac产生抗性后,钙黏蛋白的表达量明显降低[19];Carriére等利用实时荧光定量 PCR 技术,发现了棉红铃虫抗性品系钙黏蛋白表达量不稳定的现象[20];Herrero等通过Nort her n blot比较了甜菜夜蛾(Spodopter a exigua)的APNs表达量,发现APN1在抗性昆虫中不表达,说明APN1的不表达与甜菜夜蛾对Cry1Ca的抗性相关[21];Rajagopal等构建了斜纹夜蛾的ds RNA,并将其注入5龄幼虫的血淋巴中,干扰了APN基因的RNA转录,48 h后处理组幼虫APN的表达比对照组减少了80%,而LC50提高了70%,证明APN的表达量与幼虫的敏感性是显著相关的[4];Yang等[22]发现 Cry1 Ab抗性小蔗螟品系中,APN1、APN2和APN3的表达量相对于敏感品系都有不同程度的下降;利用RNAi技术降低敏感昆虫体内3种APN的表达量后,敏感性伴随着APN表达量的下降而出现了下降。
作者的结果也发现抗性品系棉铃虫的CAD和APN1表达量都明显降低,尤其是1、2龄幼虫时表现明显,抗、感品系差异极显著。这也再次证明了昆虫中肠的钙黏蛋白、APN表达量的下降与抗性相关。但在试验中发现,抗性品系4龄棉铃虫幼虫的APN1和CAD表达量反而比敏感品系高,这可能与抗性品系幼虫一直取食含Bt的饲料有关。本研究在试验中采用了实时荧光定量PCR的方法测定APN1和CAD的表达量,比以前采用其他方法测定的结果具有更好的即时性、良好的重复性、特异性及准确性。这些结果将为我们进一步了解APN和CAD的功能及与抗性的关系奠定基础。
[1] FerréJ,Van Rie J.Bioche mistr y and genetics of insect resistance to Bacill us t huringiensis[J].Annu Rev Ento mol,2002,47:501-533.
[2] Pigott C R,Ellar D J.Role of receptors in Bacill us thuringiensis crystal t oxin activity[J].Microbiol Mol Biol Rev,2007,71:255-281.
[3] Gill M,Ellar D.Transgenic Dr osophil a reveals a f unctional in vivo receptor f or t he Bacill us thuringiensis toxin Cry1 Ac[J].Insect Mol Biol,2002,11:619-625.
[4] Rajagopal R,Sivaku mar S,Agrawal N,et al.Silencing of midgut a minopeptidase N of Spodopter a litur a by doublestranded RNA establishes its role as Bacill us thuringiensis t oxin receptor[J].J Biol Chem,2002,277(49):46849-46851.
[5] Vadla mudi R,Weber E,Ji I,et al.Cloning and expression of a receptor f or an insecticidal toxin of Bacill us thuringiensis[J].J Biol Chem,1995,270:5490-5494.
[6] Nagamatsu Y,Toda S,Ya maguchi F,et al.Identification of Bo mbyx mori midgut receptor f or Bacill us thuringiensis insecticidal Cry1 A(a)toxin[J].Biosci Biotechnol Biochem,1998,62:718-726.
[7] Zhang X,Candas M,Griko N B,et al.Cytotoxicity of Bacill us thuringiensis Cry1 Ab toxin depends on specific binding of the toxin to the cadherin receptor BT-R1 expressed in insect cells[J].Cell Death Differ,2005,12:1407-1416.
[8] Bravo A,Gomez I,Conde J,et al.Oligomerization triggers binding of a Bacill us thuringiensis Cry1 Ab pore-f or ming toxin to aminopeptidase N receptor leading to insertion into membrane microdomains[J].Biochi m Biophys Acta,2004,1667(1):38-46.
[9] Griffitts J S,Aroian R V.Many roads to resistance:how invertebrates adapt to Bt toxins[J].Bio Essays,2005,27(6):614-624.
[10]Wu K,Lu Y,Feng H,et al.Suppression of cotton boll wor m in multiplecrops in China in areas wit h Bt toxin-containing cotton[J].Science,2008,321:1676-1678.
[11]梁革梅,谭维嘉,郭予元.棉铃虫对转Bt基因棉的抗性筛选及遗传方式的研究[J].昆虫学报,2000,43(S1):57-62.
[12]梁革梅,谭维嘉,郭予元.棉铃虫人工饲料技术的改进[J].植物保护,1999,25(2):15-17.
[13]Livak K J,Sch mittgen T D.Analysis of relative gene expression data using real-ti me quantitative PCR and t he 2-ΔΔCTmet hod[J].Met hods,2001,25:402-408.
[14]Si mpson R M,Poulton J,Mar k wick N P.Expression levels of aminopeptidase-N genes in the lightbrown apple moth,Epiphyas postvittana[J].Insect Science,2008,15:505-512.
[15]Angelucci C,Barrett-Wilt G A,Hunt D F,et al.Diversity of aminopeptidases,derived fro m f our lepidopteran gene duplications,and polycalins expressed in t he midgut of Helicover pa ar miger a:identification of pr oteins binding t heδ-endotoxin,Cry1 Ac of Bacill us thuringiensis[J].Insect Biochem Molec Biol,2008,38:685-696.
[16]Crava C M,Bel Y,Lee S F,et al.St udy of t he a minopeptidase N gene fa mily in t he lepidopterans Ostrinia nubil alis(Hübner)and Bombyx mori (L.):Sequences,mapping and expression[J].Insect Bioche m Mol Biol,2010,40:506-515.
[17]Chougule N P,Giri A P,Sainani M N,et al.Gene expression patterns of Helicover pa ar migera gut proteases[J].Insect Bioche m Mol Biol,2005,35(4):355-367.
[18]Midboe E G,Candas M,Bulla L A.Expression of a midgutspecific cadherin BT-R1 during t he develop ment of Manduca sexta lar va[J].Co mp Biochem Physiol B,2003,135(1):125-137.
[19]王桂荣,吴孔明,梁革梅,等.棉铃虫中肠钙粘蛋白基因的克隆、表达及Cr y1 A结合区定位[J].中国科学C辑:生命科学,2004,34(6):1-10.
[20]Carriére Y,Sho walter A M,Fabrick J A,et al.Cadherin gene expression and effects of Bt resistance on sper m transfer in pink boll wor m[J].J Insect Physiol,2009,55:1058-1064.
[21]Herrero S,Gechev T,Bakker P L,et al.A Bacill us thuringiensis Cry1Ca-resistant Spodopter a exigua lacks expression of one of f our a minopeptidase N genes[J].BMC Geno mics,2005,6:96.
[22]Yang Y,Zhu Y C,Ottea J,et al.Molecular characterization and RNA interference of t hree midgut aminopeptidase N isozy mes from Bacill us thuringiensis-susceptible and-resistant strains of sugarcane borer,Diatraea saccharalis[J].Insect Bioche m Mol Biol,2010,40(8):592-603.

