一种以菱镁石和白云石混合矿物为原料的真空热还原法炼镁技术
冯乃祥,王耀武
(东北大学 材料与冶金学院,沈阳 110004)
一种以菱镁石和白云石混合矿物为原料的真空热还原法炼镁技术
冯乃祥,王耀武
(东北大学 材料与冶金学院,沈阳 110004)
提出一种以白云石和菱镁石的混合矿物为原料、以铝粉为还原剂的真空热还原炼镁,然后利用镁还原后的残渣制取氢氧化铝的工艺和技术,并进行实验研究。结果表明:以煅烧后的白云石和菱镁石混合矿物为原料的真空金属热还原炼镁,在还原温度为1 200 ℃、还原时间为2 h、铝粉过量系数为5%的条件下,镁的还原率可达89%以上,还原渣主要物相为CaO·2Al2O3,还原渣中Al2O3的含量为67%左右;该炼镁还原渣经碳酸钠和氢氧化钠的混合碱液浸出后,Al2O3的浸出率达到85%,浸出Al2O3后渣的主要成分为CaCO3;浸出液中的Al2O3以可溶解的铝酸钠存在于浸出液中,后经碳分分解制得氢氧化铝,氢氧化铝的白度达到97%。
铝热还原;铝酸钙;氧化铝;镁;菱镁石;白云石;真空热还原;浸出
金属镁是仅次于钢铁和铝的第 3大金属结构材料,也是迄今工程上所应用的密度最低的金属结构材料。由于镁及镁合金具有比强度高、导热和导电性能好,阻尼减震,电磁外屏蔽、易于机械加工和容易回收等优点,因此,广泛应用于军工、汽车及电子通讯等领域,被称为“21世纪绿色工程金属材料”[1-3]。世界上镁矿资源丰富,仅菱镁石和白云石矿的资源储量即可满足人类上千年的需求[4],而且其矿石品位高,不像铝土矿那样需要复杂的化工过程才能提取冶金级的氧化铝,菱镁矿石和白云石从矿山上开采出来后,仅进行煅烧后就可以直接用于金属镁的冶炼。除此之外,水镁石、海水提盐后的卤水和盐湖提钾后的水氯镁石都是很好的炼镁原料,可以说镁资源是少数几个取之不尽、用之不竭的资源之一[5-6]。因此,在很多金属资源逐渐枯竭以后,镁及镁材料的快速发展和应用,是人类社会生产力发展的必然趋势。
世界上炼镁的方法主要有两种[7]:一种是无水氯化镁熔盐电解法;另一种是皮江法。电解法由于电能消耗高[7-8],产生的氯气泄露和氯化物电解质渣难以处理,对环境污染和设备的腐蚀大及生产成本高等缺点[9],其所占比例越来越小。目前,世界上 80%以上的金属镁是用皮江法生产的。所谓皮江法炼镁,就是由加拿大皮江(Pidgeon)于 1941年发明的一种以煅烧后的白云石为原料、以硅铁合金为还原剂,在真空条件下制取金属镁的方法,是一种硅热还原炼镁技术[10]。我国的皮江法炼镁技术起步于 20世纪 70年代,经过几十年的发展,我国的皮江法炼镁技术得到了很大发展,在能耗、原料单耗及生产成本等方面均有大幅降低,但皮江法仍是一个高能耗、高CO2排放的冶金行业[11-12],即使采用最新的蓄热式节能技术,由原料煅烧到还原再到精炼,其能耗(包括生产硅铁还原剂的生产能耗在内)接近 10 t标煤[13-14]。皮江法炼镁冶金过程的物料平衡和工艺过程如图1所示,其还原反应可用式(1)表示。
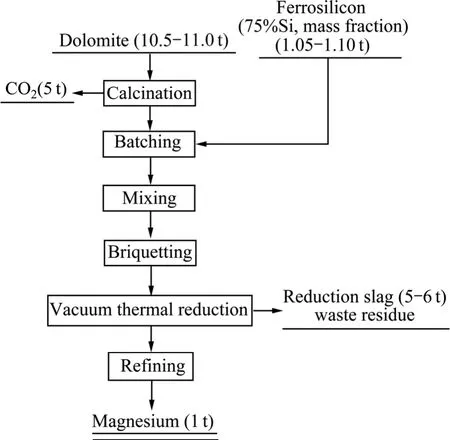
图1 皮江法炼镁工艺与物料平衡Fig.1 Flowchart and materials balance of Pidgeon process
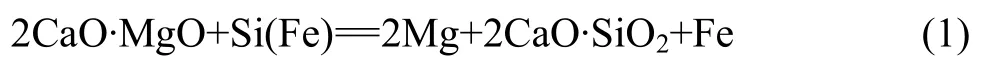
从图1的物料平衡可以看出,皮江法炼镁每还原生产1 t金属镁要排放利用价值很低或不能被利用的废渣5~6 t,矿石分解排放的CO2达5.0 t,如果加上煤气燃烧产生的CO2,则其CO2排放量超过30 t。
为了大幅度降低炼镁能耗,减少CO2和废渣排放量,2009年,冯乃祥等[15-16]发明并实验成功了一种新的炼镁技术,该技术以菱镁石和白云石两种矿物的混合物为原料或以我国辽宁特有的一种镁化白云石为原料,以再生的铝粉为还原剂进行真空还原制取金属镁,同时利用还原后排出的渣料生产氢氧化铝或氧化铝。该炼镁技术仍利用现行皮江法炼镁装置,可使原料消耗和能源消耗大幅度降低,单体设备的生产率大幅度提高,生产成本也得到一定程度的降低,与现行皮江法相比,该新方法炼镁能耗可降低40%,温室气体CO2排放可减少50%,且炼镁排放的固体渣料得到了综合利用[17],可使废渣排放量降低70%。该新法炼镁的工艺流程和物料平衡如图2所示(其中,物料平衡为本实验室的实验结果)。
由图2可以看出,新法炼镁技术所用原料中白云石约占 30%,菱镁石约占 70%。在还原过程中其料/镁质量比为(3.1~3.3):1,比传统皮江法的降低了45%以上,每生产1 t金属镁可以从炼镁渣中提取2.0~2.3 t高白度氢氧化铝。
以煅烧的白云石和菱镁石为原料、以铝粉为还原剂的真空热还原法制取金属镁,根据配料比及真空还原反应温度的不同,还原反应后所剩还原渣的物相组成可能有很大差别,也就是说,利用原料的配比和还原温度的改变,可以分别得到主要成分为CaO·Al2O3、CaO·2Al2O3或 CaO·6Al2O3的还原渣,其真空还原反应如下:
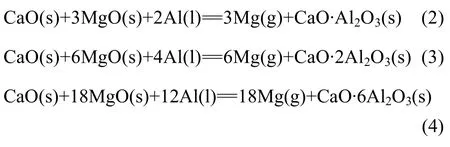
真空热还原后获得结晶镁和炼镁还原渣,结晶镁经精炼后获得金属镁,而炼镁还原渣中的主要物相为铝酸钙,铝酸钙中的氧化铝经碱液浸出后可生成可溶性的铝酸钠溶液,铝酸钠溶液经碳分后生产氢氧化铝,碳分后的溶液经处理后返回铝酸钙的浸出工序循环使用。
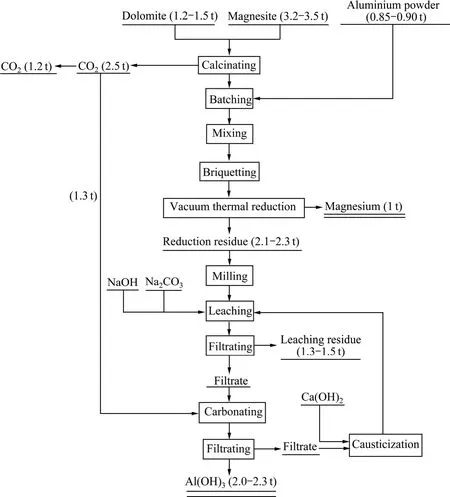
图2 新法炼镁工艺流程和物料平衡Fig.2 Flowchart and materials balance of new method
1 以菱镁石和白云石的混合矿物为原料真空铝热还原炼镁的实验研究
1.1 原料
本实验新法炼镁使用菱镁石和白云石两种矿物为原料,这两种矿物原料均产自辽宁营口大石桥地区,其主要化学成分如表1所列。
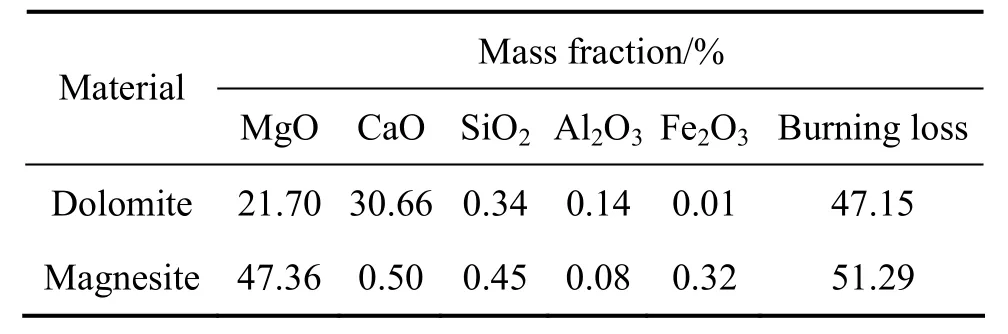
表1 白云石和菱镁矿的主要化学成分Table1 Main compositions of dolomite and magnesite
上述两种原料在作为还原反应的配料之前先进行煅烧,两种原料的煅烧温度分别为白云石1 100 ℃、菱镁石850 ℃,在此煅烧温度下煅烧1.5 h,煅烧后的矿石原料磨细到粒度小于0.1 mm,与粒度小于0.074 mm的铝粉混合后在实验室模压机上压制成尺寸d 20 mm×20 mm的块状还原反应物料,还原剂所用再生铝粉的纯度为98%。在配料过程中,既可以按化学反应方程式(2)进行配料,也可以按化学反应式(3)或(4)进行配料。按化学反应式(4)进行配料可以获得最小的还原料/镁比,但还原反应温度高,此还原反应需要在1 200 ℃以上才能进行,1 200 ℃时 CaO·6Al2O3的生成率较低,还原物料中镁的还原率较低,当温度升高到1 300 ℃以上时,按反应式(4)进行配料可获得较高的镁还原率,但在此温度下还原罐的寿命会大大降低,对生产过程造成不利影响。还原反应(3)和(2)的反应温度较低,在1 100~1 200 ℃即可获得较高的镁还原率,但与还原反应(2)相比,还原反应(3)还原过程的料/镁比较低,因此,本研究采用还原反应(3)进行配料。
1.2 实验装置
用于真空铝热还原炼镁的还原反应装置如图3所示。该装置是一个由不锈钢管制成的还原反应罐,该还原反应罐的炉外端为外部带有循环冷却水、内部置有金属套筒的镁结晶器。还原反应物料置于炉内端的还原反应罐中。整个还原反应罐是水平放置的,炉体为一个由硅碳棒加热的电阻炉,这种反应罐的结构基本上与工业上皮江法制取金属镁的还原反应罐相同,只是大小和加热方式不同而已。
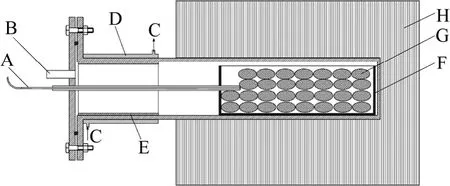
图3 炼镁装置示意图Fig.3 Schematic diagram of experimental apparatus of magnesium production: A—Thermocouple; B—Vacuum tube;C—Circulating water; D—Water-cooled jacket; E—Condenser;F—Briquettes bucket; G—Briquettes; H—Furnace
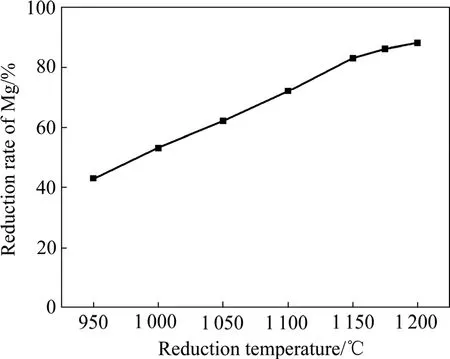
图4 铝粉过量系数为5%、制团压力为30MPa、还原时间为2 h时还原温度对镁还原率的影响Fig.4 Effect of reduction temperature on reduction ratio of Mg at excess coefficient of reductant 5%, briquetting pressure 30 MPa and reduction time 2 h
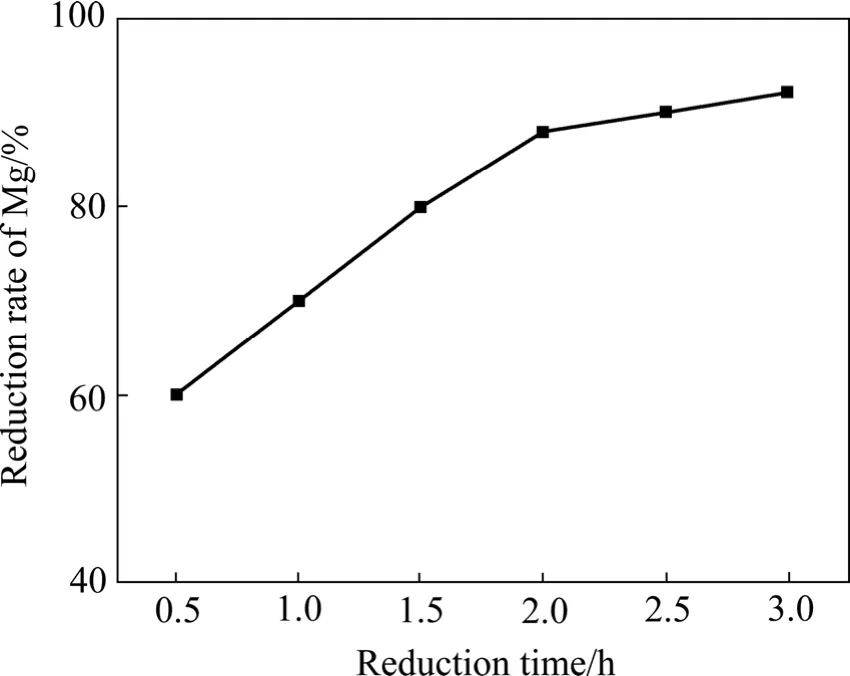
图5 铝粉过量系数为5%、制团压力为30 MPa、还原温度为1 140 ℃时还原时间对镁还原率的影响Fig.5 Effect of reduction time on reduction ratio of Mg at excess coefficient of reductant 5%, briquetting pressure 30 MPa and reduction temperature 1 140 ℃
1.3 实验结果与讨论
按照化学反应式(3)进行配料,还原反应配料中CaO·MgO 和 MgO 都是按前文所述的煅烧条件制取的。还原过程中,以镁还原率作为评价还原过程好坏的主要指标,制团压力、还原反应温度、还原剂的配料量、还原反应时间和氟化钙添加量是影响镁还原率的主要因素。氧化镁的铝热还原反应为一个吸热过程,还原反应温度越高,还原反应的速率越快,达到还原平衡的时间越短,反应越完全,镁还原率越高;还原剂加入量越多,镁还原率越高,但还原剂加入量越多,还原剂的利用率越低,增加了还原过程的成本;氟化盐的加入能够加快还原反应的进行,在还原温度一定的情况下(特别是还原温度低于1 150 ℃时)可使镁还原率提高 5%以上,在获得相同镁还原率的情况下,加入氟盐可使还原温度降低50 ℃;还原时制团压力越大,还原剂与还原物料之间的接触越紧密,导热性越好,越有利于各物质之间反应的进行,加快还原反应速率,缩短反应平衡时间,但制团压力的增加降低了团块的气孔率,增加了镁蒸汽溢出的阻力,对镁还原率有一定影响,因此,存在一个最佳制团压力范围。以上各因素对还原过程中镁还原率影响的实验结果如图4~8所示。
由图4~8可以看出,还原过程中镁还原率均随还原温度的升高、还原时间的延长、还原剂过量系数的增加而升高。当还原温度为1 200 ℃、还原剂过量系数为5%、还原时间为2 h、制团压力为30 MPa时,不加氟盐情况下镁的还原率可以达到89%,比目前工业上所用皮江法炼镁的还原率高 5%以上。还原过程中添加氟化盐后可显著提高镁还原率,在1 140 ℃时镁还原率即可达到90%以上,但氟盐的添加会对还原渣的组成有一定影响,降低后续还原渣中氧化铝的浸出率。
根据上述的实验结果可以计算出,以菱镁石和白云石为原料、以铝粉为还原剂的新法炼镁,其还原过程的料/镁质量比为(3.1~3.3):1,生产1 t镁所消耗矿石原料约5 t。
图9所示为在1 200 ℃、铝粉过量系数5%、制团压力30 MPa、还原时间2 h及不加氟盐的情况下炼镁还原渣的X射线衍射谱。由图9可知,还原后炼镁还原渣的主要物相为CaO·2Al2O3,此外,还含有少量的CaO·Al2O3、MgO·Al2O3、未反应的 MgO 和过量的单质铝。
目前,文献中关于CaO·2Al2O3化合物的物理化学性质研究较少,只在有关氧化铝生产和铝酸盐水泥生产的文献中有所报道,均认为 12CaO·7Al2O3和CaO·Al2O3较易生成,其生成温度较低,而CaO·2Al2O3和 CaO·6Al2O3的生成温度较高,CaO·2Al2O3的完全转化温度一般都在1 500 ℃以上[18-20]。而在真空铝热还原炼镁的实验中,还原反应后渣料的物相分析结果表明,在较低温度下CaO·2Al2O3即可生成,远低于文献[18-20]所给出的 CaO·2Al2O3的生成温度,其生成机理有待于进一步研究。
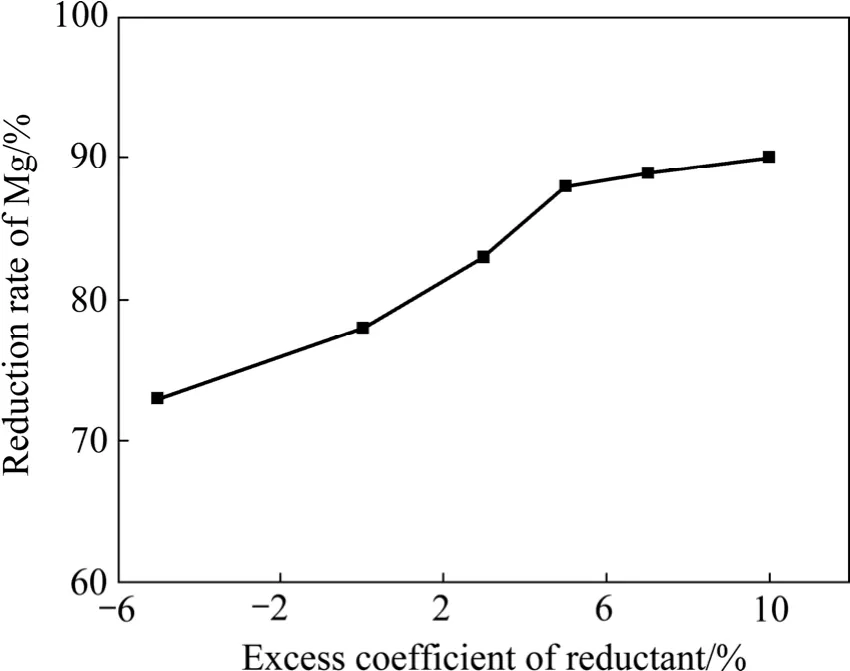
图6 制团压力为30 MPa、还原温度为1 140 ℃、还原时间为2 h时还原剂过量系数对镁还原率的影响Fig.6 Effect of excess coefficient of reductant on reduction ratio of Mg at briquetting pressure 30 MPa, reduction temperature 1 140 ℃ and reduction time 2 h
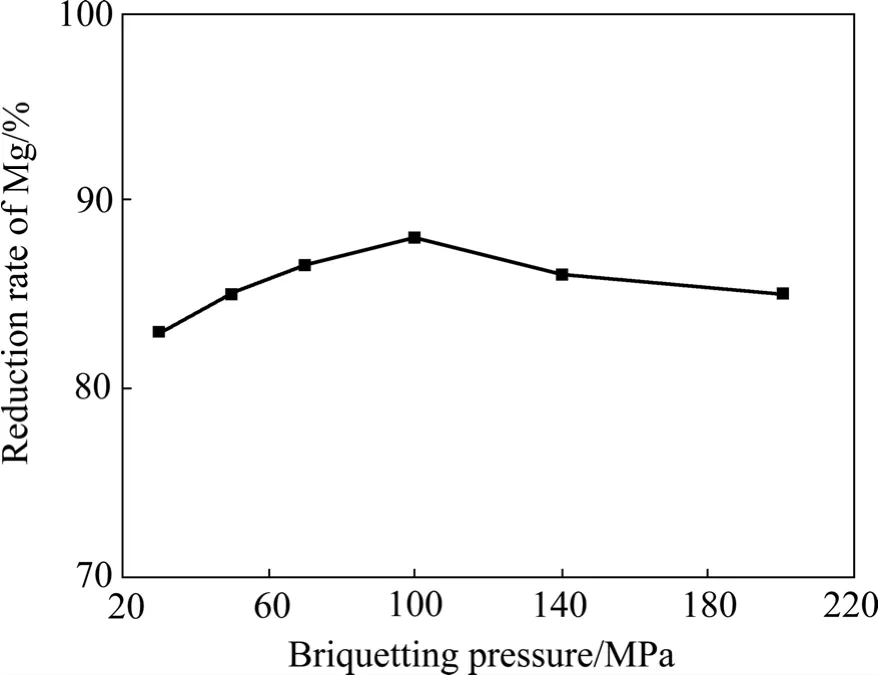
图7 还原剂过量系数为5%、还原温度为1 140 ℃、还原时间为2 h时制团压力对镁还原率的影响Fig.7 Effect of briquetting pressure on reduction ratio of Mg at excess coefficient of reductant 5%, reduction temperature 1 140 ℃ and reduction time 2 h
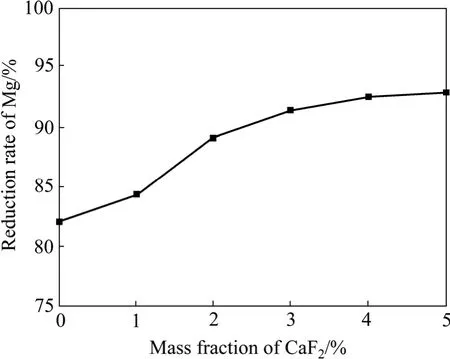
图8 还原剂的过量系数为5%、制团压力为30 MPa、还原温度为1 140 ℃、还原时间为2 h时CaF2添加剂对镁还原率的影响Fig.8 Effect of addition of CaF2 on reduction ratio of Mg at excess coefficient of reductant 5%, briquetting pressure 30 MPa, reduction temperature 1 140 ℃ and reduction time 2 h
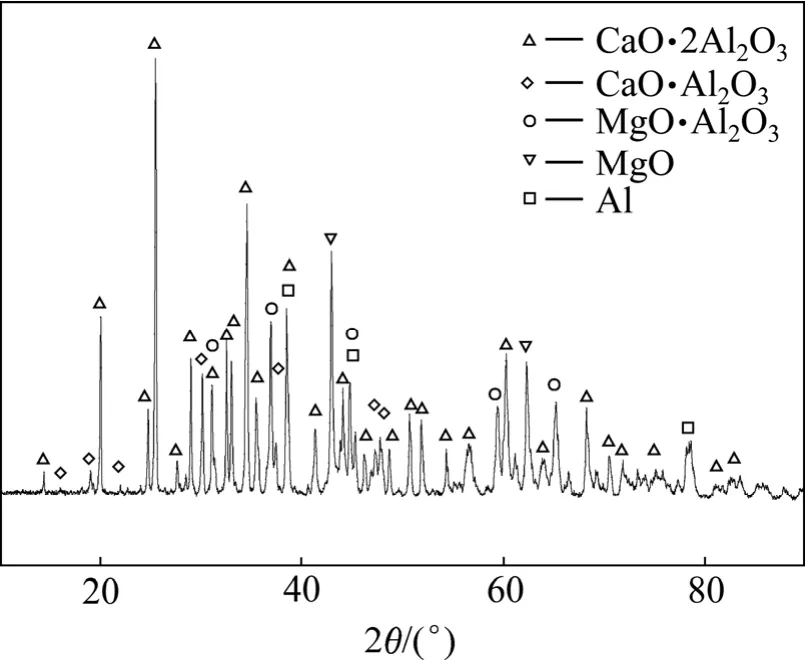
图9 还原渣的XRD谱Fig.9 XRD pattern of reduction slag
近年来,铝土矿资源紧缺,为了综合利用难处理铝土矿和非铝土矿,世界各国学者,特别是国内学者对CaO-Al2O3体系浸出生产氧化铝进行了大量研究,并取得了很大的成绩。CaO-Al2O3体系主要有3CaO·Al2O3、12CaO·7Al2O3、CaO·Al2O3、CaO·2Al2O3和CaO·6Al2O35种化合物,目前,在CaO-Al2O3体系烧结生产氧化铝方面,均采用铝矿石与石灰石混合烧结后,形成主要成分为12CaO·7Al2O3或CaO·Al2O3的熟料,然后以碳酸钠溶液为浸出液浸出其中的氧化铝[21-22]。国内外文献一般认为,12CaO·7Al2O3和CaO·Al2O3较易溶出,但 CaO·2Al2O3和 CaO·6Al2O3很难被浸出分解。本实验中,由于CaO·2Al2O3的生成温度较低,一般来说,低温生成的CaO·2Al2O3比高温生成的CaO·2Al2O3具有更高的化学反应活性,这为从CaO·2Al2O3中浸出提取氧化铝创造了有利条件。
2 从炼镁渣料中浸出氧化铝的实验研究
2.1 实验方法
上述铝热真空热还原金属镁后的还原渣料为强度不高的块状物料,渣料的主要成分为CaO·2Al2O3,还有少量的CaO·Al2O3,其化学成分列于表2。
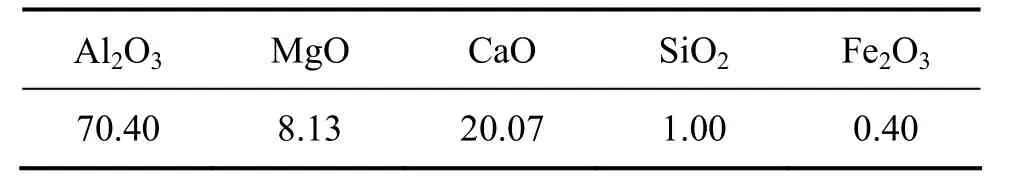
表2 炼镁还原渣的化学成分Table2 Main composition of reduction slag (mass fraction,%)
还原后的渣料中以CaO·2Al2O3和CaO·Al2O3形式存在的 Al2O3可以采用碱液浸出的方法将 Al2O3以NaAl(OH)4的形式提取出来,其浸出是在80~95 ℃的温度下进行的,其浸出过程的化学反应可用如下反应式来表示[23]:
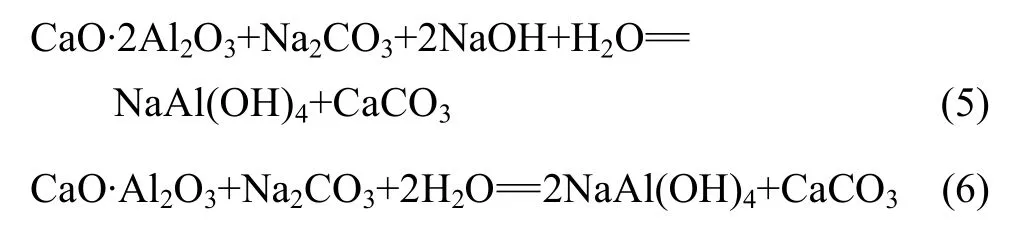
渣料中未反应的Al也可以在碱液中溶解,其溶解反应为
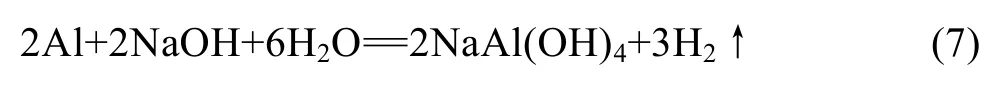
上述浸出反应完成后,所生成的 CaCO3沉淀和NaAl(OH)4溶液经液固分离后,即可获得纯铝酸钠溶液。铝酸钠溶液经CO2碳分分解后生成Al(OH)3和碳酸钠溶液,碳酸钠溶液经部分苛化后返回浸出工序进行炼镁还原渣料的浸出。在工业化生产中,其碳分分解铝酸钠溶液所用的CO2可以来自于原料白云石和菱镁石煅烧过程所排放的CO2,这样可以使原料煅烧过程排放的CO2量降低50%。
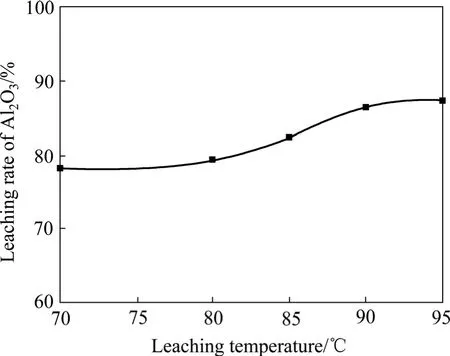
图10 浸出时间为2 h、碳酸钠用量为120 g/L、氢氧化钠用量为100 g/L时浸出温度对Al2O3浸出率的影响Fig.10 Effect of leaching temperature on leaching rate of Al2O3 at leaching time 2 h, content of sodium carbonate 120 g/L and content of sodium hydroxide 100 g/L
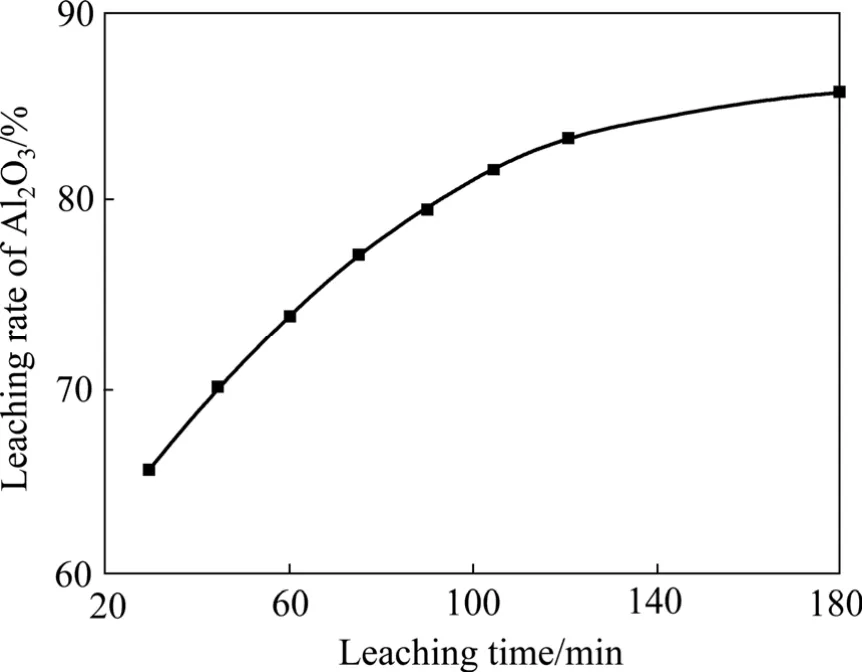
图11 浸出温度为95 ℃、碳酸钠用量为120 g/L、氢氧化钠用量为100 g/L时浸出时间对Al2O3浸出率的影响Fig.11 Effect of leaching time on leaching rate of Al2O3 at leaching temperature 95 ℃, content of sodium carbonate 120 g/L and content of sodium hydroxide 100 g/L
2.2 实验结果与讨论
影响炼镁还原渣中氧化铝浸出率的主要因素有浸出温度、浸出时间、氢氧化钠浓度和碳酸钠浓度,各因素对还原渣料中氧化铝浸出率的影响如图10~12所示。在图12中考查碳酸钠浓度对氧化铝浸出率影响时,氢氧化钠浓度为100 g/L;考查氢氧化钠浓度对氧化铝浸出影响时,碳酸钠浓度为100 g/L。
由图10~11可以看出,随着浸出温度的升高和浸出时间的延长,渣中氧化铝的浸出率呈升高趋势,但当浸出温度高于90 ℃、浸出时间超过120 min后,浸出率增加不明显。由图12可以看出,氢氧化钠浓度的变化对氧化铝的浸出率影响较大,氧化铝浸出率随着氢氧化钠浓度的增加先升高然后降低,当氢氧化钠浓度为 75 g/L时,氧化铝浸出率最大。碳酸钠浓度在80~130 g/L的范围内特别是100 g/L以上时,其变化对还原渣中氧化铝的浸出率没有明显影响。当碳酸钠浓度低于80 g/L时,氧化铝浸出直线下降。这是因为:在炼镁还原渣浸出的过程中,同时存在铝酸钠的生成反应(式(5)和(6))和水合铝酸钙的生成反应(式(8)),另外,还存在着水合铝酸钙的分解反应(式(9))。在炼镁还原渣浸出过程中,溶液中的氢氧化钠和碳酸钠均参与氧化铝的浸出反应,氢氧化铝浓度的增加有利于水合铝酸钙的生成,因此,氢氧化钠浓度增大会增加氧化铝的损失,而碳酸钠的主要作用是与还原渣中的CaO反应生成CaCO3,防止CaO与铝酸钠反应生成水合铝酸钙,另外,碳酸钠的存在还可以使生成的水合铝酸钙分解,从而减少氧化铝的损失。因此,影响碳酸钠浓度的因素主要有两个:一方面,为了避免水合铝酸钙的生成,碳酸钠浓度应高于理论值;另一方面,由于碳酸钠分解水合铝酸钠的反应为可逆反应,浸出液中碳酸钠的浓度越高,则水合铝酸钙的量越少。当液固比为5时,理论需要的碳酸钠浓度为80 g/L,根据图12可知,此时较佳的碳酸钠浓度为100 g/L。
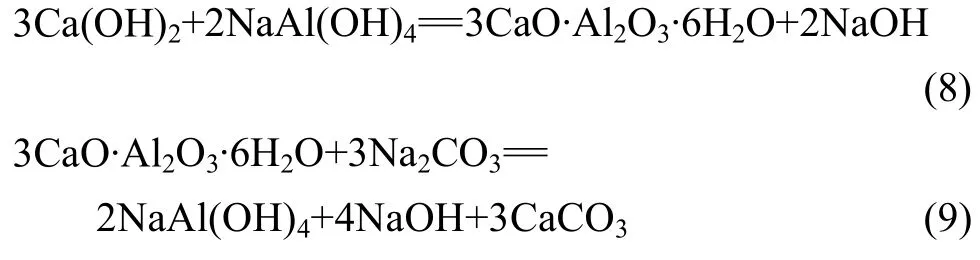
由图10~12可以看出,在浸出温度为95 ℃、浸出时间为2 h、浸出液固比为5:1、碳酸钠浓度为100 g/L、氢氧化钠浓度为75 g/L的条件下,氧化铝的浸出率可达85%以上。
将浸出渣烘干后进行X射线衍射物相分析,其分析结果如图13所示。
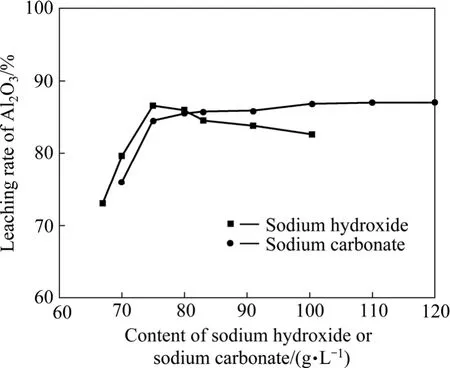
图12 浸出温度为95 ℃、浸出时间为2 h时氢氧化钠和碳酸钠浓度对Al2O3浸出率的影响Fig.12 Effect of contents of sodium carbonate and sodium hydroxide on leaching rate of Al2O3 at leaching temperature 95℃ and leaching time 2 h
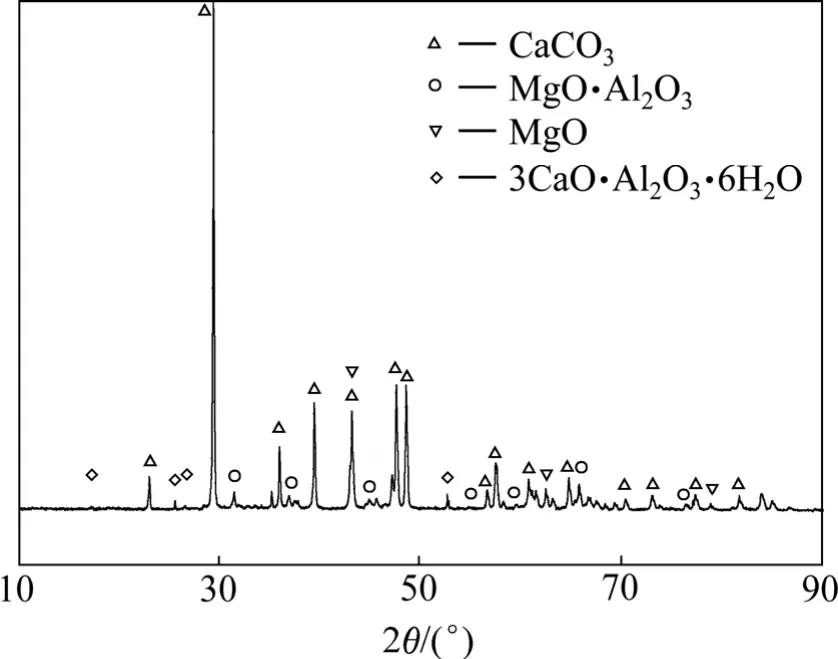
图13 浸出渣的XRD谱Fig.13 XRD pattern of leaching slag
由图13可以看出,炼镁还原渣经碱液浸出后,浸出渣的主要成分为CaCO3,此外,还有少量的MgO、镁铝尖晶石(MgO·Al2O)和水合铝酸钙,还原渣中的CaO·2Al2O3和 CaO·Al2O3全部被分解。
浸出后获得的溶液为铝酸钠溶液,该铝酸钠溶液中氧化铝的浓度为 110~140 g/L,氧化硅的浓度为0.1~0.3 g/L,该溶液经碳分后获得的氢氧化铝达到国家二级品氢氧化铝标准以上,其白度在97%以上,可视为高白氢氧化铝产品。
3 结论
1) 采用以菱镁石和白云石的混合矿物为原料、以铝粉为还原剂的新法炼镁技术,在还原温度为 1 200℃、还原剂过量系数为5%、还原时间为2 h、制团压力为30 MPa的条件下,镁还原率可以达到89%以上,还原反应后还原渣的主要物相为CaO·2Al2O3。
2) 以主要成分为 CaO·2Al2O3的炼镁还原渣为原料,经碱液浸出后,其还原渣中的氧化铝浸出率可达85%以上,浸出过程中还原渣中的CaO·2Al2O3全部被分解。
3) 根据本实验的结果可计算出,新法炼镁在还原过程中的料/镁质量比为(3.1~3.3):1,生产1 t镁的原料消耗约 5 t,与现行的皮江法相比,矿石消耗量降低50%,还原过程能耗降低45%以上,镁还原率提高5%以上,同时实现了炼镁还原渣的综合利用,是一种低能耗、低排放的炼镁技术。
REFERENCES
[1] 张新明, 彭卓凯, 陈健美, 邓运来. 耐热镁合金及其研究进展[J]. 中国有色金属学报, 2004, 14(9): 1443-1448.
ZHANG Xin-ming, PENG Zhuo-kai, CHEN Jian-mei, DENG Yun-lai. Heat-resistant magnesium alloys and their development[J]. The Chinese Journal of Nonferrous Metals,2004, 14(9): 1443-1448.
[2] SUJIT D. Primary magnesium production costs for automotive applications[J]. Journal of the Minerals, Metals and Materials Society, 2008, 60(11): 63-69.
[3] HANKO G, ANTREKOWITSCH H, EBNER P. Recycling automotive magnesium scrap[J]. JOM, 2002, 54(2): 51-54.
[4] 鲍荣华, 周进生. 注重镁的研发与应用拓宽节约能源新途径[J]. 资源与产业, 2009, 11(5): 92-95.
BAO Rong-hua, ZHOU Jin-sheng. Magnesium can be used for saving energy[J]. Resource and Industries, 2009, 11(5): 92-95.
[5] ZHOU Ning-bo, CHEN Bai-zhen, HE Xin-kuai, LI Yi-bing.Preparation of anhydrous magnesium chloride in a gas-solid reaction with ammonium carnallite[J]. Frontiers of Chemistry in China, 2006, 1(4): 384-388.
[6] 马鸿文, 曹 瑛, 蒋 芸, 吴秀文, 刘玉芹. 中国金属镁工业的环境效应与可持续发展[J]. 现代地质, 2008, 22(5): 829-835.
MA Hong-wen, CAO Ying, JIANG Yun, WU Xiu-wen, LIU Yu-qin. Environmental impacts and sustainable developments of magnesium smelting industry in China: A review[J]. Geology Science, 2008, 22(5): 829-835.
[7] 彭建平, 冯乃祥, 高 枫, 谭亚菊, 陈 恒. 镁冶金技术的能耗与环境评价[J]. 有色矿冶, 2008, 24(1): 40-45.
PENG Jian-ping, FENG Nai-xiang, GAO Feng, TAN Ya-ju,CHEN Heng. Environmental impact and energy consumption of different magnesium reductions[J]. Non-ferrous Mining and Metallurgy, 2008, 24(1): 40-45.
[8] SUN Ze, ZHANG He-nan, LI Ping, LI Bing, LU Gui-min.Modeling and simulation of the flow field in the electrolysis of magnesium[J]. Journal of the Minerals, Metals and Materials Society, 2009, 61(5): 29-33.
[9] LEBEDEV O A, BRUSAKOV Y, SHKURYAKOV N P. Express monitoring of MgCl2concentration in the electrolyte of magnesium electrolyzers[J]. Russian Journal of Applied Chemistry, 2005, 78(8): 1276-1279.
[10] MINIĆ D, MANASIJEVIĆ D, ÐOKIĆ J, ŽIVKOVIĆ D,ŽIVKOVIĆ Ž. Silicothermic reduction process in magnesium production[J]. Journal of Thermal Analysis and Calorimetry,2008, 93(2): 411-415.
[11] 高 峰, 聂祚仁, 王志宏, 左铁镛. 中国皮江法炼镁的资源消耗和环境影响分析[J]. 中国有色金属学报, 2006, 16(8):1456-1461.
GAO Feng, NIE Zuo-ren, WANG Zhi-hong, ZUO Tie-yong.Resource depletion and environmental impact analysis of magnesium produced using Pidgeon process in China[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(8): 1456-1461.
[12] 徐日瑶, 刘荣义, 刘宏专. 节能、降耗、减排是硅热法炼镁发展的生命力[J]. 轻金属, 2009(1): 45-49.
XU Ri-yao, LIU Rong-yi, LIU Hong-zhuan. Energy-saving,consumption reducing and discharge abatement are the vitality of silicothermic reduction in magnesium metallurgy[J]. Light Metals, 2009(1): 45-49.
[13] GAO Feng, NIE Zuo-ren, WANG Zhi-hong, GONG Xian-zheng,ZUO Tie-yong. Life cycle assessment of primary magnesium production using the Pidgeon process in China[J]. The International Journal of Life Cycle Assessment, 2009, 14(5):480-489.
[14] MINIC D, MANASIJEVIC D, DOKIC J. Silicothermic reduction process in magnesium production[J]. Journal of Thermal Analysis and Calorimetry, 2008, 92(2): 411-415.
[15] 冯乃祥, 王耀武, 胡文鑫. 以MgO/CaO摩尔比大于1的物料为原料真空还原制取金属镁的方法: 中国, 101942572A[P].2011-01-12.
FENG Nai-xiang, WANG Yao-wu, HU Wen-xin. A new method of producing magnesium by vacuum aluminothermic reduction using materials which the ratio of MgO and CaO is over 1: China,101942572A[P]. 2011-01-12.
[16] 冯乃祥, 王耀武, 胡文鑫. 从以铝或铝合金为还原剂制取金属镁的副产物中提取氢氧化铝和氧化铝的方法: 中国,101845550A[P]. 2010-09-29.
FENG Nai-xiang, WANG Yao-wu, HU Wen-xin. A new method of extracting aluminum hydroxide from the magnesium melting slag using aluminum and aluminum alloys as reductant: China,101845550A[P]. 2010-09-29.
[17] HU Wen-xin, FENG Nai-xiang, WANG Yao-wu. Magnesium production by vacuum aluminothemic reduction of a mixture of calcined dolomite and calcined magnesite[C]//2011 Magnesium Tchnology. SanDiego: The Minerals, Metals & Materials Society,2011: 43-47.
[18] DAS S K, MITRA A, DAS PODDAR P K. Thermal analysis of hydrated calcium aluminates[J]. Journal of Thermal Analysis,1996, 47: 765-768.
[19] 陈肇友, 柴俊兰. 六铝酸钙材料及其在铝工业炉中的应用[J].耐火材料, 2011, 45(2): 123-125.
CHEN Zhao-you, CHAI Jun-lan. Calcium hexaluminate (CA6)material and its application in aluminium industry[J].Refractories, 2011, 45(2): 123-125.
[20] SINGH V K. Sintering study of calcium aluminate[J]. Journal of Materials Science A, 1996, 31: 5163-5168.
[21] GAWLICKI M, WCZELIK W, PYZALSKI M. Studies on the hydration of calcium aluminates[J]. Journal of Thermal Analysis,1984, 29: 1005-1008.
[22] 孙会兰, 涂赣峰, 毕诗文. 七铝十二钙的合成及其在高碳钠铝酸钠溶液中的浸出性能[J]. 轻金属, 2007(11): 17-19.
SUN Hui-lan, TU Gan-feng, BI Shi-wen. Synthesization of Ca12Al7and its leaching property in sodium aluminate solution with high-Na2Oc[J]. Light Metals, 2007(11): 17-19.
[23] WANG Yao-wu, FENG Nai-xiang, YOU Jing, PENG Jian-ping,DI Yue-zhong. Study on extracting aluminum hydroxide from reduction slag of magnesium smelting by vacuum aluminothermic reduction[C]//Light Metals. SanDiego: The Minerals, Metals & Materials Society, 2011: 205-209.
A method of producing magnesium by vacuum thermal reduction using magnesite and dolomite as materials
FENG Nai-xiang, WANG Yao-wu
(School of Materials and Metallurgy, Northeastern University, Shenyang 110004, China)
The experiments of a new method of producing magnesium and aluminum hydroxide as by-product using dolomite and magnesite as materials and aluminum powder as reductant were studied. The results show that when magnesium is produced by vacuum aluminothermic reduction using the mixture of calcined dolomite and calcined magnesite as materials, the reduction ratio of Mg can be over 89% under the conditions of reduction temperature 1 200 ℃,reduction time 2 h, and the excess coefficient of reductant 5%. The main phase of the reduction slag is CaO·2Al2O3and the content of alumina is about 67%. The Al2O3leaching rate of reduction slag reaches 85% when the reduction slag is leached with a mixture of sodium hydroxide and sodium carbonate. The main phase of leaching slag is CaCO3. The Al2O3enters into the leaching solution with soluble sodium aluminate. Aluminum hydroxide with whiteness of over 97% can be obtained after carbonation precipitation.
aluminothermic reduction; calcium aluminate; aluminum oxide; magnesium; dolomite; magnesite; vacuum thermal reduction; leaching
TF803.21
A
1004-0609(2011)10-2678-09
2010-05-08;
2011-07-26
冯乃祥,教授,博士;电话:024-83686463;E-mail: Fengnaixiang@163.com

