电沉积方法制备镍硫析氢电极及其电化学性能
王华,段成林
(大连理工大学化工环境与生命学部化工学院,辽宁 大连 116023)
【电沉积技术】
电沉积方法制备镍硫析氢电极及其电化学性能
王华*,段成林
(大连理工大学化工环境与生命学部化工学院,辽宁 大连 116023)
采用恒电流电沉积方法制备Ni–S电极,通过极化曲线研究了硫脲质量浓度、电流密度、镀液温度、电沉积时间等对Ni–S电极析氢性能的影响,获得了较佳的制备工艺:NiSO4·6H2O 187.2 g/L,硫脲100 g/L,H3BO340 g/L,NaCl 20 g/L,pH = 4,电流密度30 mA/cm2,镀液温度55 °C和电沉积时间120 min。通过扫描电镜、能谱分析和X射线衍射对Ni–S镀层进行了表征,比较了在不同电流密度下,Ni–S电极和纯镍电极、低碳钢电极在25 °C、6 mol/L NaOH溶液中的析氢过电位,并对Ni–S电极的电化学性能进行了研究。结果表明,Ni–S镀层结构致密,呈现出明显的非晶态,主要由Ni和S元素组成,其中S含量为13.61%。当电流密度为100 mA/cm2时,Ni–S电极的析氢过电位比纯镍电极低309 mV,比低碳钢电极低354 mV。在60 ~ 90 °C内,随着电解液温度的升高,Ni–S电极的析氢过电位降低,90 °C时析氢过电位为63 mV。电极反应在不同的电流密度下遵循不同的反应机理,当电流密度为0.1 ~ 1.0 A/cm2时,析氢反应的表观活化能为19.57 kJ/mol。在150 mV的过电位下,电极的阻抗谱由2个容抗弧构成,含有Hads赝电容。
镍硫电极;电沉积;电化学;析氢;过电位
1 前言
随着经济的高速发展,水电解制氢装置的应用范围越来越广,研制高催化活性的新型电极,对于降低电解能耗具有十分重要的意义。电解水制氢是现有成熟制氢技术中最具应用前景的一种[1],但目前使用的Fe电极和Raney-Ni电极由于较高的析氢过电位,导致制氢能耗偏高[2-6]。因此,要实现大规模开发应用氢能,必须大幅降低析氢阴极的过电位。Ni–S及其多元合金电极因具有较低的析氢过电位而成为制氢阴极的研究热点[7-11]。
2 实验
2. 1 电极制备
阴极基体为低碳钢片,尺寸为1 cm × 5 cm。预处理流程为:碱洗除油(10% NaOH溶液)─去离子水洗涤─化学抛光(30 mL H2SO4+ 50 mL H3PO4+ 10 mL HNO3+ 0.5 ~ 1.0 g/L CrO3,100 °C)─自来水冲洗─去离子水洗涤─活化处理(5% HCl溶液)─去离子水冲洗─电沉积。阳极为镍板,尺寸为2.6 cm × 5.0 cm。
镀液基础配方:

采用单阴极双阳极,温度35 ~ 65 °C,电流密度10 ~ 40 mA/cm2,电镀时间30 ~ 180 min,CS(NH2)2(硫脲)50 ~ 125 g/L。
2. 2 电极的表征
利用日本电子公司的JSM-6360LV扫描电子显微镜(SEM)对镀层表面形貌进行观察,并用其配备的Oxford INCA的X射线能谱仪(EDS)对镀层元素进行组成分析。镀层的晶相组成用日本理学的D/MAX-2400型X射线衍射仪(XRD)进行分析,铜靶(40 kV,100 mA),步长0.02°,扫描范围为10° ~ 80°。
2. 3 电化学性能测量
实验溶液为6 mol/L NaOH溶液,若无特殊说明测试温度为25 °C。根据能斯特方程,算得25 °C时氢的平衡电极电位为:-1.118 V(相对于饱和甘汞电极)。
2. 3. 1 动电位极化曲线测量
实验仪器为科思特仪器有限公司的CS300电化学工作站,采用三电极体系,研究电极为自制的Ni–S电极(用环氧树脂密封,使电极工作面积为1 cm2),辅助电极为铂电极,参比电极为饱和甘汞电极(SCE),扫描电位区间为-0.9 ~ -1.6 V(相对于SCE),扫速1 mV/s。
析氢过电位η析氢的计算公式为:

2. 3. 2 电化学阻抗谱(EIS)测试
仪器为 Princeton Potentiostat/Galvanostat Model 283恒电位仪和1025频率响应仪。在过电位分别为0、50和150 mV下进行,选择振幅值为5 mV的正弦交流微干扰信号,在100 kHz ~ 10 mHz的频率范围内自高频向低频进行对数扫描。使用 ZSimpWin软件对阻抗数据进行解析与拟合。
3 结果与讨论
3. 1 电极制备条件对电极析氢性能的影响
3. 1. 1 硫脲质量浓度
图1示出了不同硫脲质量浓度制备的Ni–S电极在6 mol/L NaOH中的极化曲线,镀液温度45 °C,电流密度10 mA/cm2,电镀时间30 min。
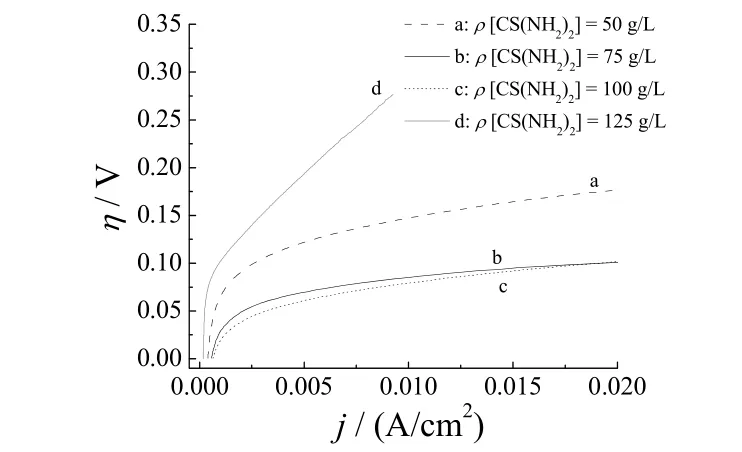
图1 不同硫脲质量浓度制备的Ni–S电极的极化曲线Figure 1 Polarization curves of Ni–S electrodes prepared with different mass concentrations of thiourea
由图1可以看出,硫脲质量浓度从50 g/L升高到100 g/L时,Ni–S电极的析氢过电位逐渐降低,但是当硫脲质量浓度加大到 125 g/L时,析氢过电位反而增大。这与镀层中的硫含量有关[12]。随着硫脲浓度的增大,镀层中硫的含量也在增大,但只有当硫含量适中时,合金电极才具有较高的活性。而且实验中发现,随着硫脲浓度的增大,镀层的毛刺变得越来越长,结合力越来越差。因此,将硫脲质量浓度控制在100 g/L。
3. 1. 2 电镀时间
不同电沉积时间制备的 Ni–S电极在 6 mol/L NaOH中的极化曲线如图2所示,CS(NH2)2100 g/L,电流密度10 mA/cm2,镀液温度45 °C。
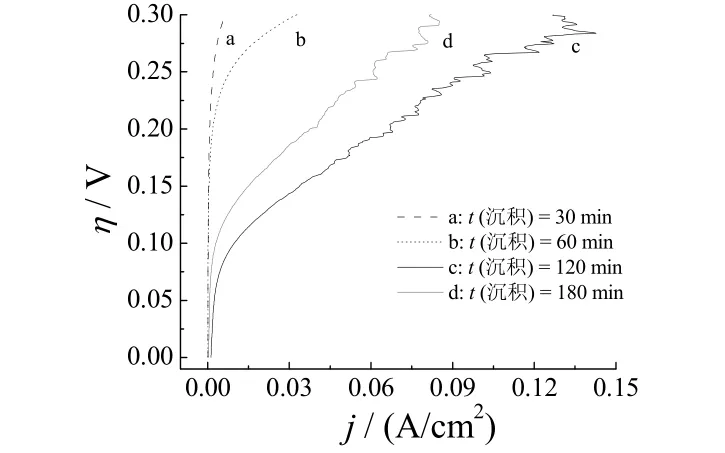
图2 不同电沉积时间制备的Ni–S电极极化曲线Figure 2 Polarization curves of Ni–S electrodes prepared for different electrodeposition time
由图2可以看出,电沉积时间由30 min增加到120 min的过程中,相同电流密度下Ni–S电极的析氢过电位降低。当电沉积时间达到180 min时,析氢过电位又升高了。因此,电沉积时间以120 min最适宜。
3. 1. 3 电流密度对电极性能的影响
图3为不同电流密度下电沉积制备的Ni–S电极在6 mol/L NaOH中的极化曲线,CS(NH2)2100 g/L,镀液温度45 °C,电沉积时间120 min。它表明,在析氢电流密度小于100 mA/cm2时,在40 mA/cm2下电沉积制备的Ni–S电极在同一析氢电流密度下的析氢过电位最低,性能最好;当析氢电流密度超过130 mA/cm2时,在30 mA/cm2条件下制备的Ni–S电极在相同析氢电流下的析氢过电位达到最低,性能最好。

图3 不同电流密度制备的Ni–S电极的极化曲线Figure 3 Polarization curves for Ni–S electrodes prepared at different current densities
但是从观察电极表面形貌以及电解实验发现,随着电流密度的增加,沉积物越来越粗糙,镀层与基体的结合力降低,很容易脱落。所以电流密度取30 mA/cm2。
3. 1. 4 镀液温度
不同镀液温度下制备的Ni–S析氢电极在6 mol/L NaOH中的极化曲线如图4所示,CS(NH2)2100 g/L,电流密度30 mA/cm2,电镀时间120 min。
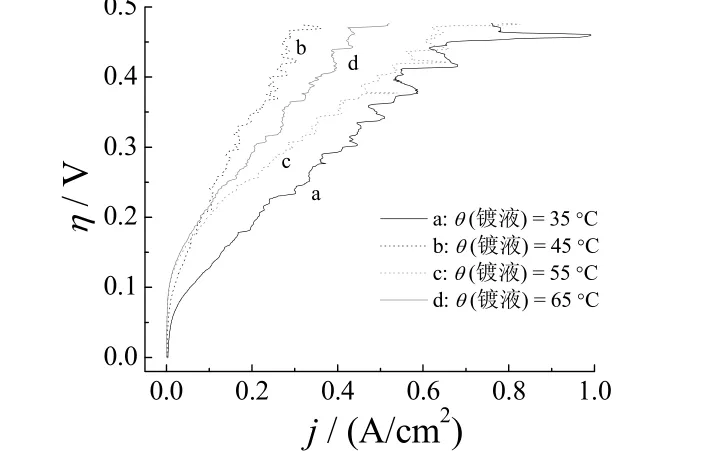
图4 不同镀液温度下制备的Ni–S电极的极化曲线Figure 4 Polarization curves for Ni–S electrodes prepared at different temperatures of electroplating bath
由图4可以看出,35 °C下制备的Ni–S电极的析氢反应活性似乎最好,然而在电解实验做完后发现,镀层与基体脱落,用吹风机一吹就有部分脱落。因此,很可能是由于镀层的两面都在发生析氢反应,且反应面积大于1 cm2,导致析氢电流很大。所以此温度不予考虑。随温度的升高,离子扩散和迁移速度增大,降低了镀层的内应力,所以当温度达到45 °C后,镀层与基体的结合力良好。当析氢电流密度在100 mA/cm2时,另3种温度下的析氢过电位相差不大,都在200 mV左右。当析氢电流密度大于100 mA/cm2时,55 °C下制备的电极在同一析氢电流密度下的析氢过电位低于45 °C和65 °C下制备的电极。这是两种机制相互作用的结果:当其他条件不变时,升高镀液温度,会降低阴极极化,导致结晶变粗;另一方面,温度升高,又能提高阴极电流密度上限,增大阴极极化,有利于形成细晶镀层。因此,当镀液温度为55 °C时,镀层具有良好的析氢性能。
综上所述,制备 Ni–S析氢电极的较佳条件为:NiSO4·6H2O 187.2 g/L,CS(NH2)2100 g/L,H3BO340 g/L,NaCl 20 g/L,pH 4,电流密度30 mA/cm2,镀液温度55 °C,时间120 min。
3. 2 电极的电化学性能
图5是以上述较佳工艺制备的Ni–S电极和纯镍电极、低碳钢电极在25 °C、6 mol/L NaOH电解液中的极化曲线。可以看出,在相同的电流密度下,所制备的Ni–S电极的过电位明显小于其他两种电极。
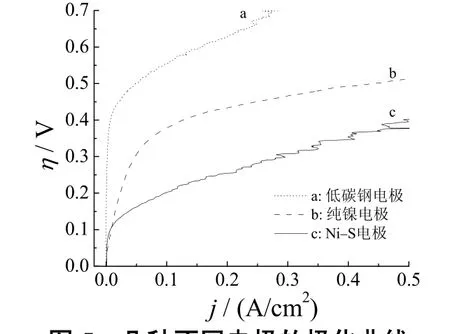
图5 几种不同电极的极化曲线Figure 5 Polarization curves for several electrodes
表1给出了各种电极分别在不同电流密度下的析氢过电位。在100 mA/cm2电解时,Ni–S电极的析氢过电位比纯镍电极低309 mV,比低碳钢电极低354 mV。这对降低电解槽槽电压、节约能源有重大意义。

表1 不同电流密度下几种电极的析氢过电位Table 1 Hydrogen evolution overpotentials on several electrodes at different current densities
图 6 示出 Ni–S析氢电极在不同温度的 6 mol/L NaOH溶液中的Tafel极化曲线。
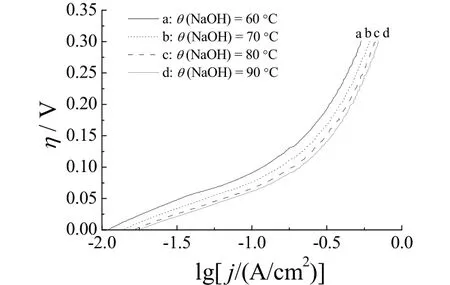
图6 Ni–S电极在不同温度NaOH溶液中的极化曲线Figure 6 Polarization curves for Ni–S electrodes in NaOH solution at different temperatures
由图 6可以看出,随着电解液温度的升高,析氢过电位降低。在高温条件下电解时,Ni–S电极的析氢反应过电位已经达到很低的程度。在90 °C下,当析氢反应电流密度为0.1 A/cm2时,析氢过电位为63 mV;当析氢电流密度为0.3 A/cm2时,过电位也只有143 mV。
由图6的Tafel曲线还发现,不同电解温度下的极化曲线在低电流密度区和高电流密度区有不同的斜率,表明电极反应在两个电流密度区遵循不同的反应机理。对电流密度为0.01 ~ 0.10 A/cm2的塔菲尔段作线性拟合,其电化学参数见表2。

表2 不同温度下Ni–S电极析氢反应的电化学参数Table 2 Electrochemical parameters of Ni–S electrode for hydrogen evolution reaction at different temperatures
根据表2,在低电流密度区,Ni–S电极的交换电流密度j0为9.85 ~ 17.57 mA/cm2,大于文献[13]报道的0.81 ~ 4.36 mA/cm2。而且,Tafel斜率随温度的升高而减小。可能是传递系数a值随温度升高而增大。
将ln j0对1/T作图得图7。
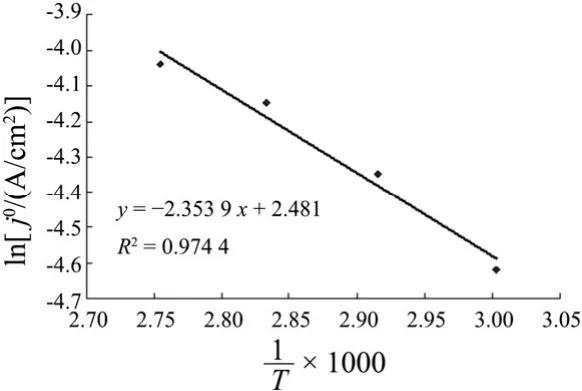
图7 lnj0–1/T图Figure 7 lnj0–1/T diagram
根据Arrhenius公式:

可知Ni–S析氢电极的表观活化能∆H = K × R,所以电流密度为0.01 ~ 0.10 A/cm2时,析氢反应表观活化能为19.57 kJ/mol,远低于Ni电极的35 kJ/mol[14]。因此,Ni–S析氢电极具有良好的析氢活性。有文献[13]报道,Ni–S电极析氢活化能高于镍电极,有利于高温反应。
图8是不同过电位下的电化学阻抗图。
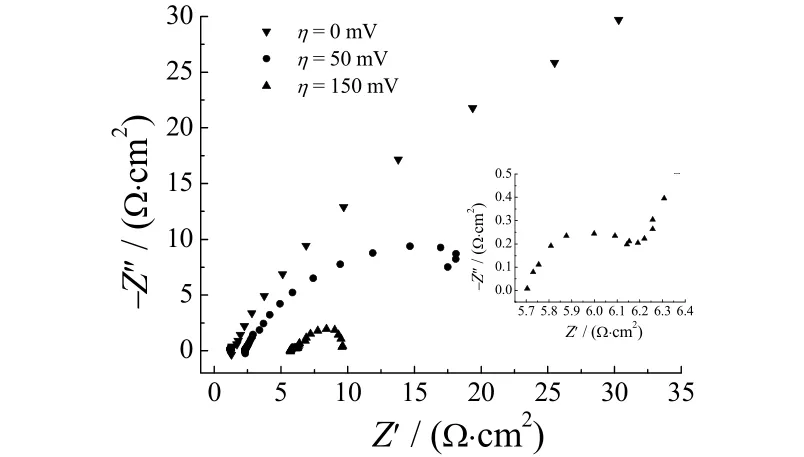
图8 Ni–S电极在不同过电位下的电化学阻抗图Figure 8 EIS plots of Ni–S electrode at different overpotentials
由图8可以看出,过电位为0 mV和50 mV的电化学阻抗图谱只有一个压扁的半圆,因此可以用图9a的等效电路来模拟。而过电位为150 mV的阻抗谱由2个半圆构成(图8内插为高频放大),用图9b中的等效电路来模拟。其中,Rs是溶液电阻,Zcpe为双电层电容,Rct是电荷迁移阻力,Zcpe1为赝电容(吸附 Hads中间态),R1与吸附Hads中间态的物质传递阻力相关。拟合结果见表3。

图9 等效电路图Figure 9 Equivalent circuits diagram

表3 电化学阻抗谱等效电路拟合结果Table 3 Fitted data of equivalent circuit of electrochemical impedance spectra
由表 3可以看出,随着过电位增大,电荷传递阻力下降。即电荷迁移阻力由0 mV时的106.8 Ω·cm2下降为150 mV时的0.705 Ω·cm2,表明析氢反应速度增加。根据极化曲线,150 mV时,电极表面已经明显有氢气析出。
3. 3 电极表征
图10为所制备的Ni–S电极的SEM 图与能谱分析图。可以发现,镀层由紧密堆积的菜花状结构组成,具有很高的表面粗糙度,所以表面活性高,活化能低。能谱分析表明,电极主要由Ni和S元素组成,其中S含量为13.61%。
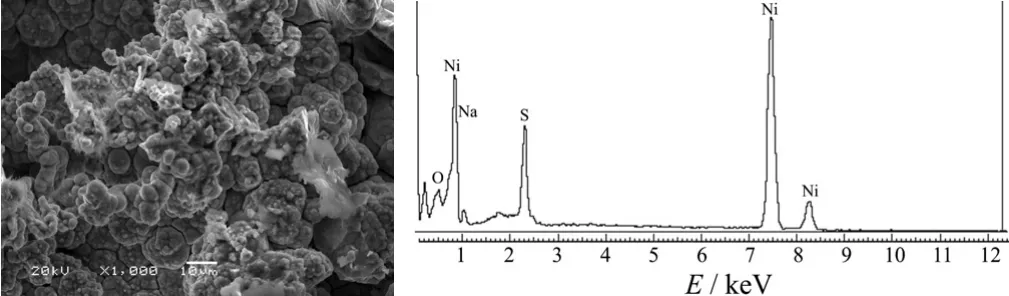
图10 Ni–S电极的SEM照片与能谱图Figure 10 SEM image and EDS diagram of Ni–S electrode
图11 为Ni–S电极的XRD谱图。
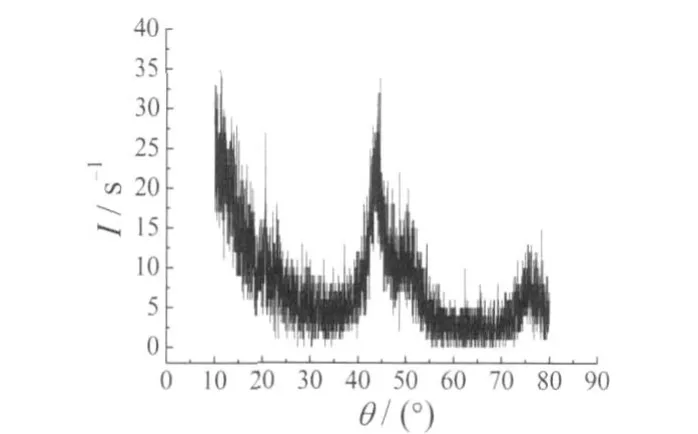
图11 Ni–S电极的XRD谱图Figure 11 XRD spectrum of Ni–S electrode
由图11可以看出,在45°左右出现镍峰,并且镍峰比较平缓。这说明Ni–S镀层呈现出明显的非晶态,所以析氢催化活性比较好。
4 结论
恒电流电沉积制备 Ni–S电极较适宜的条件是:NiSO4·6H2O 187.2 g/L,CS(NH2)2100 g/L,H3BO340 g/L,NaCl 20 g/L,pH = 4,电流密度30 mA/cm2,镀液温度55 °C,时间120 min。所得镀层呈紧密堆积的菜花状结构,主要由Ni和S元素组成。在25 °C、6 mol/L NaOH 中,以 100 mA/cm2的电流密度电解时,Ni–S电极的析氢过电位比纯镍电极低309 mV。随着电解液温度的升高,析氢过电位降低,90 °C时析氢过电位为63 mV。在电流密度为0.01 ~ 0.10 A/cm2时,Ni–S电极的析氢反应表观活化能为19.57 KJ/mol。电化学阻抗测试表明,在高过电位下,电极的阻抗谱由 2个容抗弧构成。
[1] 池凤东. 实用氢化学[M]. 北京: 国防工业出版社, 1996.
[2] HU C-C, WU Y-R. Bipolar Performance of the electroplated iron–nickel deposits for water electrolysis [J]. Materials Chemistry and Physics, 2003, 82 (3): 588-596.
[3] SHAFIA HOOR F, ARAVINDA C L, AHMED M F, et al. Fe–P and Fe–P–Pt co-deposits as hydrogen electrodes in alkaline solution [J]. Journal of Power Sources, 2001, 103 (1): 147-149.
[4] 刘萍, 唐致远, 宋全生, 等. Ni–Mo合金电极的制备条件对其析氢性能的影响[J]. 电镀与精饰, 2006, 28 (3): 11-14.
[5] 高润生, 苏清茂, 张斌, 等. 低氢过电位Raney Ni–Mo活性阴极的研究[J]. 氯碱工业, 1994 (3): 9-11.
[6] 王龙彪, 黄清安, 陈永言, 等. 电沉积镍–钴–磷合金析氢反应电催化行为的研究[J]. 电镀与涂饰, 1998, 17 (4): 1-3, 11.
[7] 何捍卫, 刘红江, 刘芳, 等. 泡沫镍基镍硫合金涂层形貌、结构和析氢性能研究[J]. 功能材料, 2006, 37 (1): 87-91.
[8] 杜敏, 高荣杰, 蒲艳丽. 电沉积Ni–S合金作碱液电解活性阴极的研究进展[J]. 腐蚀科学与防护技术, 2001, 13 (增刊): 544-546.
[9] WEN T-C, LIN S-M, TSAI J-M. Sulphur content and the hydrogen evolving activity of NiSxdeposits using statistical experimental strategies [J]. Journal of Applied Electrochemistry, 1994, 24 (3): 233-238.
[10] HAN Q, LIU K R, CHEN J S, et al. A study on the electrodeposited Ni–S alloys as hydrogen evolution reaction cathodes [J]. International Journal of Hydrogen Energy, 2003, 28 (1): 1207-1212.
[11] 曹寅亮, 王峰, 刘景军, 等. 镍硫析氢活性阴极的电化学制备及其电催化机理[J]. 物理化学学报, 2009, 25 (10): 1979-1984.
[12] 马强, 巴俊洲, 蒋亚雄, 等. 电沉积 Ni–S合金析氢阴极的初步摸索研究[J]. 舰船防化, 2008 (1): 1-6.
[13] 杜敏, 高荣杰. 非晶态Ni–S合金在碱液中析氢反应(HER)机理的研究[J].青岛海洋大学学报(自然科学版), 2003, 33 (6): 961-968.
[14] 韩庆, 陈建设, 刘奎仁, 等. 电沉积非晶态Ni–S–Co合金在碱性介质中的析氢反应[J]. 金属学报, 2004, 40 (3): 331-336.
Preparation of nickel–sulfur electrode by electrodeposition and its electrochemical performance //
WANG Hua*, DUAN Cheng-lin
Ni–S electrodes were prepared by constant current electrodeposition. The influence of the mass concentration of thiourea, current density, temperature of electroplating bath and electrodeposition time on the hydrogen evolution performance of Ni–S electrode was studied with polarization curves. A good preparation process was obtained as follows: NiSO4·6H2O 187.2 g/L, thiourea 100 g/L, H3BO340 g/L, NaCl 20 g/L, pH 4, current density 30 mA/cm2, bath temperature 55 °C and electrodeposition time 120 min. The Ni–S deposit was characterized by scanning electron microscopy, energy-dispersive spectroscopy and X-ray diffraction. The electrochemical performance of Ni–S electrode was studied, and the hydrogen evolution overpotentials on Ni–S electrode, pure Ni electrode and mild
steel electrode were compared at different current densities in 6 mol/L NaOH solution at 25 °C. The results indicated that the microstructure of Ni–S deposit is compact and amorphous, which consists mainly of Ni and S elements, and contains 13.61% S. The hydrogen evolution overpotential on Ni–S electrode is lower than that on the pure Ni electrode by 309 mV and the mild steel electrode by 354 mV at a current density of 100 mA/cm2. The hydrogen evolution overpotential on Ni–S electrode is decreased with increasing electrolyte temperature in range of 60-90 °C. For example, the overpotential is 63 mV at 90 °C. The electrode reactions at different current densities follow different reaction mechanisms. The apparent activation energy is 19.57 kJ/mol when the current densities is in range of 0.1-1.0 A/cm2. The electrochemical impedance spectrum of the electrode consists of two capacitive arcs containing Hadspseudocapacitance at overpotential of 150 mV.
nickel–sulfur electrode; electrodeposition; electrochemistry; hydrogen evolution; overpotential
Faculty of Chemical Environment and Biological Science and Technology, Dalian University of Technology, Dalian 116023, China
TQ153.12
A
1004 – 227X (2011) 08 – 0001 – 05
2010–12–23
2011–03–23
王华(1974–),女,吉林人,讲师,博士,主要从事电化学/金属腐蚀与防护研究。
作者联系方式:(E-mail) whcj1@126.com。
[ 编辑:韦凤仙 ]

