脂肪分化相关蛋白真核表达载体的构建及其对H9c2心肌细胞增殖和凋亡的影响*
鲍苑苑, 方 舟, 周丽诺△, 胡仁明, 丁 薇
(复旦大学1附属华山医院内分泌科,2生命科学院,上海 200040)
脂肪分化相关蛋白真核表达载体的构建及其对H9c2心肌细胞增殖和凋亡的影响*
鲍苑苑1, 方 舟2, 周丽诺1△, 胡仁明1, 丁 薇1
(复旦大学1附属华山医院内分泌科,2生命科学院,上海 200040)
目的构建编码脂肪分化相关蛋白(adipose differentiation-related protein, ADRP)基因全长序列的真核表达载体,探讨ADRP过表达对软脂酸诱导的H9c2心肌细胞凋亡有何影响。方法(1)RT-PCR扩增编码ADRP全长的 DNA 序列,重组入pEGFP-C1质粒表达载体中,酶切、测序鉴定后转化大肠埃希菌DH5α,挑取阳性克隆,扩增后提取质粒并进行鉴定;采用脂质体转染法将鉴定后的重组质粒稳定转染H9c2心肌细胞;荧光显微镜下观察细胞绿色荧光蛋白表达情况;RT-qPCR和Western blotting检测ADRP表达情况;(2)采用MTT比色法和流式细胞术检测不同浓度软脂酸对细胞增殖和凋亡的影响。结果(1)成功构建了真核质粒表达载体pEGFP-C1-ADRP,转染H9c2细胞后,荧光显微镜下观察发现细胞内有绿色荧光蛋白表达;RT-qPCR和Western blotting显示重组质粒转染H9c2细胞ADRP mRNA和蛋白表达水平明显高于空质粒转染组和正常对照组(P<0.01);(2)经不同软脂酸刺激后,重组质粒转染H9c2细胞增殖抑制率和凋亡率均明显低于空质粒转染组和正常对照组(P<0.05)。结论(1)成功获得了稳定表达ADRP的H9c2心肌细胞株;(2)软脂酸可抑制H9c2心肌细胞增殖并可诱导其凋亡,而ADRP高表达可对抗软脂酸的这一作用,表明ADRP对高脂环境中心肌细胞可能具有一定的保护作用。
脂肪分化相关蛋白质; H9c2细胞; 棕榈酸; 细胞凋亡
糖尿病心脏病是糖尿病患者死亡的最主要原因之一,其早期的临床表现为心室舒张功能障碍,随后可出现收缩功能受损,逐渐发展为充血性心力衰竭。糖尿病心脏病患者存在游离脂肪酸(free fatty acid, FFA)过剩,可对心肌细胞造成损伤[1]。脂肪分化相关蛋白(adipocyte differentiation-related protein,ADRP)是细胞内脂滴表面PAT家族蛋白的一种。研究发现,ADRP可促进细胞对FFA的吸收并将其转化为甘油三酯(triglyceride, TG)储存于脂滴内[2]。目前ADRP与糖尿病的关系尚存在争议,Minnaard等[3]认为糖尿病者ADRP水平升高可使细胞内FFA水平升高,对细胞造成一定的损伤;而Phillips等[4]则认为ADRP水平升高可使细胞内FFA转化为TG从而避免损伤细胞。此外,ADRP在心肌病方面的研究报道少见。鉴于此,本研究构建ADRP高表达H9c2心肌细胞稳定株,并用软脂酸(palmitic acid,PA)刺激,观察ADRP高表达后对PA刺激心肌细胞增殖和凋亡的影响,可能为糖尿病心脏病的基因治疗提供新的作用靶点。
材 料 和 方 法
1材料
1.1质粒、菌株和细胞株 原核质粒表达载体pEGFP-C1、大肠埃希菌株DH5α均由上海华山医院中心实验室提供,H9c2心肌细胞株购于中国科学院上海细胞库。
1.2主要试剂 编码ADRP全长的DNA序列引物由上海生工生物工程公司合成;限制性内切酶BclⅡ和HindⅢ、T4 DNA连接酶及预染蛋白质分子量marker购于Fermentas;Trizol购于Invitrogen;SYBR green real-time PCR master mix、逆转录试剂盒购于Toyobo;高纯度质粒小提中量提取试剂盒、DNA纯化回收试剂盒、DL2000及D15000核酸电泳分子量标准、LipofectamineTM2000(Lipo 2000)购于Tiangen;PA、Opti-MEM购于Gibco;兔源性抗ADRP多克隆抗体、羊抗兔IgG-HRP购于Sigma;Annexin Ⅴ-PE/7-AAD细胞凋亡检测试剂盒购于BD;噻唑蓝溴盐(MTT)购于Ameresco。
2方法
2.1pEGFP-C1-ADRP 质粒表达载体的构建 采用主动脉逆行插管的方法[5],收集大鼠心肌细胞,按照试剂盒步骤抽提总RNA并逆转录。以cDNA为模板,按PCR试剂盒说明扩增全长ADRP基因序列。扩增ADRP的引物为:上游5 ’-ccc aagctt gtt agg cgt ctc ttt tct cca-3’(下划线为HindⅢ酶切位点),下游5’-tgc ccgcgg ctg gtg aca agg agg ggt tta-3’(下划线为SacⅡ酶切位点)。反应体系为30 μL,反应条件为:94 ℃ 30 s,65 ℃ 30 s,72 ℃ 3.5 min,扩增35个循环。对PCR扩增产物进行琼脂糖凝胶电泳观察,并进行切胶回收纯化、测序鉴定。用限制性内切酶BclⅡ和HindⅢ对扩增产物和表达质粒进行双酶切,回收并纯化后,用T4 DNA连接酶将扩增产物和表达质粒进行连接;将连接产物转化E.coliDH5α大肠埃希菌,随机挑取阳性克隆,扩增后提取质粒,进行酶切和测序鉴定。
2.2细胞培养及重组质粒稳定转染 选取对数生长期细胞,以0.25% Trypsin消化,用含10%胎牛血清的DMEM高糖培养基将细胞制成密度为1×109cells/L的单细胞悬液。培养24 h后细胞长至约80%融合时进行转染。按照Lipo2000试剂盒说明操作,将pEGFP-C1-ADRP质粒转染入H9c2心肌细胞内,并将空质粒pEGFP-C1转染H9c2心肌细胞作为阴性对照,正常H9c2心肌细胞作为空白对照。继续培养72 h后改用含G-418(500 mg/L)的选择培养液继续培养3周,正常H9c2细胞全部死亡,挑取具有抗性的单克隆扩增进行后续实验。
2.3重组质粒在H9c2心肌细胞中稳定表达的鉴定
① 荧光显微镜间接观察ADRP基因表达 经3周培养后,于倒置荧光显微镜下观察质粒报告基因GFP的表达,间接监测目的基因ADRP表达情况,并对荧光显微镜下2种细胞形态变化进行观察。
② 反转录定量PCR(RT-qPCR)检测ADRP基因转录水平的表达 按Trizol试剂盒说明书提取细胞总RNA,按照反转录试剂盒说明进行操作,逆转录后得到的cDNA为模板,按荧光定量PCR试剂盒说明进行扩增。引物为:上游5’-aag agg cca aac aaa aga gcc agg aga cca-3’,下游5’-acc ctg aat ttt ctg gtt ggc act gtg cat-3 ’。反应体系为20 μL,反应条件为: 95 ℃ 15 s,63 ℃ 15 s,72 ℃ 45 s,扩增40个循环,采用GAPDH基因作为内参照。
③ Western blotting检测ADRP蛋白的表达 超声法提取上述3种细胞总蛋白,BCA法测定其蛋白浓度,然后行SDS-10%PAGE电泳分离。电泳完毕后将蛋白电转移至NC膜,然后用丽春红染色观察蛋白转移情况,转移液脱色后浸入5%脱脂牛奶溶液中室温封闭2 h,PBST洗涤后加入兔源性抗ADRP抗体(1∶1 000),室温孵育3 h或4 ℃过夜,PBST洗涤后,加入HRP标记的羊抗兔IgG(1∶2 000),室温孵育1 h,PBST洗涤后用化学发光法显色。采用GAPDH作为内参照。
2.4PA干预 分别用含1%BSA的DMEM高糖培养基和含有1%BSA及不同浓度PA的DMEM高糖培养基(按照Cousin等[6]文献报道的方法配置PA/BSA混和溶液,经0.22 μm孔径的滤膜过滤后经DMEM溶液倍比稀释,得到PA浓度为0.5 mmol/L、1 mmol/L、2 mmol/L DMEM溶液)培养3种细胞48 h进行后续实验。
2.5MTT比色法检测心肌细胞增殖活力 选取对数生长期的3种细胞,以0.25%trypsin消化,用含10%小牛血清的DMEM培养液将细胞分散成密度为5×107cells/L的单细胞悬液,将细胞接种于96孔板,每孔200μL。培养24 h后换含有PA(终浓度分别为0.5 mmol/L、1 mmol/L和2 mmol/L)的培养液继续培养,每种浓度组及对照组均做6个平行孔。分别处理24 h、48 h和72 h后,每孔加入新鲜配置的MTT溶液(5 g/L)20 μL,继续孵育4 h。待测定时小心吸出孔内培养液,加入150 μL DMSO,振荡混合器上振荡10 min,使结晶物充分溶解,然后测定570 nm波长处各孔吸光度(A)值。抑制率按照以下公式计算:抑制率=(1-PA干预组平均A值/对照组平均A值)×100%。实验重复进行3次。
2.6流式细胞术检测细胞凋亡 待测细胞用不含EDTA的trypsin消化收集,加入1 mL预冷PBS洗涤细胞2次后,将细胞重悬于500 μL binding buffer中,使其每孔浓度为109cells/L,加入5 μL Annexin V-PE混匀后室温避光反应15 min,2 000 rpm/min离心10 min,弃去上清加入500 μL binding buffer和5 μL的7-AAD混匀避光反应10 min后,用流式细胞仪检测细胞凋亡率。实验重复进行3次。
3统计学处理
结 果
1重组质粒表达载体的构建
琼脂糖凝胶电泳图谱显示,PCR扩增产物ADRP约1.2 kb,见图1,测序鉴定结果与GenBank报道的完全一致(ADRP登录号为BC085861,测序图谱略),无PCR引起的突变。用限制性内切酶SacⅡ和HindⅢ对重组质粒pEGFP-C1-ADRP进行双酶切后,电泳分析,可见除了有4 700 bp的质粒载体谱带外,还有相应目的基因片段大小的谱带,见图2。对重组质粒进行测序鉴定,结果与GenBank报道的完全一致(ADRP登录号为BC085861,测序图谱略)。
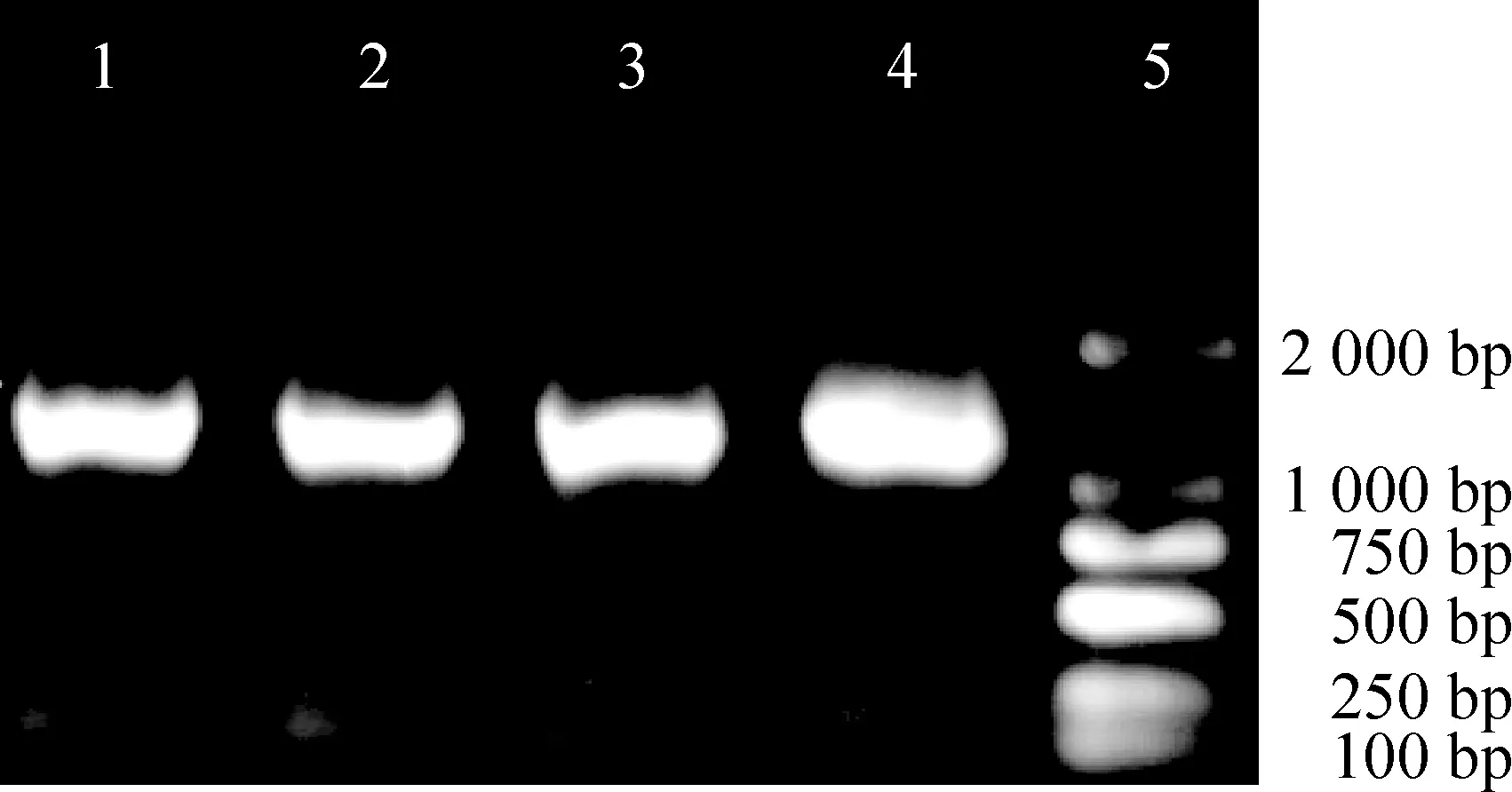
Figure 1. Electrophoresis analysis(2% agarose gel) of ADRP PCR products. Lane 1-4:ADRP; Lane 5: DL2000 DNA marker.
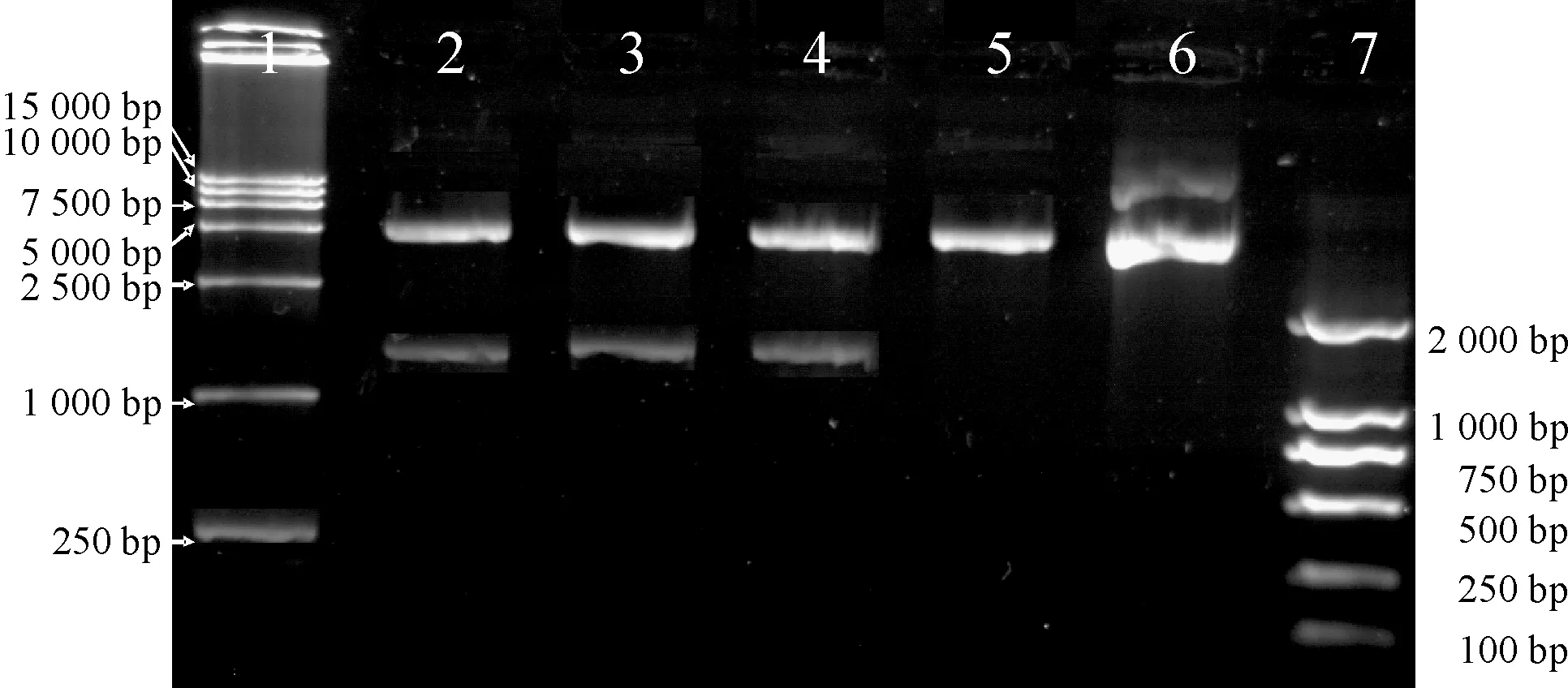
Figure 2. Identification of recombination vector by enzyme digestion. Lane 1:DL15000 DNA marker; Lane 2-4: digestive productsof pEGFP-C1-ADRP(4.7 kb and 1.7 kb); Lane 5: digestive product of pEGFP-C1; Lane 6: pEGFP-C1; Lane 7: DL2000 DNA marker.
2稳定转染心肌细胞株的建立
2.1荧光显微镜观察 倒置荧光显微镜下观察发现,重组质粒转染组细胞和空质粒转染组细胞均有绿色荧光稳定表达,传代20次以上仍无消失。
2.2重组质粒转染细胞、空质粒转染细胞和正常H9c2细胞ADRP mRNA的表达水平 从3种细胞中提取的总RNA用1.5%琼脂糖凝胶电泳后,在紫外透射分析仪下观察,显示清晰的28S、18S 2条条带,且28S∶18S约为2∶1,提示RNA提取完整、无降解;进一步检测所有总RNA样品的A260 nm/A280 nm值均大于1.8,表明总RNA纯度较高,能满足逆转录需求。荧光定量PCR结果如图3所示,重组质粒转染组细胞ADRP mRNA的表达水平明显高于空质粒转染组和正常H9c2细胞组细胞(P<0.01),而空质粒转染组细胞ADRP mRNA的表达水平与正常H9c2细胞组相比无显著差异(P>0.05)。
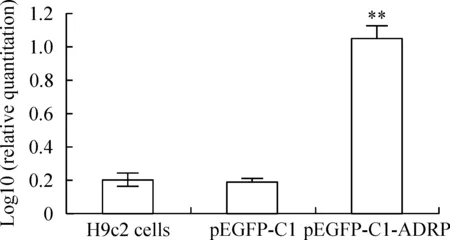
Figure 3. Expression level of ADRP mRNA by RT-qPCR in H9c2 cells transfected with pEGFP-C1-ADRP or pEGFP-C1 and normal H9c2 cells. pEGFP-C1: H9c2 cells transfected with pEGFP-C1; pEGFP-C1-ADRP: H9c2 cells transfected with pEGFP-C1-ADRP.±s.n=3.**P<0.01 vs H9c2 cells transfected with pEGFP-C1 or normal H9c2 cells.
2.3重组质粒转染细胞、空质粒转染细胞和正常H9c2细胞ADRP蛋白的表达水平 Western blotting结果显示:重组质粒转染组细胞ADRP的表达水平明显高于空质粒转染组和正常H9c2细胞组细胞(P<0.01),而空质粒转染组细胞ADRP的表达水平与正常H9c2细胞组相比无显著差异(P>0.05),见图4。

Figure 4. Expression level of ADRP protein by Western blotting in H9c2 cells transfected with pEGFP-C1-ADRP or pEGFP-C1 and normal H9c2 cells. Lane 1: normal H9c2 cells; Lane 2: H9c2 cells transfected with pEGFP-C1-ADRP; Lane 3: H9c2 cells transfected with pEGFP-C1.
3PA对重组质粒转染细胞、空质粒转染细胞和正常H9c2细胞增殖的影响
如表1所示,不同浓度的PA对3种细胞生长均有一定的抑制作用,随着PA浓度增大、作用时间延长,其对3种细胞增殖的抑制作用逐渐增强(P<0.05),并且PA对3种细胞增殖的抑制作用均呈明显的剂量-效应和时间-效应依赖关系。
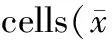
表1 PA对正常H9c2细胞、空质粒转染细胞和重组质粒转染细胞增殖的影响
在同一PA处理浓度和相同处理时间下,重组质粒转染组细胞抑制率明显低于空质粒转染细胞和正常H9c2细胞(P<0.05),正常H9c2细胞与空质粒转染细胞组相比抑制率无明显差异(P>0.05)。
4PA对重组质粒转染细胞、空质粒转染细胞和正常H9c2细胞凋亡率的影响
流式细胞术分析显示,PA处理3种细胞72 h后,与对照组相比,细胞凋亡率显著增加(P<0.05),并呈明显的剂量效应依赖关系;同一PA浓度刺激时,空质粒转染细胞凋亡率与正常H9c2细胞相比无明显差异(P>0.05),而重组质粒转染组细胞凋亡率明显低于空质粒转染细胞和正常H9c2细胞(P<0.05),表明ADRP基因可能对PA刺激引起的心肌细胞凋亡具有保护作用,见图5。
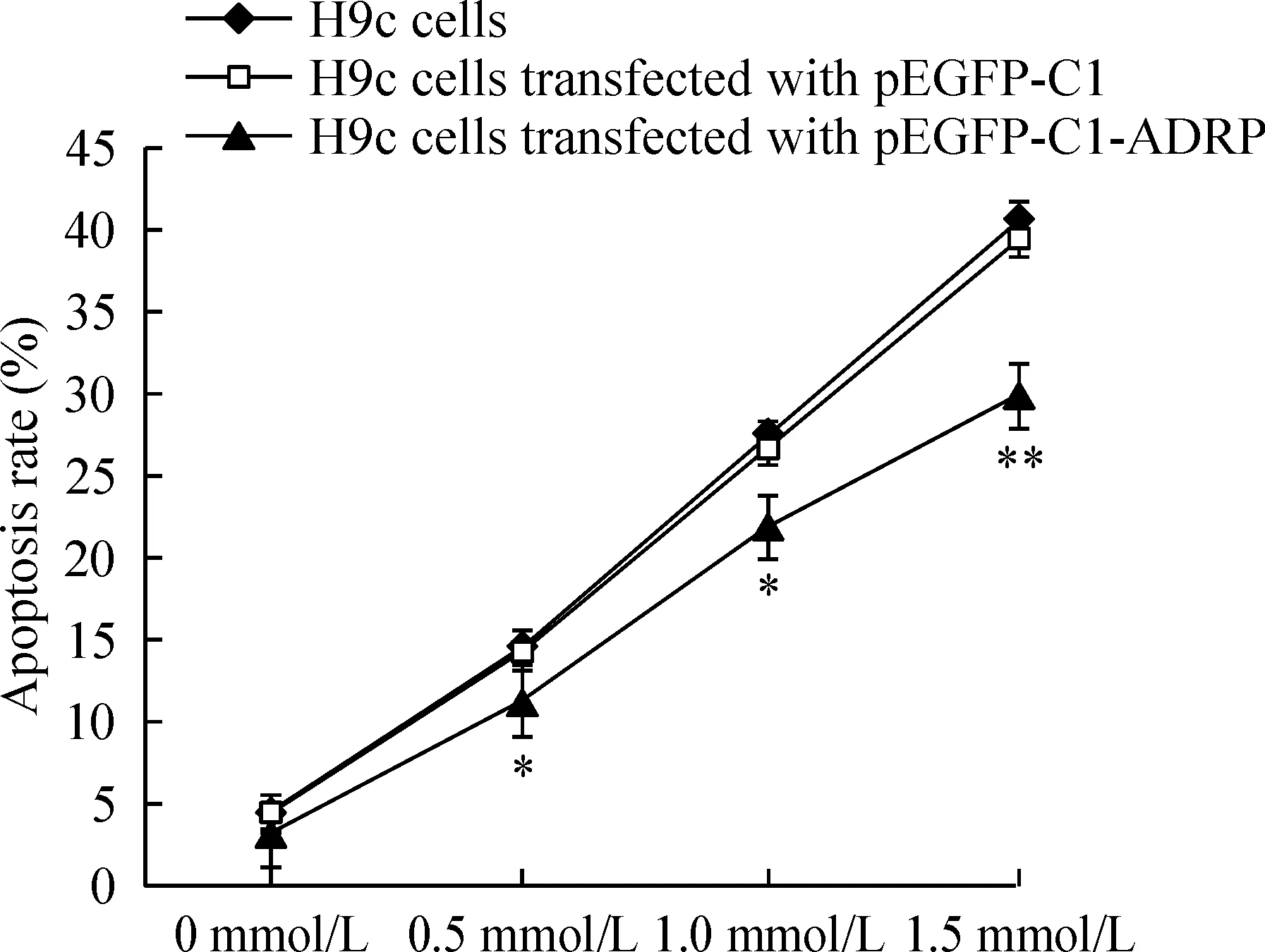
Figure 5. Effect of PA at different doses on cell apoptosis of H9c2 cells transfected with pEGFP-C1-ADRP or pEGFP-C1 and normal H9c2 cells(72 h later). ±s.n=3.*P<0.05,** P<0.01 vs H9c2 cells or H9c2 cells transfected with pEGFP-C1
讨 论
脂肪酸是心脏能量产生的主要来源,在多种疾病状态下,心肌细胞脂肪酸代谢异常可引起细胞内FFA增高和脂代谢中间产物积聚,进而导致心肌收缩和舒张功能受损。动物实验发现,糖尿病动物模型心肌细胞中FFA水平的升高可导致细胞胰岛素抵抗的发生及细胞凋亡率的增加,从而加快了糖尿病心衰或心肌病的进程。近来研究发现,ADRP可通过促进高脂环境培养下骨骼肌细胞对FFA的吸收和转化来降低细胞内FFA水平,从而避免FFA对骨骼肌细胞的损伤[3,4],然而有关ADRP对高脂环境下心肌细胞的影响尚未见文献报道。
H9c2心肌细胞来源于大鼠胚胎心脏组织,具有增殖能力强、易培养等特点,目前广泛用于细胞周期调控相关基因表达、细胞增殖及凋亡等的研究[7]。基因转染进入细胞的方式主要有4种:电击法、磷酸钙法、脂质体介导法和病毒介导法。电击法和磷酸钙法实验条件控制较严、难度较大;病毒法前期准备较复杂,费用较高,且可能对细胞有较大影响;而脂质体介导法与上述几种方法相比,操作简单,适用范围广,转染效率较高,细胞毒性较低。本研究构建了含有EGFP报告基因的重组质粒pEGFP-C1-ADRP,并通过脂质体转染法将其转入H9c2细胞中。荧光显微镜下观察发现重组质粒转染细胞和空质粒转染细胞均呈现明显的绿色荧光,而未转染的正常H9c2细胞则未见荧光;RT-qPCR与Western blotting结果显示,与正常H9c2细胞和空质粒转染细胞相比,重组质粒转染细胞ADRP mRNA和蛋白的表达水平明显升高(P<0.01),这表明高表达ADRP心肌细胞稳定株构建成功。
本实验采用MTT法观察了PA对重组质粒转染组、空质粒转染组和正常H9c2细胞组细胞增殖的影响。结果显示,PA对3种细胞的增殖均有一定抑制作用,并呈明显的剂量-效应和时间-效应依赖关系;相同PA处理条件(相同浓度和作用时间)下,重组质粒转染组细胞抑制率明显低于空质粒转染细胞和正常H9c2细胞(P<0.05),表明ADRP基因高表达可对抗PA对H9c2心肌细胞增殖的抑制作用,即ADRP可能具有保护心肌细胞免于高脂环境损伤的作用。
研究发现,高脂环境(PA)可诱导微血管内皮细胞的凋亡,进而影响糖尿病肾病的发生发展[8]。那么PA对心肌细胞有何影响?将ADRP转入细胞后可否对抗PA引起的细胞凋亡?基于此,我们采用不同浓度的PA刺激重组质粒转染组、空质粒转染组细胞和正常H9c2细胞,然后用流式细胞仪检测细胞凋亡情况。结果发现,与对照组相比,经PA刺激后各组细胞凋亡率均有所增加,且具有明显的剂量效应依赖性,推测其原因可能是PA使心肌细胞中长链酯酰辅酶A增多,非氧化代谢产物神经酰胺浓度升高,通过NF-κB介导,释放细胞色素C,引起细胞凋亡[9]。进一步分析发现,相同PA浓度作用下,重组质粒转染组细胞凋亡率明显低于空质粒转染组细胞和正常H9c2细胞组(P<0.05),表明ADRP高表达也可通过抑制高脂环境诱导的H9c2心肌细胞凋亡来保护心肌细胞,推测原因可能是由于ADRP高表达使PA以TG的形式储存在脂滴内,避免了PA对心肌细胞产生损伤。
综上,我们成功建立了稳定表达ADRP的H9c2心肌细胞株,观察到相同PA作用条件下重组质粒转染组细胞增殖和凋亡率均明显低于空质粒转染组和正常H9c2细胞组细胞,表明ADRP可能对细胞内FFA升高造成的细胞损伤具有一定的保护作用。目前ADRP影响心肌细胞脂肪代谢途径的研究较少,因此有关ADRP对高脂环境中心肌细胞保护作用的机制尚不清楚,有待于我们进一步研究。
[1] Poornima IG, Parikh P, Shannon RP. Diabetic cardiomyopathy - The search for a unifying hypothesis[J]. Circ Res, 2006, 98(5):596-605.
[2] Chang BH, Chan L. Regulation of triglyceride metabolism. III. Emerging role of lipid droplet protein ADFP in health and disease[J]. Am J Physiol Gastrointest Liver Physiol, 2007, 292(6):G1465-G1468.
[3] Minnaard R, Schrauwen P, Schaart G, et al. Adipocyte differentiation-related protein and OXPAT in rat and human skeletal muscle:involvement in lipid accumulation and type 2 diabetes mellitus[J].J Clin Endocrinol Metab,2009,94(10):4077-4085.
[4] Phillips SA, Choe CC, Ciaraldi TP, et al. Adipocyte differentiation-related protein in human skeletal muscle: relationship to insulin sensitivity[J]. Obes Res, 2005, 13(8): 1321-1329.
[5] Liu K, Zhang WW, Liu L, et al. Ghrelin inhibits apoptosis induced by high glucose and sodium palmitate in adult rat cardiomyocytes through the PI3K-Akt signaling pathway[J]. Regul Pept, 2009, 155(1-3):62-69.
[6] Cousin SP, Hugl SR, Wrede CE, et al. Free fatty acid-induced inhibition of glucose and insulin-like growth factor I-induced deoxyribonucleic acid synthesis in the pancreatic beta-cell line INS-1[J]. Endocrinology, 2001, 142(1):229-240.
[7] 付德明,吕吉元,康玉明,等.洛沙坦抑制β-肾上腺素能刺激诱导的大鼠心肌细胞凋亡的机制研究[J].中国病理生理杂志,2009,25(8):1463-1468.
[8] Yamagishi S, Okamoto T, Amano S, et al. Palmitate-induced apoptosis of microvascular endothelial cells and pericytes[J]. Mol Med, 2002, 8(4):179-184.
[9] Zhang DX, Fryer RM, Hsu AK, et al. Production and metabolism of ceramide in normal and ischemic-reperfused myocardium of rats[J]. Basic Res Cardiol, 2001, 96(3):267-274.
Effectofadiposedifferentiation-relatedproteinonproliferationandapoptosisinH9c2cells
BAO Yuan-yuan1, FANG Zhou2, ZHOU Li-nuo1, HU Ren-ming1, DING Wei1
(1DepartmentofEndocrinologyandMetabolism,HuashanHospital,2AcademyforLifeScience,FudanUniversity,Shanghai200040,China.E-mail:zhoulinuo@yahoo.cn)
AIM: To construct an adipose differentiation-related protein(ADRP) eukaryotic expression vector and to explore the effect of ADRP on apoptosis of H9c2 cells induced by palmitic acid(PA).METHODSThe ADRP gene obtained by the method of RT-PCR was cloned into pEGFP-C1 plasmid. The recombinant plasmid was transformed intoE.coliDH5α for amplification. The recombinant plasmid was extracted fromE.coliDH5α and transfected into H9c2 cells by LipofectamineTM2000. The stable transformants were selected by G418 screening. Expression of green fluorescent protein was observed under fluorescence microscope and the ADRP expression was identified by RT-qPCR and Western blotting analysis. The effect of PA on the proliferation of H9c2 cells was detected by MTT assay. The apoptotic percentage of H9c2 cells caused by PA was determined by flow cytometry.RESULTSThe eukaryotic expression vector pEGFP-C1-ADRP was successfully constructed. Green fluorescent was observed in the cells transfected with pEGFP-C1 or pEGFP-C1-ADRP under fluorescence microscope. RT-qPCR and Western blotting analysis showed that recombinant cells exhibited high mRNA and protein levels of ADRP. After treated with PA at different concentrations, the apoptosis rates and the proliferation inhibition of recombinant cells were both lower than those of the other two cells.CONCLUSIONThe transfected H9c2 cells with stable ADRP expression were successfully established. The over-expression of ADRP prevents the cells from apoptosis and inhibition of proliferation caused by PA, indicating that ADRP plays a protective role in H9c2 cells.
Adipose differentiation-related protein; H9c2 cells; Palmitic acid; Apoptosis
R589.2
A
10.3969/j.issn.1000-4718.2011.02-003
1000-4718(2011)02-0223-06
2010-10-08
2010-11-04
国家自然科学基金资助项目(No.30270627)
△ 通讯作者Tel:021-52888143;E-mail:zhoulinuo@yahoo.cn
欢迎订阅《中国病理生理杂志》
《中国病理生理杂志》中国病理生理学会主办、暨南大学出版、国内外公开发行的综合性病理生理学高级学术期刊。
杂志主要刊登有关病理生理学方面的论著(包括实验研究和临床研究)、专题综述、学术动态、临床生理专题讲座、教学经验、研究技术和实验方法(包括疾病模型和实验动物)、书刊评论、教学科研仪器和药品的评价等。适合医、药院校教学科研人员、研究生、广大临床医务工作者和高年级医学生阅读。
《中国病理生理杂志》为月刊,每月15日出版,每期定价为15元,全年180元(含邮费)。本刊由广东省报刊发行局负责全国发行,读者可到当地邮局订阅(邮发代号:46 - 98;国内统一刊号:CN 44-1187/R;国际标准刊号:ISSN 1000-4718),也可直接汇款到《中国病理生理杂志》编辑部购买。汇款订购请注明详细地址、邮编、以及期刊的年份、期号、订购数量。
汇款地址:广州市黄埔大道西601号暨南大学《中国病理生理杂志》编辑部收
邮 编:510632
电 话:020-85220269
传 真:020-85222175
网 址:http://www.CJPP.net
E-mail: obsbjb@jnu.edu.cn
# 现工作单位: 南华大学附属第二医院麻醉科

