MuRF-1在大鼠心肌梗死后慢性心衰心脏中的表达变化及其分子机制的探讨*
戴翠莲, 张 赟, 姜黔峰
(遵义医学院附属医院心内科, 贵州 遵义 563003)
MuRF-1在大鼠心肌梗死后慢性心衰心脏中的表达变化及其分子机制的探讨*
戴翠莲△, 张 赟, 姜黔峰
(遵义医学院附属医院心内科, 贵州 遵义 563003)
目的研究肌肉环指蛋白1(MuRF-1)在心肌梗(MI)死后慢性心衰大鼠心脏中的表达变化及其分子机制,对心功能及心肌肌钙蛋白I(cTnI)的影响及其与cTnI的关系。方法将48只制作成功的心肌梗死大鼠及假手术大鼠纳入研究,分为sham组、MI组、MG-132组及TNF-α组,检测各样本血流动力学指标及血清N末端原脑钠肽水平(NT-proBNP),观察心肌组织学变化;原位杂交及real-time PCR法半定量测定心肌组织MuRF-1及cTnI mRNA表达,Western blotting法确定心肌MuRF-1及cTnI蛋白质水平,并对MuRF-1及cTnI的相关性进行分析。结果与MI及TNF-α组相比,MG-132能够显著降低NT-proBNP(P<0.05),使心衰的发生率及死亡率有下降趋势,心肌组织损伤减轻,并使大鼠左心室收缩压(LVSP)升高(P<0.01),左心室等容收缩期室内压最大上升速率(+dp/dtmax)增加(P<0.01),左心室舒张末压(LVEDP)明显降低(P<0.01)。与sham组相比,MI组MuRF-1的mRNA及蛋白质表达均显著升高(P<0.05),cTnI水平降低(P<0.05); MG-132能够明显降低心肌梗死后MuRF-1表达(P<0.05),升高cTnI水平(P<0.01);TNF-α则起相反作用。相关性分析显示,MuRF-1与cTnI呈显著负相关(P<0.01)。结论MuRF-1在慢性心衰中表达显著升高,使心功能损害加重,其作用通过抑制cTnI表达而实现;抑制蛋白酶体活性能够通过抑制MuRF-1表达而升高cTnI水平,改善心功能。MuRF-1的激活可能是慢性心力衰竭的机制之一。
心力衰竭; 肌肉环指蛋白-1; 肌钙蛋白Ⅰ
心肌梗死后心室重塑是慢性心力衰竭的主要原因,左心室扩张、存活心肌细胞病理性肥大及某些胚胎基因的再表达是其主要特征[1]。作为钙离子受体的肌钙蛋白在心肌收缩状态中起着重要作用,研究发现,心肌肌钙蛋白I(cardiac troponin I,cTnI)可能是E3 泛素连接酶肌肉特异性环指蛋白(muscle ring finger 1, MuRF-1)的特异靶蛋白。E3泛素连接酶MuRF-1与肌小节粗肌丝的肌联蛋白结合[2],并且两者的相互作用可以调节肌原纤维M带结构的稳定性[3]。本实验以心肌梗死后慢性心力衰竭大鼠为观察对象,通过上调或者减少MuRF-1的表达,以研究MuRF1在心肌梗死后慢性心衰中的作用,并对cTn I 与MuRF-1相关性进行研究,结果有助于为心室重塑机制提供新观点,并从肌肉萎缩途径为慢性心衰的预防提供新方法。
材 料 和 方 法
1材料
1.1动物 SD(Sprague-Dawley)大鼠60只,体质量(220±50)g,雌雄各半(购于第三军医大学实验动物中心),雌雄分笼饲养。
1.2主要试剂 蛋白酶体抑制剂MG-132(N-[(phenylmethoxy)carbonyl]-L-leucyl -N-[(1S)-1-formyl-3-methylbutyl]-L-leucinamide)购于Calbiochem。大鼠N-末端原脑钠肽(N-terminal pro-brain natriuretic peptide,NT-proBNP) ELISA(enzyme-linked immunosorbent assay)试剂盒购于PhoenixPeptide。肿瘤坏死因子α (tumor necrosis factor alpha,TNF-α)购于Sigma。MuRF-1兔抗大鼠多克隆抗体(SC-32920),及3-磷酸甘油醛脱氢酶(glyceraldehyde 3-phosphate dehydrogenase,GAPDH)兔抗大鼠多克隆抗体购于Santa Cruz。cTnI小鼠抗大鼠单克隆抗体(ab27972)购于Abcam。RNA提取试剂盒、RNA反转录试剂盒、荧光定量PCR试剂盒、Trizol 及引物设计均为TaKaRa产品。二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒购于上海捷瑞生物工程有限公司。DAB显色试剂盒购于北京中衫金桥生物有限公司。PVDF膜为Biometra产品。MuRF-1及cTnI原位杂交试剂盒购于上海罗氏公司。BL-410生物机能实验系统为成都泰盟科技有限公司产品。
2方法
2.1动物模型和实验分组 TNF-α及MG-132实验使用剂量分别参考文献[4, 5]。慢性心力衰竭模型参照文献[6]并加以改进。同窝出生的成熟大鼠,以3.5%水合氯醛腹腔内注射麻醉后接心电图机,气管插管后接小动物呼吸机。于胸骨左缘0.5 cm切开皮下组织,减断第3、4肋骨,暴露胸腔。减开心包,暴露动脉圆锥和左心耳根部间的左冠状静脉,以其为标志,于左冠状动脉前降支(left anterior descending, LAD)发出约2 mm处穿线后打死结,以阻断其血流,造成心肌梗死。假手术组模型制作相同,但只穿线通过LAD不打结。以心电图改变和心肌颜色变化作为心肌梗死模型成功的标志。
根据不同的干预手段,将造模成功且24 h后仍存活的48只大鼠随机分为4组,每组12只,并立即进行以下处理:(1)MG-132组:腹腔内注射0.1 mg·kg-1·d-1的MG-132 (溶于2 mL生理盐水);(2)TNF-α组:腹腔内注射100 ng·g-1·d-1TNF-α (溶于2 mL生理盐水);(3)心肌梗死(MI)组:腹腔内注射2 mL·d-1生理盐水;(4)假手术(sham)组:腹腔内注射2 mL·d-1生理盐水。所有腹腔内注射持续7周。
2.2检测指标及方法
① 计算动物心衰发生率及存活率 心衰判断:精神萎靡、饮食差、活动减少、皮肤松弛、毛色欠光亮、气促,并且尸检发现肝淤血、肺淤血伴或不伴胸腔积液、腹腔积液,并结合血流动力学结果进行判断。
② 血流动力学检测 7周后再次给予大鼠3.5%水合氯醛腹腔内注射麻醉,接呼吸机,纵形切开右颈部皮肤约1.5-2 cm,分离出右侧颈总动脉。结扎颈总动脉远心端,关闭颈总动脉近心端。剪开颈动脉并插入1 mm的预先充满肝素盐水的聚乙烯导管,导管另一端与电生理记录仪压力感受器相连,导入BL-410生物机能实验系统测得左心室收缩压(left ventricular systolic pressure,LVSP)、左心室舒张末压(left ventricular end-diastolic pressure, LVEDP)、心率(heart rate, HR),同时同步输入微分器描记曲线,测得左心室等容收缩期室内压最大上升速率(the maximum rate of left ventricular pressure rise, +dp/dtmax)、左心室等容舒张期室内压最大下降速率(the maximum rate of left ventricular pressure decrease,-dp/dtmax)。
完成血流动力学检测后,于腹腔内再次注入致死量的水合氯醛,右颈总动脉取血,开胸并摘取心脏,迅速分离出左心室,并从结扎点开始沿长轴横切成2 mm的薄片。取第1片心肌组织制作石蜡包埋切片用于原位杂交及HE染色,第2及第3片分别-80 ℃保存用于荧光定量PCR及Western blotting检测。
③ 组织学观察 将石蜡包埋后心肌组织切成5 μm薄片,用苏木精-伊红(hematoxylin and eosin,HE)染色后显微镜下观察梗死边缘心肌结构变化。
④ NT-proBNP水平 分离血清,采用双抗体夹心 ABC-ELISA(avidin-biotin-peroxidase complex enzyme-linked immunosorbent assay) 法检测NT-proBNP水平,严格按照说明书操作。配制好标准品,并将待测样品做10倍稀释。将标准品及待测样品加入96孔板中,每孔100 μL,充分混匀后置37 ℃ 2 h;洗板3次加第Ⅰ抗体工作液100 μL,混匀后置37 ℃ 1 h;洗板5次并加酶标抗体工作液100 μL,将反应板置37 ℃ 30 min;洗板5次,加入底物工作液100 μL,室温暗处反应30 min,加入100 μL终止液混匀,用酶标仪在450 nm处测吸光度值。
⑤ 原位杂交法检测MuRF-1及cTnI的mRNA表达水平 严格按照说明书操作。石蜡切片脱蜡至水,置打孔液中室温10 min后置过氧化氢封闭液室温20 min,预杂交1 h;滴加杂交工作液覆盖组织37 ℃过夜,分别用0.2× SSC(标准柠檬酸盐溶液,standard saline citrate)及0.1 mol/L TBS(三乙醇胺缓冲盐水溶液,triethanolamine-buffered saline solution)洗涤,滴加小鼠抗地高辛生物素标记的抗体工作液37 ℃孵育45 min后,辣根过氧化物酶37 ℃孵育45 min;DAB显色,光学显微镜下观察,当细胞内胞浆阳性颜色与细胞外背景颜色对比度反差明显时,蒸馏水终止反应。细胞浆显棕黄色颗粒为阳性反应,苏木素复染,胞核为蓝色。自来水充分冲洗,脱水透明、封片。高倍镜下(×200)观察MuRF-1及cTnI的mRNA表达情况:在每一张切片的梗死边缘区域随机选10个视野,用HPLAS-1000图像分析系统计算吸光度(absorbance,A)值,计算其平均值。
⑥ 荧光定量PCR半定量检测MuRF-1及cTnT mRNA表达 提取心肌总RNA(按照说明书进行) ,计算RNA的纯度,进行逆转录反应( TaKaRa) ,合成的cDNA储存在-20 ℃条件下备用。以β-actin为内参照, 引物如下:cTnI上游5’-ACCTATGCCGGCAGCTTCA-3’,下游5’- GAGAGTGGGCCGCTTAAACTTG-3’;MuRF-1上游5’-GGGAACGACCGAGTTCAGACTATC-3’,下游5’-GGCGTCAAACTTGTGGCTCA-3’;β-actin上游5’-GCGAGAAGATGACCCAGATC-3’,下游5’-CCAGTGGTACGGCCAGAGG-3’。制备cDNA的逆转录体系为5×PrimeScriptTMbuffer 2 μL,PrimeScriptTMRT enzyme mixⅠ0.5 μL,oligo-dT primer 0.5 μL,random 6-mers 0.5 μL,RNA 1 μL。反应参数为37 ℃ 15 min,85 ℃ 5 s,循数1次。定量PCR检测在LightCycler荧光定量PCR仪上进行。20 μL反应体系,反应液中包括SYBR Premix ExTaqTM10 μL,PCR forward primer及PCR reverse primer各0.5 μL,ddH2O 8 μL,模板cDNA 1 μL。cTnI、MuRF-1及β-actin的PCR反应条件为95 ℃ 3 min,1个循环,95 ℃ 30 s、61.6 ℃ 30 s 40个循环。每份标本设3个复孔,取其循环阈值(Ct)均值,分别计算各组的△C(△Ct=CtMuFR1/cTnI-Ctβ-actin),再依公式△△Ct =△CtMuFR1/cTnI-△Ctβ-actin计算△△Ct,2-△△Ct为模板中目的基因的相对比值。
⑦ Western blotting检测 MuRF-1及 cTnI 蛋白质水平 提取心肌总蛋白(按照说明书进行),BCA-100法测定蛋白含量。取100 μg等量蛋白经10%SDS-PAGE电泳后转至PVDF膜上,用含5%脱脂奶封闭1 h后分别与兔抗大鼠MuRF-1、小鼠抗大鼠cTnI及兔抗大鼠GAPDH抗体(以TBS稀释,浓度分别为1∶200、1∶500、1∶200)室温孵育2 h;洗膜后与Ⅱ抗(兔抗小鼠及山羊抗兔IgG)室温孵育1 h,化学发光显影,凝胶成像系统拍照、扫描分析。用UVP公司LabWorks 4.5软件对条带进行定量分析,以目的条带和GAPDH条带积分吸光度比值作为半定量结果。
3统计学处理
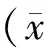
结 果
1心衰发生率及生存率
7周后sham组大鼠无心衰发生,MI组、MG-132组及TNF-α组分别有9只、6只和10只发生心衰,其发生率为75%、50%和83%。与sham组相比,MI组和TNF-α组心衰的发生率显著增加(P<0.05),而MG-132组较MI组有下降趋势。MI组2只死于心衰,TNF-α组3只死于心衰,MG-132组无死亡。对以上组各取6只存活且发生心衰的大鼠进行研究并用于统计学分析。
2血流动力学检测结果
图1结果显示,与sham组相比,MI组的心率明显增快,LVSP降低,LVEDP增高,+dp/dtmax及-dp/dtmax均降低,差异均显著(P<0.01),TNF-α组更进一步加重了心功能损害;与MI组和TNF-α组比较,MG-132组上述心功能指标得到改善,且差异均显著(P<0.01)。
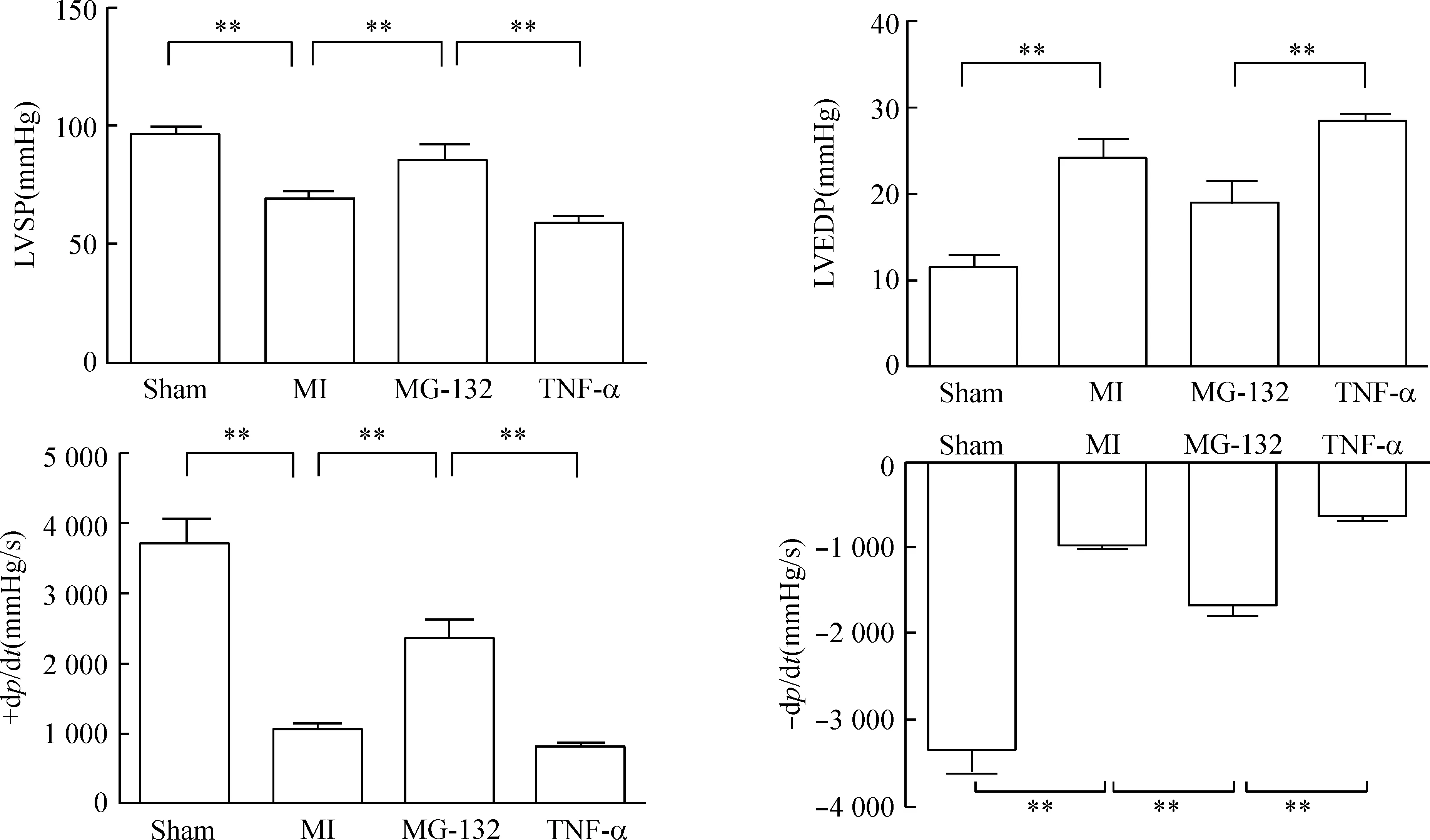
Figure 1. Cardiac hemodynamic changes. The myocardial infarction model in rats was induced by ligating left anterior descending coronary artery. For sham surgical operating, left anterior descending coronary artery was not ligated. The rats,which survived 24 h after modeling, were treated with proteasome inhibitor MG-132, TNF-α or saline by intraperitoneal injection. Sham: sham group; MI: myocardial infarction group; MG-132: MG-132 group(MI rats treated with MG-132 for 7 weeks, 0.1 mg·kg-1·d-1, ip); TNF-α: tumor necrosis factor α group(MI rats were treated with TNF-α for 7 weeks, 100 ng·kg-1·d-1,ip); LVSP: left ventricular systolic pressure; LVEDP: left ventricular end-diastolic pressure;+dp/dtmax: the maximum rate of left ventricular pressure rise; -dp/dtmax: the maximum rate of left ventricular pressure decrease. ±s. n=6.**P<0.01.
3病理形态学
HE染色结果显示,与sham组相比,MI组及TNF-α组可见大片心肌坏死,疤痕组织形成,结缔组织增生,炎症细胞浸润,残存心肌水肿;尤以TNF-α组为重,仅可见岛状心肌结构。MG-132组上述损害减轻,见图2。
4NT-proBNP水平
与sham组相比,MI组NT-proBNP水平明显增高(P<0.01);TNF-α组较MI组进一步增加;与MI组及TNF-α组比较,MG-132组NT-proBNP水平均显著降低(P<0.01),见图3。
5RT-PCR检测MuRF-1及cTnI的mRNA表达(图4)
5.1MuRF-1 mRNA表达水平 Sham组MuRF-1 mRNA呈低水平表达,与其相比,MI组则显著增加(P<0.05),TNF-α组更进一步上调了MuRF-1 mRNA水平。与MI组和TNF-α组相比,MG-132则使MuRF-1的表达显著降低(P<0.05)。
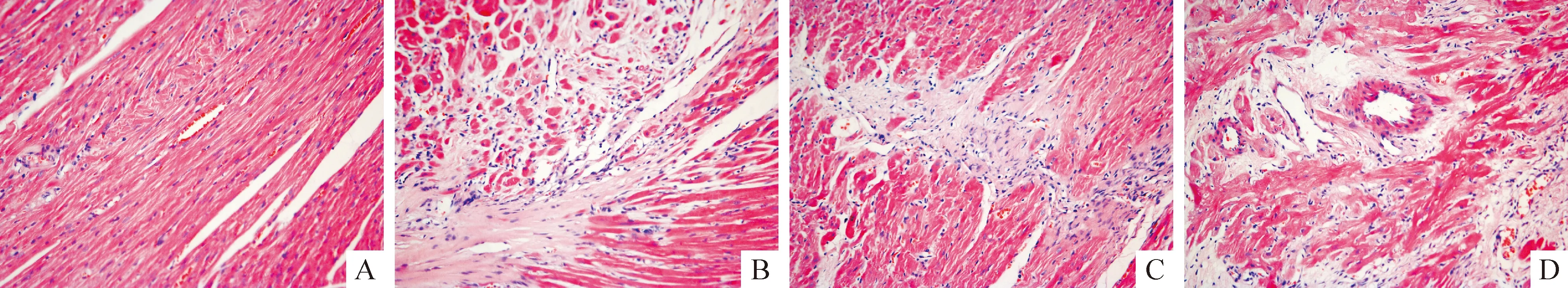
Figure 2. Left ventricular myocardial infarction sections stained with hematoxylin-eosin(×200). A: sham group; B: MI group; C: MG-132 group; D: TNF-α group.
Figure 3. Detection of plasma NT-proBNP level. NT-proBNP: N-terminal pro-brain natriuretic peptide. Sham: sham group; MI: myocardial infarction group; MG-132: MG-132 group; TNF-α: tumor necrosis factor α group.±s.n=6.**P<0.01.
5.2cTnI的mRNA表达水平 MI组cTnI为0.63±0.26,明显低于sham组(1.78±0.89),差异显著(P<0.05)。与MI组相比,MG-132组cTnI表达量显著增加(P<0.01);TNF-α组cTnI的表达量(0.20±0.04)则明显低于MI组(P<0.01)。
5.3MuRF-1与cTnI mRNA表达量的相关性分析 对4组大鼠心肌中MuRF-1和cTnI的mRNA 表达量进行相关性分析,结果显示MuRF-1与cTnI之间呈负相关,相关系数r=-0.56,P<0.01。
6原位杂交(图5)
6.1心肌MuRF-1吸光度(A)值 与sham组比较,MI组MuRF-1 mRNA 的A值为208.52,差异显著(P<0.01)。与MI组比较,MG-132组显著下调了MuRF-1的表达(A=143.63,P<0.01),但高于sham组;TNF-α组显著上调了MuRF-1的水平。
6.2心肌cTnIA值 与sham组比较,MI组cTnI mRNA的表达量降低(P<0.01),差异显著。与MI组相比较,MG-132组cTnI mRNA的表达量有升高趋势(P<0.01),TNF-α组cTnI mRNA的表达量则显著降低(P<0.01)。
6.3MuRF-1与cTnI mRNA吸光度值相关性分析 相关性分析结果显示,MuRF-1与cTnI的mRNA 表达量呈明显负相关(r=-0.83,P<0.01)。
7Westernblotting检测MuRF-1与cTnI的蛋白质水平(图6)
7.1MuRF-1的蛋白质表达水平 经内参照校正后,MI组MuRF-1蛋白质水平明显高于sham组,差异显著(P<0.01)。与MI组相比较,MG-132抑制了MuRF-1蛋白质水平(P<0.05),但仍高于sham组。而TNF-α则显著上调了MuRF-1的蛋白质表达(P<0.01)。
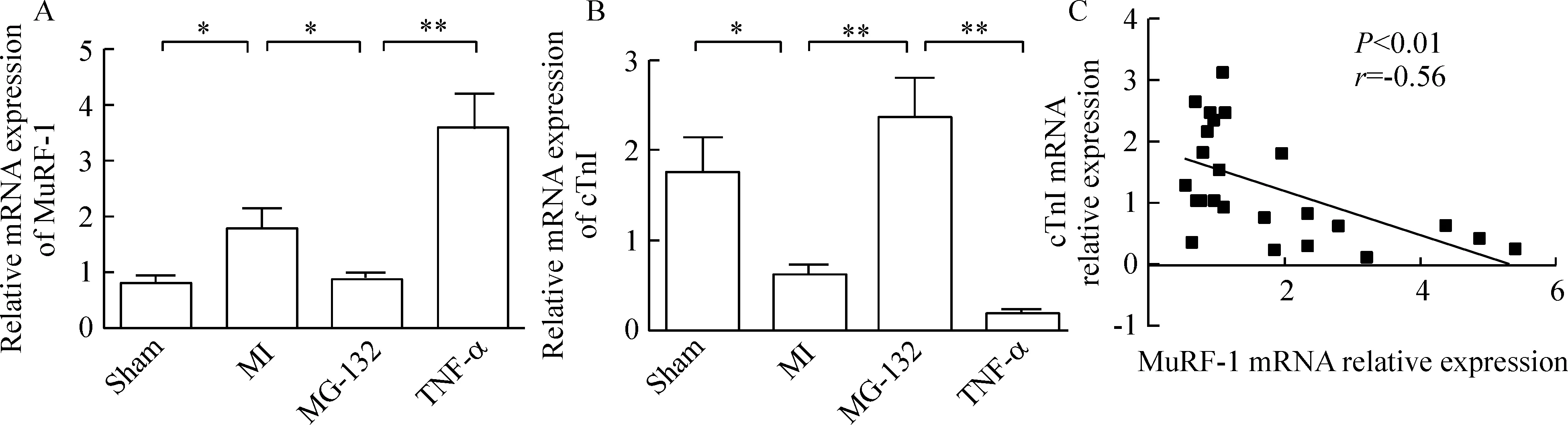
Figure 4. Quantification of MuRF-1(A) and cTnI(B) mRNA expression as well as correlation analysis between the expression of MuRF-1 and troponin I(C) in the myocardium were measured by real-time PCR. Sham: sham group; MI: myocardial infarction group; MG-132: MG-132 group; TNF-α: tumor necrosis factor-α group. ±s. n=6.*P<0.05,**P<0.01.
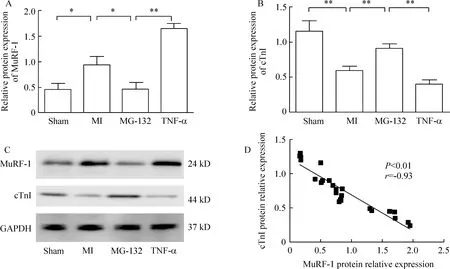
Figure 6. Relative protein expression of MuRF-1(A, C) and cTnI(B, C) as well as the correlation of MuRF-1 and cTnI(D) in the myocardium. Relative protein expression of MuRF-1 and cTnI was quantified densitometrically using the LabWorks 4.5 software and calculated according to the GAPDH reference bands. Sham: sham group; MI: myocardial infarction group; MG-132: MG-132 group; TNF-α: tumor necrosis factor α group. ±s. n=6. *P<0.05,**P<0.01.
7.2cTnI的蛋白质表达水平 经内参照校正后,与sham组相比较,MI组cTnI蛋白质表达明显降低(P<0.01),差异显著。与MI组相比,MG-132组cTnI蛋白质表达量明显增加(P<0.01),TNF-α组cTnI蛋白质表达明显降低,差异显著(P<0.01)。
7.3MuRF-1与cTnI蛋白质表达相关性分析 对4组大鼠心肌MuRF-1和cTnI的蛋白质表达量进行相关性分析,结果显示MuRF-1与cTnI之间呈显著负相关(r=-0.93,P<0.01)。
讨 论
本实验对心肌梗死后慢性心力衰竭大鼠进行研究,结果显示,心肌梗死后7周大鼠心功能显著恶化,心肌结构紊乱;TNF-α使上述心肌损害加重,其机制可能是通过上调MuRF-1的水平,加速心肌cTnI降解所致。当使用蛋白酶体抑制剂MG-132后,MuRF1表达降低,cTnI水平升高,大鼠的心肌结构和心功能得到改善。
本实验中,MG-132组大鼠慢性心力衰竭的发生率为50%,较心肌梗死组(75%)有下降趋势;与MG-132组相比,MI组和TNF-α组的死亡率有增加趋势,无明显差异的原因可能主要在于样本量较小。但结果说明抑制蛋白酶体系统能够使心衰大鼠的死亡率、心肌梗死后心衰的发生率有下降趋势。而且,MG-132还显著降低了MI组大鼠的左室舒张末压,使左室最大收缩速率增加,作为慢性心力衰竭重要指标之一的NT-proBNP[7]水平降低,改善了大鼠的心脏功能,再次印证了我们以前的研究结果[8],即蛋白酶体抑制剂具有心肌保护作用,且能够降低NT-proBNP水平。
心力衰竭的发生机制目前还不明确,越来越多的证据表明泛素蛋白酶体系统功能失衡是其重要原因。由于蛋白质合成及降解的精确调控维持了正常的心脏结构和功能[9],蛋白质质量控制异常将会引起心肌纤维退化和心力衰竭的发生[10],而作为蛋白质质量控制之一的泛素蛋白酶体系统可能起了重要作用。目前认为,与心肌萎缩相关的E3泛素连接酶MuRF-1与肌小节 M带结构的稳定性[2, 3]有关,cTnI可能是MuRF1的底物之一且具有高度选择性[11]。
由于蛋白酶体抑制剂MG-132能够抑制26S蛋白酶体,从而阻断E3泛素连接酶MuRF1的活性,而TNF-α能够升高MuRF-1约3倍[12]。为研究与萎缩相关的MuRF-1在慢性心力衰竭中的作用,故本实验特设MG-132组和TNF-α组作为对照研究,以抑制或者刺激MuRF-1表达,从而观察MuRF1在慢性心衰中的作用。
本研究中,原位杂交和荧光定量PCR半定量结果均显示,心肌梗死显著增加了MuRF-1 mRNA水平,而cTnI表达则显著降低,TNF-α却使MuRF-1 mRNA水平更加升高,MG-132有效地抑制了MuRF-1 mRNA水平;Western blotting结果发现各组大鼠的MuRF-1与cTnI的蛋白质水平与其mRNA表达相吻合,而且MuRF1的mRNA水平和蛋白质水平均与cTnI表达呈显著负相关。这与Conraads等[13]的研究结果一致。但他们发现在2周内发生心肌梗死的患者其远离心肌梗死部位MuRF-1的表达水平降低、心肌肥厚,这与本研究结果不同,但本实验动物为慢性心力衰竭样本(心梗后7周),与Conraads等[13]的样本不同(心梗2周内),而且该实验只检测了远离心肌梗死部位的心肌组织,故具有一定的局限性,而且,近期研究表明,慢性心衰模型中泛素蛋白酶体的活性是被激活的[14]。因此,本实验从基因水平及蛋白质水平均证明,心肌梗死后心力衰竭与心肌中MuRF-1的上调有关,而且MuRF-1 的上调加速了cTnI的降解,这可能是慢性心力衰竭的重要原因。这与体外研究报道一致[12],而且研究还发现,MuRF-1转基因大鼠的心脏表现出左心室壁变薄和心功能受损;在主动脉缩窄的模型中,MuRF-1转基因大鼠可导致心脏快速衰竭,超生心动描记术显示,与野生型大鼠相比,左心室的前壁与后壁的厚度分别减少了19.3%和19.8%,射血分数降低[15]。说明MuRF-1的过表达促进心肌梗死后心衰的发生。由于MuRF-1对cTnI的作用,意味着可能通过对MuRF-1的调节以减缓慢性心力衰竭心室重塑的进程。
本研究还证明,TNF-α能够上调慢性心衰大鼠心脏的MuRF-1水平,可以做这样的推测,即TNF-α对心肌的损害作用一个重要方面是通过上调MuRF-1实现的。由于cTnI的降解与心肌收缩力的损害有关[16],cTnI降解越严重,单个心肌细胞收缩力越低[17],cTnI的缺失可导致大鼠心肌收缩力的降低和心功能失常[15]。MuRF-1对cTnI具有特异性、靶向性降解的能力,因此通过腹腔内注射TNF-α增加MuRF-1的表达会影响cTnI的稳定性。体外研究[11]支持了本研究的结果。研究发现,增加MuRF-1的表达可以导致cTnI的半衰期缩短[11]。当用MG-132干预后,MuRF-1转基因的大鼠中cTnI的水平增加了210%,免疫沉淀法发现MuRF-1增加cTnI的泛素化降解,MG-132增加了cTnI的水平。
MuRF-1对肌钙蛋白的作用可能是通过调节其能量代谢和蛋白质合成而实现的。近期研究表明,MuRF-1的激活可以引起肌钙蛋白翻译异常[4]而导致骨骼肌收缩力降低,与丙酮酸脱氢酶和3-羟基脱氢酶有关[18]。因此,MuRF-1对于心梗后心衰心肌的作用是否也存在着能量代谢和蛋白合成与降解之间的协同偶联机制还需要进一步证明。
本研究证明,在慢性心力衰竭的心肌中,cTnI是E3泛素连接酶MuRF1的底物蛋白,通过抑制泛素蛋白酶体系统能够抑制MuRF1所致的泛素化降解,从而改善心功能。此研究为慢性心力衰竭的治疗提供了新的治疗思路。
[1] Ferrari R, Ceconi C, Campo G, et al. Mechanisms of remodelling: a question of life(stem cell production) and death(myocyte apoptosis)[J]. Circ J, 2009, 73(11):1973-1982.
[2] Centner T, Yano J, Kimura E, et al. Identification of muscle specific ring finger proteins as potential regulators of the titin kinase domain [J]. J Mol Biol, 2001, 306(4):717-726.
[3] McElhinny AS, Kakinuma K, Sorimachi H, et al. Muscle-specific RING finger-1 interacts with titin to regulate sarcomeric M-line and thick filament structure and may have nuclear functions via its interaction with glucocorticoid modulatory element binding protein-1[J]. J Cell Biol, 2002, 157(1):125-136.
[4] Adams V, Mangner N, Gasch A, et al. Induction of MuRF1 is essential for TNF-α-induced loss of muscle function in mice[J]. J Mol Biol, 2008, 384(1):48-59.
[5] 陈章荣,罗开良,殷跃辉,等.蛋白酶体抑制剂MG-132改善大鼠心肌梗死后心肌结构重塑[J]. 第三军医大学学报,2008,30(8):750-753.
[6] Dekhuijzen PN, Heunks LM. Proteasome inhibition improves diaphragm function in congestive heart failure rats [J]. Am J Physiol Lung Cell Mol Physiol, 2008, 294(6): L1260-L1268.
[7] Dronavalli VB, Ranasinghe AM, Venkateswaran RJ, et al. N-terminal pro-brain-type natriuretic peptide: a biochemical surrogate of cardiac function in the potential heart donor[J]. Eur J Cardiothorac Surg, 2010, 38(2):181-186.
[8] 戴翠莲,姜黔峰,张新民. 蛋白酶体抑制剂对心肌缺血再灌注大鼠CHIP、HSP70的影响[J]. 第三军医大学学报,2010,32(6):550-553.
[9] Fielitz J, van Rooij E, Spencer JA, et al. Loss of muscle-specific RING-finger 3 predisposes the heart to cardiac rupture after myocardial infarction [J]. Proc Natl Acad Sci USA, 2007, 104(11):4377-4382.
[10]Su H, Wang X. The ubiquitin-proteasome system in cardiac proteinopathy: a quality control perspective [J]. Cardiovasc Res, 2010, 85(5):253-262.
[11]Kedar V, McDonough H, Arya R, et al. Muscle-specific RING finger 1 is a bona fide ubiquitin ligase that degrades cardiac troponin I [J]. Proc Natl Acad Sci USA, 2004,101(52):18135-18140.
[12]Adams V, Linke A, Wisloff U, et al. Myocardial expression of Murf-1 and MAFbx after induction of chronic heart failure: Effect on myocardial contractility [J]. Cardiovasc Res, 2007,73(1):120-129.
[13]Conraads VM, Vrints CJ, Rodrigus IE, et al. Depressed expression of MuRF1 and MAFbx in areas remote of recent myocardial infarction: a mechanism contributing to myocardial remodeling?[J]. Basic Res Cardiol, 2010, 105(2):219-226.
[14]Depre C, Wang Q, Yan L, et al. Activation of the cardiac proteasome during pressure overload promotes ventricular hypertrophy [J]. Circulation, 2006, 114(17):1821-1828.
[15]Willis MS, Schisler JC, Li L, et al. Cardiac muscle ring finger-1 increases susceptibility to heart failureinvivo[J]. Circ Res, 2009, 105(1):80-88.
[16]Cohen S, Brault JJ, Gygi SP, et al. During muscle atrophy, thick, but not thin,filament components are degraded by MuRF1-dependent ubiquitylation [J]. J Cell Biol, 2009,185(6): 1083-1095.
[17]van der Velden J, Merkus D, Klarenbeek BR, et al. Alteration in myofilament function contributes to left ventricular dysfunction in pigs early after myocardial infarction [J].Circ Res, 2004, 95(11):e85-e95.
[18]Hirner S, Krohne C, Schuster A, et al. MuRF1-dependent regulation of systemic carbohydrate metabolism as revealed from transgenic mouse studies. [J]. J Mol Biol, 2008, 379(4): 666-677.
Transformationofmuscleringfinger1onchronicheartfailureinmyocardialinfarctionrats
DAI Cui-lian, ZHANG Yun, JIANG Qian-feng
(DepartmentofCardiology,TheAffiliatedHospital,ZunyiMedicalCollege,Zunyi563003,China.E-mail:dai_cui_lian@yahoo.com.cn)
AIM: To investigate the change and the mechanism of muscle ring finger 1(MuRF-1) on heart functions and cardiac troponin I(cTnI) in myocardial infarction rats and to analyze the correlation between MuRF-1 and cTnI.METHODSThe rats either with coronary artery ligation or with sham operation(48 rats) were divided into 4 groups: sham(sham-operated) group, MI(myocardial infarction) group, MG-132(N-[(phenylmethoxy)carbonyl]-L-leucyl-N-[(1S)-1-formyl-3-methylbutyl]-L-leucinamide) group and TNF-α(tumor necrosis factor alpha) group.The animals were treated with saline(sham and MI group),MG-132(MG-132 group) or TNF-α(TNF-α group) by intraperitoneal injection. Hemodynamics, N-terminal pro-brain natriuretic peptide(NT-proBNP) and cardio-pathologic changes were observed. Both mRNA and protein expressions of MuRF-1 and cTnI in the left ventricles were determined by real-time PCR andinsituhybridization or by Western blotting. The correlation between MuRF-1 and cTnI was also analyzed.RESULTSCompared with MI group and TNF-α group, the mortality and the morbidity of the animals had a decreasing tendency in MG-132 group, and NT-proBNP level as well as the left ventricular end-diastolic pressure(LVEDP) were significantly decreased(P<0.05 andP<0.01, respectively).Left ventricular systolic pressure(LVSP) and the maximum rate of left ventricular pressure rise(+dp/dtmax) were pronouncedly increased(P<0.01).The heart injury was also amended after MG-132 treatment. Compared with sham group, the mRNA and protein relative expressions of MuRF-1 were predominantly increased in MI group(P<0.05), and the cTnI levels were decreased (P<0.05). MG-132 depressed the level of MuRF-1(P<0.05) and enhanced the level of cTnI(P<0.01) at both mRNA and protein levels. In contrast, treatment with TNF-α worsened the heart failure,reduced the cTnI level and raised MuRF-1 level. The expression of MuRF-1 at mRNA and protein levels had significantly negative correlation with the expression of cTnI in all groups.CONCLUSIONThese data suggest that MuRF-1 is significantly increased in chronic heart failure and aggravates heart dysfunction by depressing cTnI level. Inhibition of proteasome activity diminishes MuRF-1 expression. MuRF-1 may be involved in the mechanism of chronic heart failure.
Heart failure; Muscle ring finger 1; Troponin Ⅰ
R541.05
A
10.3969/j.issn.1000-4718.2011.02-002
1000-4718(2011)02-0215-08
2010-08-30
2010-10-27
国家自然科学基金资助项目(No. 30860295)
△通讯作者 Tel: 0852-8609001; E-mail: dai_cui_lian@yahoo.com.cn

