肿瘤坏死因子相关凋亡诱导配体参与雷帕霉素诱导血管内皮细胞功能损伤的体外研究*
叶 盛, 张怀勤, 林以诺, 黄伟剑, 张艳丽, 邵小琳
(温州医学院附属第一医院心内科, 心血管生物和基因研究所,浙江 温州 325000)
肿瘤坏死因子相关凋亡诱导配体参与雷帕霉素诱导血管内皮细胞功能损伤的体外研究*
叶 盛, 张怀勤△, 林以诺, 黄伟剑, 张艳丽, 邵小琳
(温州医学院附属第一医院心内科, 心血管生物和基因研究所,浙江 温州 325000)
目的探讨雷帕霉素对内皮细胞凋亡和增殖、迁移能力的影响,以及肿瘤坏死因子相关凋亡诱导配体(TRAIL)表达水平的变化。方法用浓度为0、1、10、100 μg/L 的雷帕霉素孵育内皮细胞24 h,应用CCK8法检测血管内皮细胞的增殖能力,Transwell小室和划痕试验检测细胞迁移能力,DAPI染色观察凋亡细胞核形态改变,Western blotting法检测caspase-3活性以显示血管内皮细胞的凋亡,并用 Western blotting检测TRAIL在凋亡的内皮细胞中的表达。结果雷帕霉素(1-100 μg/L)能诱导血管内皮细胞凋亡并抑制其迁移能力(P<0.01)。除雷帕霉素1 μg/L外, 10 μg/L和100 μg/L雷帕霉素均能抑制内皮细胞增殖能力(P<0.01),同时雷帕霉素(10-100 μg/L)使TRAIL蛋白表达增加,两者作用均呈浓度依赖性(P<0.01)。结论雷帕霉素能诱导内皮细胞发生凋亡并抑制其增殖和迁移能力。TRAIL表达上调与雷帕霉素诱导血管内皮细胞损伤有一定的相关性。
雷帕霉素; 内皮细胞; 细胞凋亡; 细胞增殖; 细胞迁移; 肿瘤坏死因子相关凋亡诱导配体
冠心病是危害人民健康的主要疾病之一,近年来经皮腔内冠状动脉介入治疗(percutaneous coronary intervention,PCI) 广泛用于冠心病的非药物治疗,为冠心病患者带来极大的获益。但是支架的植入又带来两大棘手的问题。首先是支架内血栓的形成。早期血栓问题已通过长期服用双联抗血小板药物基本得到了解决。其次是支架内再狭窄。由于PCI过程中球囊扩张及支架作为外源性异物的植入对血管内皮的刺激,患者的冠脉往往出现内膜过度增生而导致支架再狭窄。早期的金属裸支架由于过高的再狭窄率(有报道约30%-50%)导致其使用受限,而以雷帕霉素洗脱支架为代表的药物涂层支架能阻止细胞周期进展、有效抑制平滑肌细胞迁移、增殖和胞外基质的合成,抑制血管内膜增生,从而明显减少支架内再狭窄和临床不良事件发生率;多支、复杂病变患者亦能够从中获益。然而雷帕霉素洗脱支架并不能完全解决支架所面临的问题。虽然支架的药物涂层(如雷帕霉素)能够通过抑制平滑肌细胞及细胞外基质合成从而抑制支架的再狭窄,但雷帕霉素也会抑制正常的内皮细胞及内皮前体细胞在病变冠脉内的再内皮化,导致部分患者一旦停用氯吡格雷后会出现晚期支架内血栓,同时它也会导致一定程度的冠脉内皮功能不全、侧枝功能受损,而不利于冠心病患者心肌血运的恢复[1-3]。如何解决支架表面的药物涂层对周围正常的内皮细胞及内皮祖细胞的功能抑制,从而达到既能抑制支架再狭窄,又能保证血管的再内皮化而防止血栓形成成为新时代药物支架面临的重点和难点。
血管内皮是由单层内皮细胞排列组成的血管床,也是血管壁与循环中血液及其它物质的屏障。作为人体最大的内分泌、旁分泌器官,及许多活性物质的靶器官,它在调节血管收缩舒张状态、维持凝血及纤溶系统平衡、抑制血小板聚集、抑制炎性细胞与血管内皮细胞间的黏附以及调控血管平滑肌生长等方面有重要生理功能。因而内皮细胞功能不全与心血管疾病的发生发展密切相关。研究表明高同型半胱氨酸血症、热休克蛋白90(heat shock protein 90, HSP90)、非对称二甲基精氨酸、20 羟基廿碳四烯酸、糖尿病、尿酸、高血压、冠心病、吸烟、高龄及肥胖等均可影响内皮功能[4-7]。
肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是新发现的肿瘤坏死因子(tumor necrosis factor,TNF)超家族成员,它可以通过它的受体DR4和DR5选择性诱导细胞凋亡,不仅在肿瘤组织的凋亡中发挥重要作用[8],而且在某些疾病的病理性损伤修复中也起到一定作用,并且TRAIL诱导的细胞凋亡与caspase-3关系密切。Li 等[9]发现TRAIL的表达可致人脐静脉内皮细胞凋亡,但是其是否在雷帕霉素诱导的内皮细胞凋亡的过程中起作用还不甚清楚。本研究旨在明确TRAIL的表达是否存在与雷帕霉素诱导的内皮细胞发生凋亡相关。
材 料 和 方 法
1材料和试剂
胎牛血清、0.05%胰酶、RPMI-1640培养基、PBS和Hanks液购自Gibco,雷帕霉素购自福建科瑞药物有限公司,CCK-8细胞计数试剂盒购自日本株式会社同仁化学研究所,Transwell小室购自Corning,二甲基亚砜(dimethyl sulfoxide,DMSO)购自Invitrogen,活化caspase-3、TRAIL抗体购自Abcam, GAPDH抗体购自康成公司,ECL 化学发光显色试剂盒购自Cell Signal。
2方法
2.1细胞培养 本实验采用体外培养的人脐静脉内皮细胞株(购自ATCC)为研究对象,细胞生长于含10%胎牛血清的RPMI-1640 培养基中(Gibco),含1%青-链霉素,在5%CO2、37 ℃培养箱内孵育,雷帕霉素溶于DMSO,终浓度分别为1 μg/L、10 μg/L、100 μg/L,细胞在无血清培养基孵育同步化48 h后,换无血清RPMI-1640、不同浓度雷帕霉素(1 μg/L、10 μg/L、100 μg/L)继续孵育24 h。
2.2实验分组 分为4组:(1)正常对照组: 加入配制雷帕霉素的溶剂(0.01% DMSO);(2) 雷帕霉素各浓度干预组(共3组):分别用1、10、100 μg/L雷帕霉素(含0.01%DMSO RPMI-1640培养基)与内皮细胞共同孵育24 h。
2.3细胞增殖能力检测 各组细胞培养24 h后以0.05%胰蛋白酶消化收集贴壁细胞,加入1 mL培养液重悬后计数。以5 000 cells/well接种到96孔培养板, 分组培养24 h后,更换新鲜培养液,每孔加入10 μL CCK-8 细胞计数试剂,于37 ℃孵育4 h,酶标仪450 nm下读取吸光度(A)值。
2.4细胞迁移能力检测
① Transwell小室 各组细胞培养24 h后以0.05%胰蛋白酶消化收集贴壁细胞,加入1 mL培养液重悬后计数。调整细胞密度,于24孔板中放入Transwell小室(孔径8 μm)。下室加入600 μL含10%FBS的培养基,上室加入100 μL细胞悬液,在培养箱中孵育24 h。取出Transwell小室,PBS淋洗,用棉签擦去微孔膜上层的细胞, 4%多聚甲醛固定10 min,0.25%结晶紫染色。随机计数5个视野(×400),评价内皮细胞(endothelial cells,ECs)的迁移能力。
② 划痕实验 以0.05%胰蛋白酶消化收集贴壁细胞,重悬后计数。以相同细胞数接种到24孔培养板,24 h后更换无血清的培养基同步化48 h,然后随机分组处理,每组3个复孔。各组细胞培养24 h后,用无菌1 000 μL枪头(直径约1 mm)在各孔细胞生长单层的相同位置划平行直线,造成“伤口”,PBS洗2次,去除划痕造成的脱落的细胞;加入含5%FBS的培养液2 mL,继续培养24 h;吸除培养液,PBS洗3次,4%甲醛固定20 min;1% Triton X-100作用5 min;PBS洗3次,苏木精染色5 min,双蒸水冲洗;显微镜下观察,随机选取3个视野拍摄(×10),计数迁移过划痕边缘的细胞数,计算均值。
2.5DAPI观察细胞凋亡形态学变化 以0.05%胰蛋白酶消化收集贴壁细胞,重悬后计数并调整细胞浓度为1×108cells/L,取300 μL细胞悬液接种到置于6孔培养板的2 cm×2 cm的盖玻片上,置孵箱2 h细胞贴壁后加入1 mL培养液,随机将玻片分为对照组、10 μg/L雷帕霉素和100 μg/L雷帕霉素组,每组3片,培养24 h后,免疫染色固定液固定15 min,DAPI染色15 min(避光操作),吸除染液,PBS洗涤2次,用抗荧光淬灭剂封片后于激光共聚焦显微镜下观察DAPI染色细胞核形态:出现细胞核呈波纹状或呈折缝样,部分染色质浓缩状态;染色质高度凝聚、边缘化;细胞核呈碎块状致密浓染,均认为是凋亡细胞核。
2.6检测caspase-3活性 细胞接种于6孔板中培养,换无血清培养基孵育48 h使细胞同步化,各组细胞干预处理后,提取蛋白。以含1%PMSF的RIPA裂解液裂解细胞,12 000×g4 ℃离心15 min,提取上清,BCA法测定蛋白浓度后,取等量蛋白样品(40 μg)点样,10%SDS-PAGE凝胶进行电泳,湿转至PVDF膜上,300 mA 1 h,含5%脱脂奶粉TBST 37 ℃封闭1 h,加兔抗人activated caspase-3多克隆抗体(1∶1 000)为Ⅰ抗,以GAPDH作为内参照标化caspase-3蛋白质表达。4 ℃过夜,TBST充分洗涤后加HRP标记IgG(1∶1 000)为Ⅱ抗,室温作用1 h,洗膜后ECL系统显色,用Quantity One 凝胶成像分析系统进行半定量分析。
2.7TRAIL表达的检测 细胞接种于6孔板中培养,换无血清培养基孵育48 h使细胞同步化,各组细胞干预处理后,提取蛋白。以含1%PMSF的RIPA裂解液裂解细胞,12 000×g4 ℃离心15 min,提取上清,BCA法测定蛋白浓度后,取等量蛋白样品(40 μg)点样,10%SDS-PAGE凝胶进行电泳,湿转至PVDF膜上,300 mA 1 h,含5%脱脂奶粉TBST 37 ℃封闭1 h,加兔抗人TRAIL多克隆抗体(1∶1 000)为 Ⅰ 抗,以GAPDH作为内参照标化TRAIL蛋白质表达。4 ℃过夜,TBST充分洗涤后加HRP标记IgG(1∶1 000)Ⅱ抗,室温作用1 h,洗膜后ECL系统显色,用Quantity One 凝胶成像分析系统进行半定量分析。
3统计学处理
结 果
1雷帕霉素对内皮细胞增殖能力的影响
采用CCK-8法检测各组细胞的增殖能力变化,结果显示,与对照组相比,除1 μg/L雷帕霉素作用组外,10 μg/L和100 μg/L雷帕霉素均能抑制内皮细胞增殖能力(P<0.01),且100 μg/L雷帕霉素作用组与1 μg/L雷帕霉素作用组之间差异显著(P<0.01),见图1。
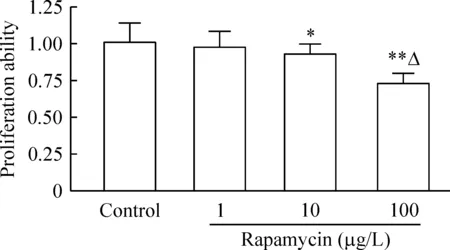
Figure 1. Effect of rapamycin on the proliferation ability of ECs.s. n=4.*P<0.05,** P<0.01 vs control group; △P<0.05 vs rapamycin 1 μg/L group.
2雷帕霉素对内皮细胞迁移能力的影响
采用Transwell小室和划痕实验检测各组内皮细胞迁移能力的变化,结果显示,与对照组相比,雷帕霉素(1-100 μg/L)能抑制内皮细胞的迁移能力(P<0.01),见图2、3。
3雷帕霉素对内皮细胞凋亡形态的影响
使用激光共聚焦显微镜观察雷帕霉素对ECs的凋亡形态学改变,DAPI染色细胞核改变见图4。对照组呈正常细胞核染色,为均匀浅蓝色;雷帕霉素10 μg/L组和100 μg/L组ECs细胞核出现凋亡形态改变,核浓缩,见蓝色荧光。
4雷帕霉素对内皮细胞凋亡的影响
采用Westorn blotting法检测caspase-3蛋白的活化来显示细胞凋亡率,结果显示:1-100 μg/L雷帕霉素能够增加内皮细胞caspase-3蛋白的表达(P<0.01),说明雷帕霉素能诱导内皮细胞凋亡,见图5。
5雷帕霉素对内皮细胞TRAIL表达的影响
采用Western blotting检测雷帕霉素是否能诱导内皮细胞中TRAIL的表达。结果显示,除1 μg/L雷帕霉素作用组外,10 μg/L和100 μg/L雷帕霉素作用24 h后TRAIL表达与对照组比较显著增加(P<0.01),且10 μg/L和100 μg/L雷帕霉素作用组与1 μg/L雷帕霉素作用组之间差异显著(P<0.01),见图6。
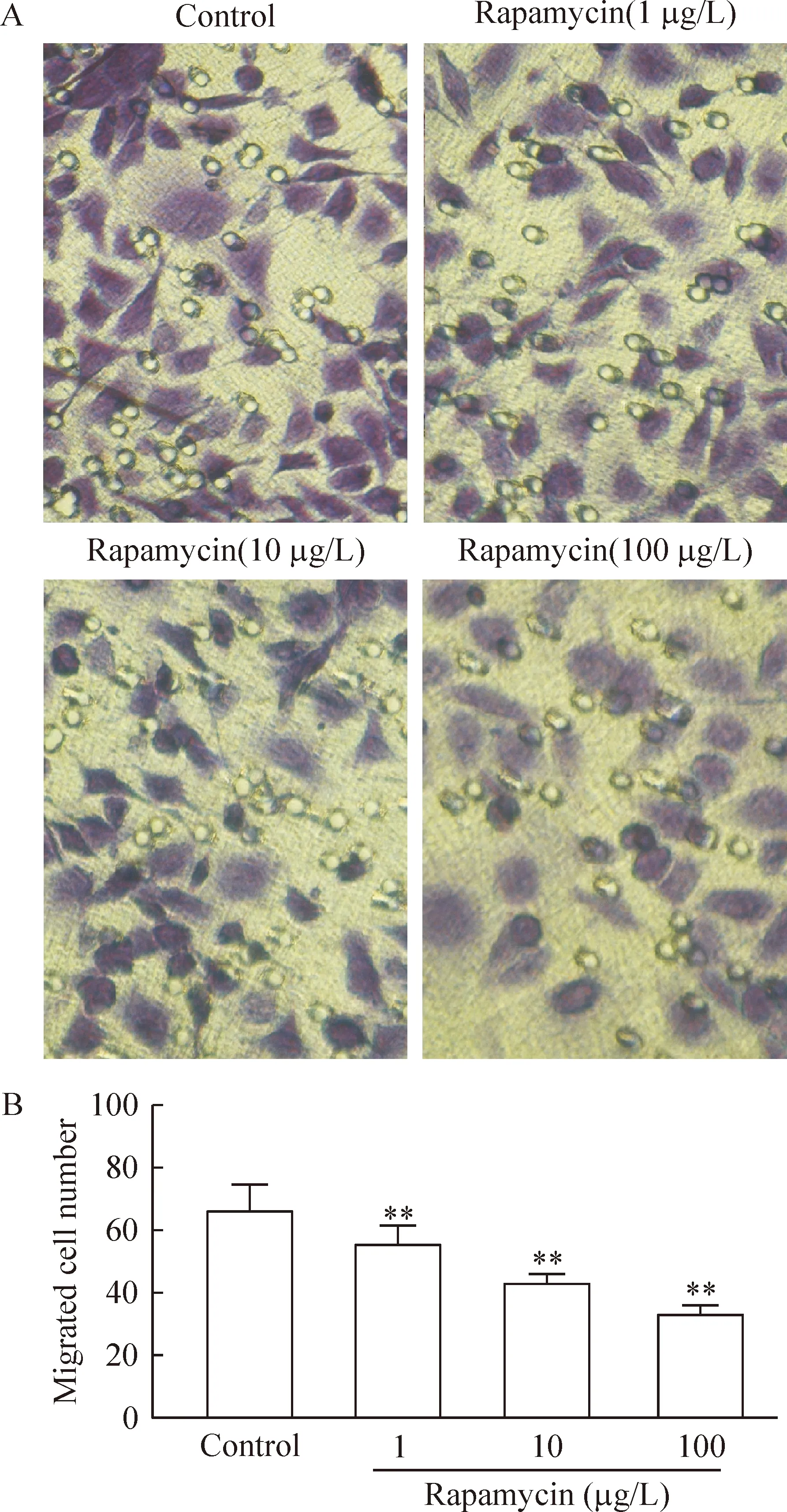
Figure 2. The migration ability of human umbilical vein endothelial cells detected by Transwell chambers(×400). n=3.**P<0.01 vs control group.
讨 论
血管内皮由单层内皮细胞排列组成,是血管壁与循环中血液及其它物质的屏障,在调节血管收缩舒张状态、维持凝血及纤溶系统平衡、抑制血小板聚集、抑制炎症细胞与血管内皮细胞间的黏附以及调控血管平滑肌生长等方面有重要生理功能。受损内膜的再内皮化可由损伤周边内皮细胞增殖、迁移修复。内皮损伤与功能失调是PCI术后再狭窄发生的启动因素,促进内皮恢复已成为预防PCI术后再狭窄的新策略。
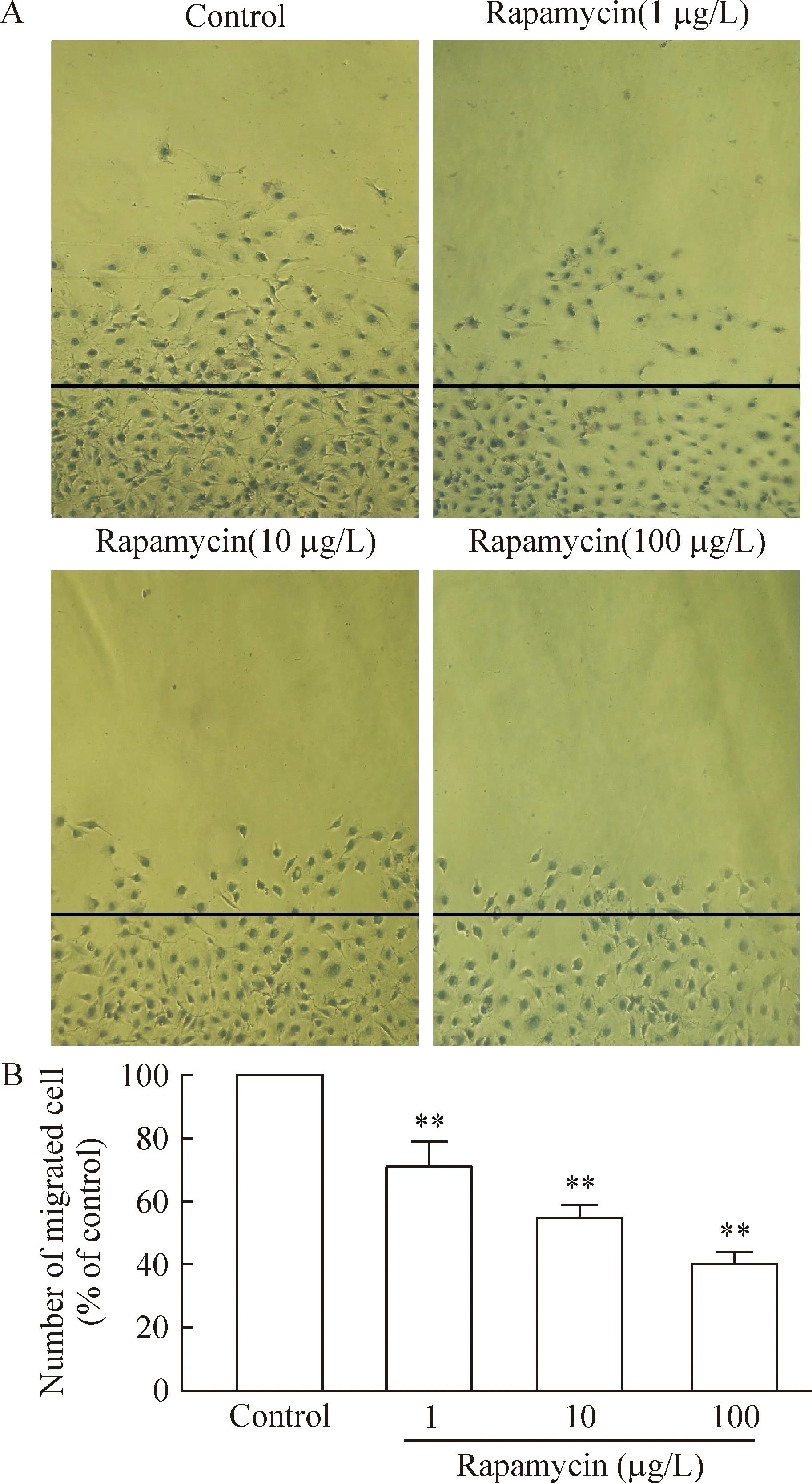
Figure 3. The migration ability of human umbilical vein endothelial cells dected by wound healing test(×100). ±s. n=3.**P<0.01 vs control group.
近年来雷帕霉素洗脱支架广泛应用于临床,缓慢洗脱的雷帕霉素通过与FKBP-12 结合形成RAPA-FKBP-12复合物并与其靶蛋白mTOR(mammalian target of rapamycin)结合,抑制mTOR活性,阻止细胞周期进展,能有效抑制平滑肌细胞迁移、增殖和胞外基质的合成。但多个研究均显示[10-14]雷帕霉素在抑制平滑肌细胞迁移、增殖的同时,能促进内皮细胞凋亡、抑制其增殖和迁移,能降低一些生长、趋化因子如血管内皮生长因子(vascular endothelial growth factor,VEGF)等在血管内皮的表达,并可通过阻断mTOR蛋白来抑制他汀类药物、VEGF等诱导的内皮细胞增殖与迁移,但其具体机制尚不清楚。而如何解决支架表面的药物涂层对周围正常的内皮细胞及内皮祖细胞的功能抑制,从而达到既能抑制支架再狭窄,又能保证血管的再内皮化而防止血栓形成成为新时代药物支架面临的重点和难点。

Figure 4. Morphological changes in apoptotic ECs(×400).Apoptotic nuclei are condensed or fragmented and brightly stained with DAPI.

Figure 5. Effect of rapamycin on caspase-3 activation in ECs. ±s. n=3. Rapamycin(1-100 μg/L) activated caspase-3 in a dose-dependent manner.** P<0.01 vs control group.
TRAIL是由Wiley 等[15]于1995年首先发现并克隆成功的肿瘤坏死因子家族第3个新成员,它与TNF家族的FasL和TNF-α一样可以引起细胞的凋亡。TRAIL是II型跨膜蛋白,诱骗受体DcR1和DcR2胞内没有死亡机构域(death domain, DD),仅表达于正常细胞中,保护细胞不受到TRAIL的凋亡作用,死亡受体DR4和DR5胞内含有由79个氨基酸组成的DD,被激活之后形成异源二聚体,通过胞内的DD和fas相关死亡结构域(Fas-associated death domain,FADD)与caspase-8的死亡效应结构
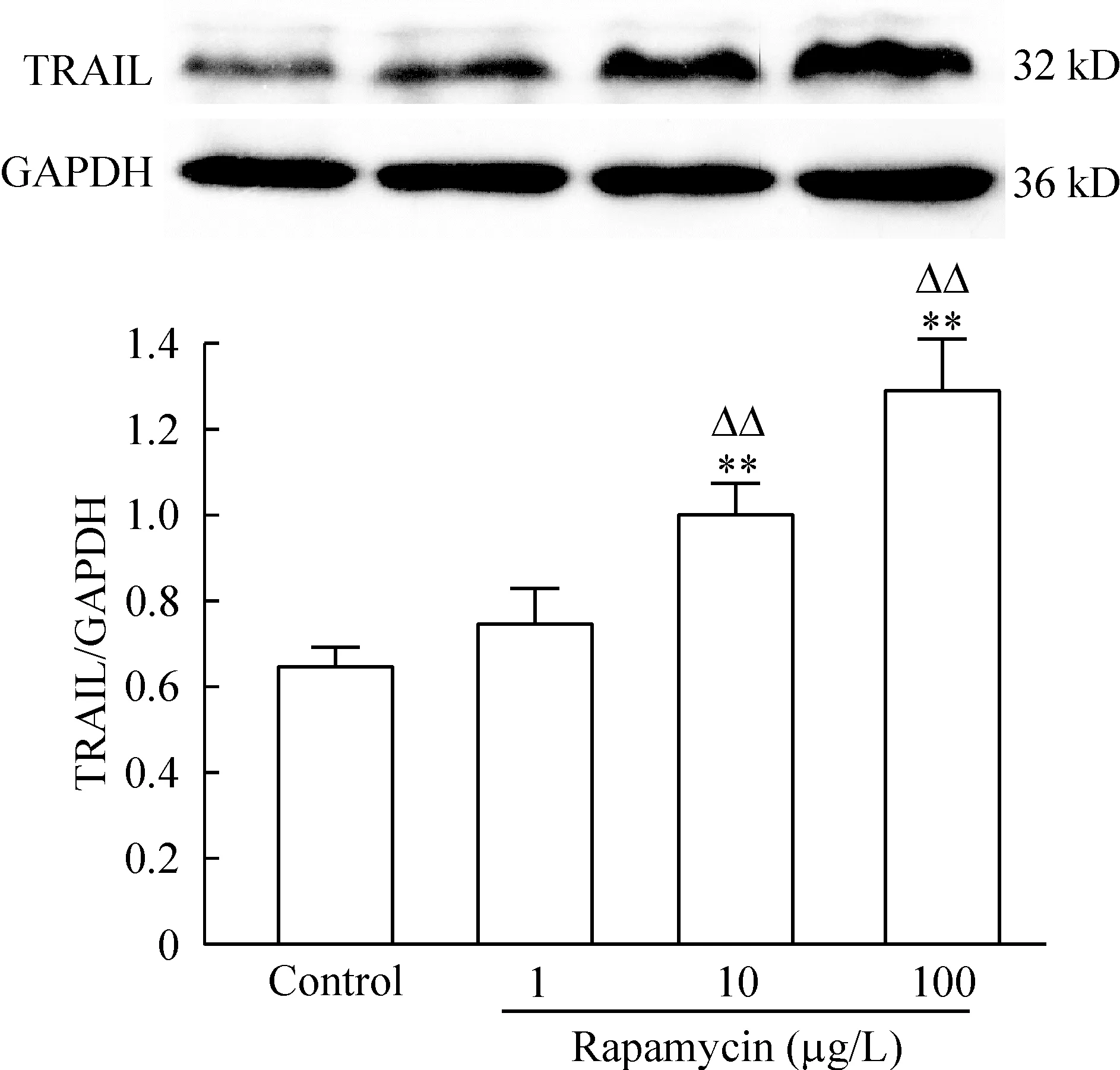
Figure 6. Effect of rapamycin on expression of TRAIL in ECs.s. n=3.** P<0.01 vs control group;△△P<0.01 vs rapamycin 1 μg/L group.
域(death-effector domain,DED)区结合,引起caspase家族的级联反应,最终使caspase-3活化而导致细胞凋亡。现认为caspase-3是细胞凋亡过程中最主要的终末剪切酶,是caspase家族中的最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子,是多种凋亡刺激信号转导的汇聚点,它的活化是凋亡进入不可逆阶段的标志。目前对TRAIL的研究也多集中在肿瘤领域,而在心血管领域的研究较少见。Li等[9]研究证实,脐静脉血管内皮细胞中表达TRAIL-R1、TRAIL-R2,并发现TRAIL可致血管内皮细胞凋亡。本实验研究发现雷帕霉素可以诱导体外培养的内皮细胞发生凋亡并抑制其增殖、迁移能力,并应用Western blotting法检测TRAIL及其在雷帕霉素损伤的血管内皮细胞中有大量的表达,表明TRAIL分子在雷帕霉素诱导的血管内皮细胞损伤中有可能发挥着一定的作用,这可能是雷帕霉素抑制血管内支架置入术后内皮修复及导致迟发性支架内血栓形成的机制之一。而是否能以此为靶点进行干预或通过给予TRAIL抑制剂来防治支架后内皮功能不全及这样做是否会带来其它负面效应,尚需进一步研究探讨。
[1] Hofma SH, van der Giessen WJ, van Dalen BM, et al. Indication of long-term endothelial dysfunction after sirolimus-eluting stent implantation[J]. Eur Heart J, 2006,27(2):166-170.
[2] Meier P, Zbinden R, Togni M, et al. Coronary collateral function long after drug-eluting stent implantation[J]. J Am Coll Cardiol, 2007,49(1):15-20.
[3] Luscher TF, Steffel J, Eberli FR, et al. Drug-eluting stent and coronary thrombosis: biological mechanisms and clinical implications[J].Circulation,2007, 115(8): 1051-1058.
[4] Elesber AA, Solomon H, Lennon RJ, et al. Coronary endothelial dysfunction is associated with erectile dysfunction and elevated asymmetric dimethylarginine in patients with early atherosclerosis[J]. Eur Heart J, 2006, 27(7):824-831.
[5] Wang JS, Singh H, Zhang F, et al. Endothelial dysfunction and hypertension in rats transduced with CYP4A2 adenovirus[J]. Circulation, 2006, 98(7): 962-969.
[6] Su Y, Liu XM, Sun YM, et al. The relationship between endothelial dysfunction and oxidative stress in diabetes and prediabetes[J]. Int J Clin Pract, 2008, 62(6): 877-882.
[7] Zoccali C,Maio R, Mallamaci F, et al. Uric acid and endothelial dysfunction in essential hypertension[J]. J Am Soc Nephrol, 2006, 17(5): 1466-1471.
[8] 戚之琳,李 璐,汪 茗,等.阿司匹林增强TRAIL诱导的HepG-2细胞凋亡[J].中国病理生理杂志, 2010,26(8):1555-1558.
[9] Li JH, Kirkiles-Smith NC, McNiff JM, et al. TRAIL induces apoptosis and inflammatory gene expression in human endothelial cells[J ]. J Immunol, 2003, 171(3):1526-1533.
[10]Barilli A, Visigalli R, Sala R, et al. In human endothelial cells rapamycin causes mTORC2 inhibition and impairs cell viability and function[J]. Cardiovasc Res,2008,78(3): 563-571.
[11]Dormond O, Madsen JC, Briscoe DM. The effects of mTOR-Akt interactions on anti-apoptotic signaling in vascular endothelial cells[J]. J Biol Chem,2007,282(32):23679-23686.
[12]Ota H, Eto M, Ako J, et al. Sirolimus and everolimus induce endothelial cellular senescence via sirtuin 1 down-regulation[J]. J Am Coll Cardiol,2009,53(24):2298-2305.
[13]Nührenberg TG, Voisard R, Fahlisch F, et al. Rapamycin attenuates vascular wall inflammation and progenitor cell promoters after angioplasty[J]. FASEB J,2005,19(2):246-248.
[14]Nakao T, Shiota M, Tatemoto Y, et al. Pravastatin induces rat aortic endothelial cell proliferation and migration via activation of PI3K/Akt/mTOR/p70S6 kinase signaling[J]. J Pharm Sci, 2007,105(4): 334-341.
[15]Wiley SR, Schooley K, Smolak PJ, et al. Identification and characterization of new member of the TNF family that induces apoptosis[J ]. Immunity, 1995, 3(6):673-682.
Tumornecrosisfactor-relatedapoptosis-inducingligandparticipatesininjuryofvascularendothelialcellsinducedbyrapamycininvitro
YE Sheng, ZHANG Huai-qin, LIN Yi-nuo, HUANG Wei-jian, ZHANG Yan-li, SHAO Xiao-lin
(InstituteforCardiovascularBiologyandGene,DepartmentofCardiology,TheFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China.E-mail:zhanghuaiqin@126.com)
AIM: To investigate the effects of rapamycin on apoptosis, proliferation, migration ability and tumor related apoptosis inducing ligand(TRAIL) in cultured human umbilical vein endothelial cells(HUVECs).METHODSCultured HUVECs were treated with rapamycin at the concentrations of 0, 1, 10 and 100 μg/L for 24 h. The cell proliferation was measured by CCK-8 method. The cell migration ability was detected by Transwell chambers and wound healing test. The apoptotic index of HUVECs was quantitatively determined by measuring the activation of caspase-3. The morphological changes of the apoptotic cells were observed by DAPI staining. The expression of TRAIL was detected by Western blotting.RESULTSA 24 h-incubation with rapamycin(1-100 μg/L) caused significant cell loss associated with the increase in apoptosis, as quantified by the determination of caspase-3 activity(P<0.01) in HUVECs. Obvious apoptotic morphology was observed by DAPI staining in HUVECs incubated with rapamycin. Rapamycin at the concentrations of 1-100 μg/L also impaired the migration ability of HUVECs(P<0.01). In addition, rapamycin(10-100 μg/L) inhibited the proliferation of HUVECs, whereas rapamycin at 1 μg/L had no such effect(P<0.01). Rapamycin(10-100 μg/L) also induced TRAIL expression in a dose-dependent manner(P<0.01).CONCLUSIONRapamycin induces apoptosis, and inhibits the proliferation and migration of HUVECs. The up-regulation of TRAIL might be related to the injury of vascular endothelial cells caused by rapamycin.
Rapamycin; Endothelial cells; Apoptosis; Cell proliferation; Cell migration; Tumor necrosis factor-related apoptosis-inducing ligand
R363
A
10.3969/j.issn.1000-4718.2011.02-009
1000-4718(2011)02-0254-06
2010-08-21
2010-11-30
温州市科技局科技项目基金资助项目(No.H20080024;No.H20100009)
△通讯作者 Tel:0577-88717594;E-mail:zhanghuaiqin@126.com
——雷帕霉素

