自噬抑制剂3-甲基腺嘌呤在H2O2引起的神经胶质瘤U251细胞损伤中的作用*
孔晓霞, 张宏宇, 钟加滕, 康劲松, 孙连坤△
(1温州医学院机能实验教学中心,浙江 温州 325035; 2吉林大学白求恩医学院病理生理学系,吉林 长春 130021)
自噬抑制剂3-甲基腺嘌呤在H2O2引起的神经胶质瘤U251细胞损伤中的作用*
孔晓霞1, 张宏宇2, 钟加滕2, 康劲松2, 孙连坤2△
(1温州医学院机能实验教学中心,浙江 温州 325035;2吉林大学白求恩医学院病理生理学系,吉林 长春 130021)
目的探讨自噬抑制剂3-甲基腺嘌呤(3-MA)在H2O2诱导的神经胶质瘤U251细胞损伤过程中的作用。方法实验分为4组:正常对照组、10 mmol/L 3-MA组、1 mmol/L H2O2组、1 mmol/L H2O2+10 mmol/L 3-MA组。MTT法检测各组的U251细胞增殖率;MDC染色检测细胞自噬空泡的变化;Hoechst 33342染色检测细胞核染色质凝聚变化;流式细胞术检测细胞凋亡率。结果与对照组相比,单独应用3-MA对U251细胞无明显影响。H2O2作用组U251细胞增殖率明显降低,细胞内出现自噬空泡,细胞核染色质凝聚,细胞凋亡率增加。3-MA与H2O2联合作用于U251细胞时,与单独应用H2O2组相比,抑制了H2O2引起的胞内自噬空泡的积聚,但细胞凋亡率明显增加。结论自噬抑制剂3-MA能够一定程度地抑制H2O2诱导的U251细胞自噬,但促进了细胞凋亡,表明自噬在H2O2诱导的神经胶质瘤U251细胞损伤过程中很可能起到保护性作用。
自呑噬作用; U251细胞;3-甲基腺嘌呤; 过氧化氢
自噬(autophagy)是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程[1,2]。已有研究表明自噬在饥饿、氧化应激、缺氧等条件下对细胞具有一定程度的保护作用[3,4]。但是,过度激活的自噬会引起程序性细胞死亡,导致细胞生存率下降,这种细胞死亡方式被定义为II型细胞程序性死亡,即自噬性细胞死亡(autophagic cell death)[5,6]。本实验应用H2O2复制神经胶质瘤U251细胞损伤模型,并利用自噬抑制剂3-甲基腺嘌呤(3-methyladenine,3-MA)协同作用,初步探讨自噬在神经胶质瘤U251细胞氧化损伤中的作用。
材 料 和 方 法
1神经胶质瘤U251细胞培养
神经胶质瘤U251细胞株由吉林大学白求恩医学院病理生理学教研室保存,细胞置于完全培养基(10% Hyclone新生牛血清,IMDM培养液,pH 7.4)中,37℃、5% CO2培养箱中培养。
2实验分组
将U251细胞分为以下4组:正常对照组、3-MA组、H2O2组和H2O2+3-MA组。H2O2和3-MA(Sigma)的终浓度分别为1 mmol/L和10 mmol/L。
3噻唑蓝(MTT)法测定细胞生存率
取对数生长期U251细胞,经消化制成细胞悬液,以每孔100 μL、1×104细胞数接种于96板,12 h后按照实验分组加药,20 h后加入MTT(5 g/L)20 μL,继续培养4 h后吸出培养液,加入DMSO 150 μL,振荡10 min,570 nm测其吸光度值。
4MDC染色检测细胞自噬空泡变化
丹酰尸胺(monodansylcadaverine,MDC) 是自噬空泡的标志物,通过MDC染色可以观察判断细胞自噬过程的发生[7]。取对数生长期U251细胞,经消化制成细胞悬液,以5×104cells/well数接种于24孔板中,细胞贴壁后,按照实验分组在药物处理12 h后,PBS洗2遍,弃上清,以4%冰冷的多聚甲醛,4 ℃下固定15 min,PBS洗2遍,加入终浓度50 μmol/ L MDC (Sigma),37 ℃孵育60 min,PBS洗2遍。激光共聚焦显微镜观察细胞自噬空泡的变化并进行荧光定量分析。
5Hoechst33342染色检测细胞凋亡
取对数生长期U251细胞,经消化制成细胞悬液,以每孔5×104cells/well数接种于24孔板中,细胞贴壁后,按照实验分组在药物处理后12 h,PBS洗2遍,弃上清,加入终浓度1 mg/L的 Hoechst 33342 (Sigma)染色,37 ℃孵育15 min,PBS洗2遍,激光共聚焦显微镜观察细胞染色质凝集及形态变化并统计荧光染色阳性细胞百分比。
6流式细胞术检测细胞凋亡率
取对数生长期U251细胞,经消化制成细胞悬液,以5×106cells/well数接种于培养瓶中,细胞贴壁后,按照实验分组在药物处理后12 h,PBS洗2遍,收集细胞,弃上清,分别加入终浓度1 mg/L PI和Annexin V-FITC (Sigma),37 ℃孵育15 min,PBS洗2遍,流式细胞仪检测细胞凋亡率。
7统计学处理
结 果
13-MA和H2O2对U251细胞增殖率的影响
单独应用3-MA作用于U251细胞时,细胞增殖率未见明显变化。单独应用1 mmol/L H2O2作用24 h,细胞增殖率明显下降,为(76.4±3.9)%,Plt;0.01;当3-MA与H2O2联合作用时,细胞增殖率与单独应用H2O2组相比明显降低,为(63.7±5.2)%,Plt;0.05,见图1。

Figure 1. The vitality of U251 cells treated with H2O2 and /or 3-MA for 24 h .±s.n=3.**Plt;0.01 vs control group;#Plt;0.05 vs H2O2 group.
2MDC染色检测细胞自噬空泡变化
MDC染色结果表明单独应用3-MA作用于U251细胞时,细胞内无明显自噬空泡出现,荧光定量分析平均荧光强度为(86.2±23.4)%,与对照组平均荧光强度[(78.1±16.3)%]相比无明显差异。单独应用H2O2作用12 h,细胞内大量自噬空泡积聚,平均荧光强度为(219.6±59.8)%,Plt;0.01,表明有自噬发生;当3-MA与H2O2联合作用时,与单独应用H2O2组相比,自噬空泡明显减少,平均荧光强度为(108.5±37.2)%,Plt;0.01,见图2。
3Hoechst33342染色检测H2O2和3-MA对U251细胞凋亡的影响
单独应用3-MA作用于U251细胞时,细胞核形态未见明显变化,无明显细胞凋亡发生,Hoechst 33342染色阳性细胞百分比为(1.8±0.3)%。单独应用H2O2作用12 h,细胞核碎裂,染色质凝聚,引起细胞凋亡,阳性细胞百分比为(8.7±2.5)%,Plt;0.01;当3-MA与H2O2联合作用时,细胞凋亡与单独应用H2O2组相比显著增强,阳性细胞百分比为(14.5±3.8)%,Plt;0.01,见图3。
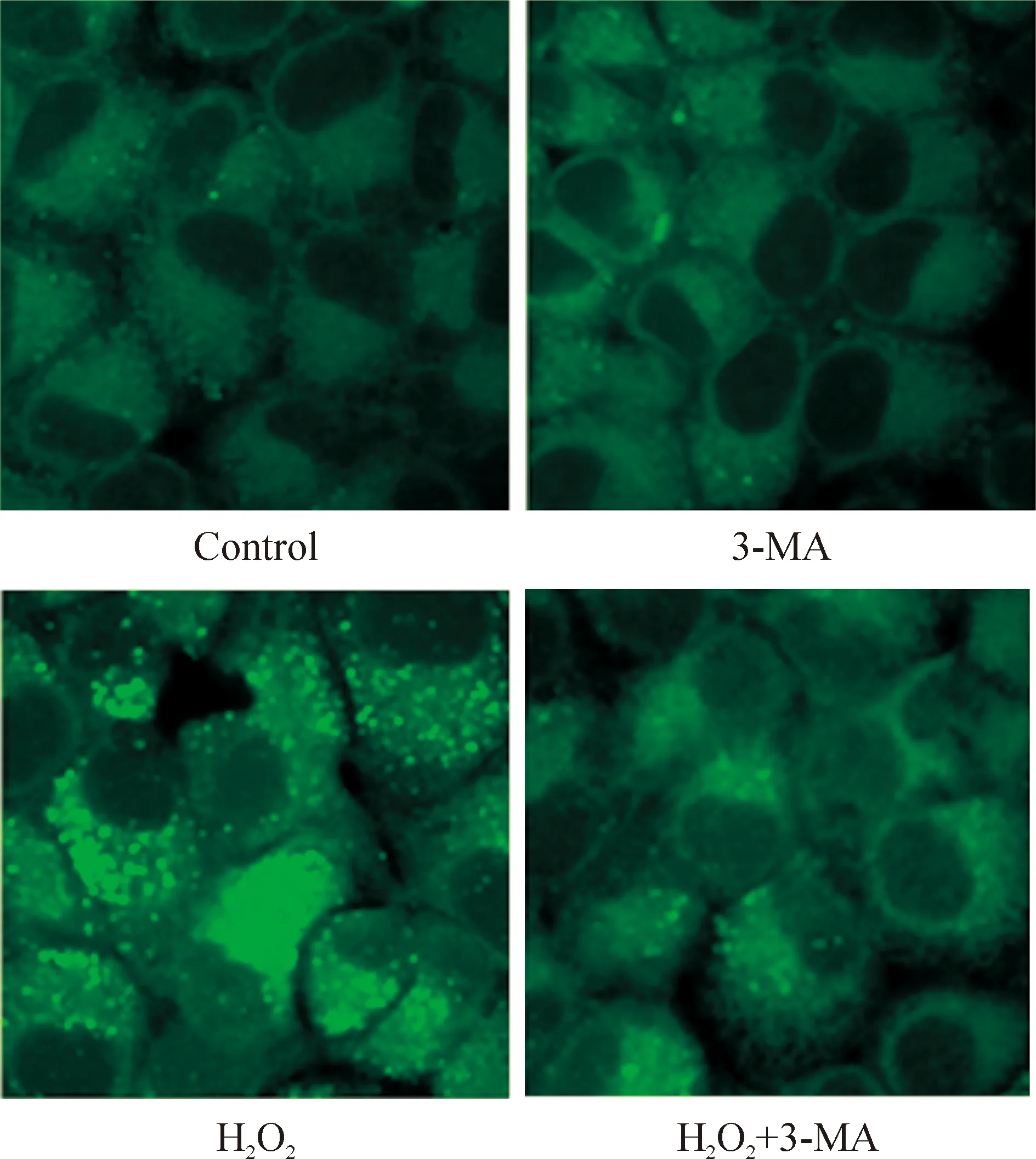
Figure 2. MDC staining of the autophagic vacuoles in U251 cells treated with H2O2 and/or 3-MA for 12 h (×800).
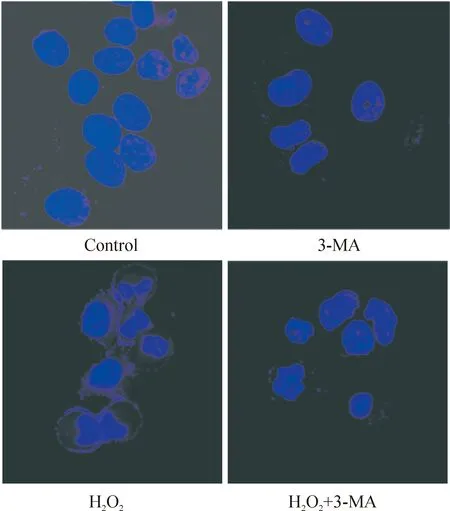
Figure 3. Hoechst 33342 staining of cell apoptotic chromatin condensation in U251 cells treated with H2O2 and/or 3-MA for 12 h (×600).
4流式细胞术检测细胞凋亡率
与正常对照组相比,单独应用3-MA作用于U251细胞时细胞凋亡率无明显变化。单独应用H2O2作用12 h,细胞凋亡率明显增加,为(9.6±1.5)%,Plt;0.01;当3-MA与H2O2联合作用时,与单独应用H2O2组相比,细胞凋亡率显著增加,为(15.4±3.1)%,Plt;0.01,见图4。
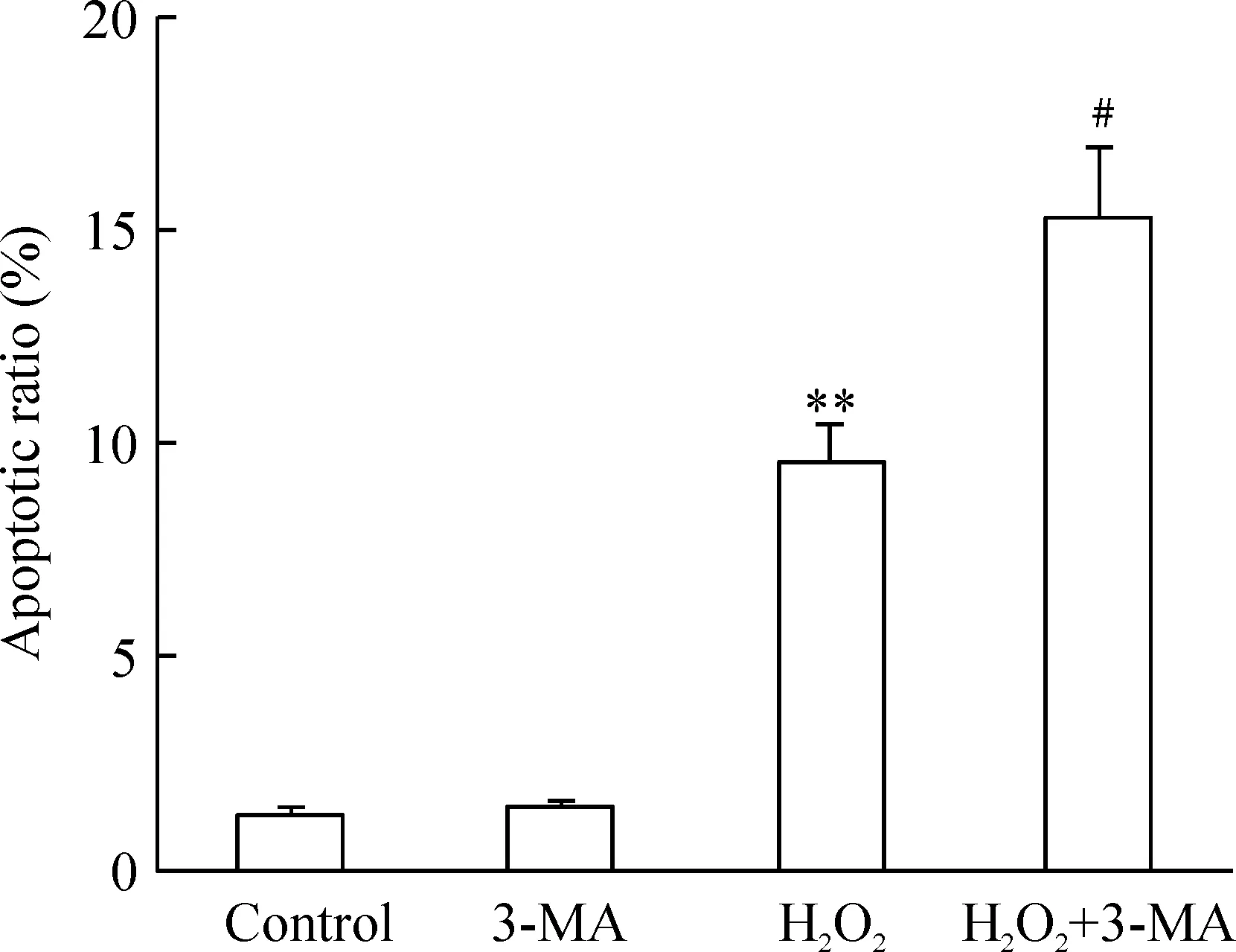
Figure 4. Flow cytometry analysis of cell apoptotic ratio of U251 cells treated with H2O2 and/or 3-MA for 12 h. **Plt;0.01 vs control group;#Plt;0.05 vs H2O2 group.
讨 论
有研究表明相同诱导因素在不同细胞中可分别诱发自噬或凋亡;近年来越来越多的研究提示二者在某些情况下可以相互拮抗或促进,可先后发生或同时共存于同一细胞,参与自噬和凋亡的分子也可能存在交叉,这些分子在自噬与凋亡两种程序性细胞死亡中可发挥正向或负向作用[8]。近来有报道表明活性氧簇(reactive oxygen species,ROS)是自噬发生过程中的信号分子,高水平的ROS能氧化细胞脂质,DNA和蛋白,并且能引起线粒体,溶酶体和其它的细胞器功能紊乱。然而通过自噬降解和再循环受损的细胞蛋白等不同的防御机制能抵抗这种氧化应激[9]。然而,自噬在细胞中的作用以及自噬与凋亡之间的关系依然存在着争议,相关机制还需进一步阐明。
本实验结果表明,H2O2作用于U251细胞,引起了U251细胞发生自噬和凋亡,提示氧化损伤过程中两种程序性细胞死亡形式同时存在并可能相互影响。MTT实验结果显示,H2O2作用于U251细胞时,能明显抑制U251细胞增殖(Plt;0.01);而自噬抑制剂3-MA与H2O2联合应用时,细胞增殖率却没有改善,反而有进一步下降,推测自噬在此过程中可能起到保护作用。激光共聚焦显微镜观察Hoechst 33342染色,H2O2作用12 h后,细胞核发生回缩,染色质凝集,表明H2O2能引起U251细胞凋亡。同时通过MDC染色发现,H2O2作用后细胞内有大量自噬空泡积聚,而3-MA与H2O2联合应用时,明显抑制了自噬的发生。3-MA与H2O2联合应用时,细胞核凋亡显著增强,流式细胞术分析结果表明3-MA的联合应用导致细胞凋亡率显著增加。上述结果表明,自噬抑制剂3-MA能够抑制H2O2引起的细胞自噬,却促进了细胞凋亡,暗示自噬在U251细胞氧化损伤过程中很可能起到了一种保护作用。有研究表明营养物质或生长因子缺乏时,机体可以通过自噬方式为细胞提供能量,促进细胞存活。Scherz-Shouval等[10]的研究表明,ROS能够调节营养匮乏引起的自噬,并且是一种明确的促生存机制;营养匮乏能够导致部分经由ClassIII/PI3K途径的线粒体活性氧积聚,激活自噬基因Atg4,这很可能是ROS诱导自噬发生的关键。通过化学或者生理学手段抑制自噬,能够启动HeLa细胞中线粒体外膜透化以及进一步的caspase活化,导致细胞凋亡[11]。我们推测,在自噬和凋亡并行发生的情况下,自噬更趋向于是一种通过降解以及再循环来提供能量的促生存机制。
以上结果表明,自噬抑制剂3-MA抑制了H2O2引起的细胞自噬,却促进了细胞凋亡,说明自噬的发生能够在一定的程度上减轻氧化应激引起的细胞损伤,对细胞起到一定的保护作用。进一步研究自噬与凋亡的关系,通过抑制细胞自噬促进凋亡性细胞死亡,很可能成为肿瘤治疗中的一种新策略。
[1] Sato K, Tsuchihara K, Fujii S, et al. Autophagy is activated in colorectal cancer cells and contributes to the tolerance to nutrient deprivation [J]. Cancer Res, 2007, 67(20):9677-9684.
[2] 曹丽丽,董 艳,徐婧婧,等.Wortmannin通过抑制癫痫大鼠海马自噬活性发挥神经保护作用[M].中国病理生理杂志,2010,26(8):1584-1588.
[3] Abedin MJ, Wang D, McDonnell MA, et al. Autophagy delays apoptotic death in breast cancer cells following DNA damage [J]. Cell Death Differ, 2007, 14(3):500-510.
[4] Degenhardt K, Mathew R, Beaudoin B, et al. Autophagy promotes tumor cell survival and restricts necrosis, inflammation and tumorigenesis [J]. Cancer Cell, 2006, 10(1):51-64.
[5] Boland B, Nixon RA. Neuronal macroautophagy: from development to degeneration [J]. Mol Aspects Med,2006, 27(5-6):503-519.
[6] Yu L, Alva A, Su H, et al. Regulation of anATG7-beclin1 program of autophagic cell death by caspase-8 [J]. Science, 2004, 304(5676):1500-1502.
[7] Munafó DB, Colombo MI. A novel assay to study autophagy: regulation of autophagosome vacuole size by amino acid deprivation [J]. J Cell Sci, 2001, 114(Pt 20):3619-3629.
[8] Lockshin RA, Zakeri Z. Apoptosis, autophagy, and more [J]. Int J Biochem Cell Biol, 2004, 36(12): 2405-2419.
[9] Moore MN. Autophagy as a second level protective process in conferring resistance to environmentally-induced oxidative stress [J]. Autophagy, 2008, 4(2):254-256.
[10]Scherz-Shouval R, Shvets E, Fass E, et al. Reactive oxygen species are essential for autophagy and specifically regulate the activity of Atg4 [J]. EMBO J, 2007, 26(7): 1749-1760.
[11]Boya P, Gonzalez-Polo RA, Casares N, et al. Inhibition of macroautophagy triggers apoptosis [J]. Mol Cell Biol, 2005, 25(3): 1025-1040.
Roleofautophagyinhibitor3-methyladenineintheinjuryofU251cellsinducedbyH2O2
KONG Xiao-xia1, ZHANG Hong-yu2, ZHONG Jia-teng2, KANG Jin-song2, SUN Lian-kun2
(1TeachingCenterofFunctionalExperiment,WenzhouMedicalSchool,Wenzhou325035,China;2DepartmentofPathophysiology,NormanBethuneSchoolofMedicalSciences,JilinUniversity,Changchun130021,China.E-mail:sunlk@jlu.edu.cn)
AIM: To investigate the role of autophagy inhibitor 3-methyladenine(3-MA) in the injury of U251 glioma cells induced by H2O2.METHODSThe following groups in this study were set up: control group, 10 mmol/L 3-MA group, 1 mmol/L H2O2group and 1 mmol/L H2O2+10 mmol/L 3-MA group. The viability of U251 cells in each group was detected by MTT assay. Autophagic vacuoles in the cells were observed by staining with MDC. The cells were stained with Hoechst 33342 to determine the chromatin condensation. Cell apoptotic ratio was measured by flow cytometry analysis.RESULTSCompared with control group, no effect of 3-MA on the viability of U251 cells was observed. In H2O2group, the cell viability decreased and cell apoptotic ratio increased.The autophagic vacuoles and nuclear chromatin condensation in the cells were also detected. Compared with H2O2group, addition of 3-MA inhibited the increase in autophagic vacuoles but exacerbated the apoptosis.CONCLUSIONAutophagy inhibitor 3-MA inhibits autophagy partially, but exacerbates apoptosis in U251 cells, indicating that autophagy exerts protective effect in the process of injury in U251 cells induced by H2O2.
Autophagocytosis; U251 cells; 3-methyladenine; Hydrogen peroxide
1000-4718(2011)04-0695-04
R730.23
A
10.3969/j.issn.1000-4718.2011.04.014
2010-10-19
2011-02-16
吉林省科技厅资助项目(No.200705373);温州医学院科研启动基金资助项目(No.QTJ09014)
△通讯作者Tel: 0431 - 85619485; E - mail: sunlk@jlu.edu.cn

