蟾蜍灵激活低分化鼻咽癌细胞氯通道*
罗海兵, 李华荣, 刘善文, 彭 爽, 刘振锋, 叶文才, 张冬梅, 陈丽新△, 王立伟△
(1广东医学院生理学教研室,广东 湛江 524023;暨南大学2医学院, 3药学院,广东 广州 510632)
蟾蜍灵激活低分化鼻咽癌细胞氯通道*
罗海兵1, 李华荣2, 刘善文2, 彭 爽2, 刘振锋2, 叶文才3, 张冬梅3, 陈丽新2△, 王立伟2△
(1广东医学院生理学教研室,广东 湛江 524023;暨南大学2医学院,3药学院,广东 广州 510632)
目的研究蟾蜍灵(bufalin)对低分化鼻咽癌(CNE - 2Z)细胞氯通道的激活作用以及通道的特性。方法采用全细胞膜片钳技术记录蟾蜍灵激活CNE - 2Z细胞膜电流并分析其电流特征。结果细胞外灌流1 μmol/L 的蟾蜍灵可诱发CNE - 2Z细胞产生一个氯电流,该电流潜伏期较长,为(12.1 ± 6.4)min, 其翻转电位接近氯离子平衡电位。该电流具有较明显的外向优势,没有明显的时间依赖性失活和电压依赖性失活。氯通道阻断剂他莫昔芬(tamoxifen)可完全抑制该电流, 细胞外灌流高渗液也可完全抑制该电流。结论蟾蜍灵可以激活CNE - 2Z细胞氯通道产生氯电流,与容积激活性氯电流相比,该电流的潜伏期较长,并且有更明显的外向优势。
蟾蜍灵; 鼻咽肿瘤; 氯通道
蟾蜍灵(bufalin)是中药蟾酥的有效成分之一,主要从中华大蟾蜍的皮肤和耳后腺提取和分离。研究结果表明, 蟾蜍灵结构与洋地黄极其相似,具有抑制细胞膜上Na+-K+-ATP酶活性,使胞内Ca2+浓度升高,具有升压、强心等作用。近年研究发现,蟾蜍灵能够抑制肿瘤细胞增殖、阻滞细胞周期[1]及诱导细胞凋亡[2]。
我们前文报道,容积激活性氯通道在细胞增殖、细胞周期及凋亡等生命活动中起重要作用,氯通道阻断剂能抑制细胞增殖,阻滞细胞周期及阻抑抗肿瘤药顺铂诱导的细胞凋亡[3-5]。目前,关于蟾蜍灵对细胞膜离子通道作用方面的相关报道甚少。本实验拟在前期研究的基础上,用全细胞膜片钳方法记录蟾蜍灵对低分化鼻咽癌细胞(CNE - 2Z)的氯电流,并分析该电流的特征,为从离子通道的角度了解蟾蜍灵抑制肿瘤细胞增殖、阻滞细胞周期及诱导细胞凋亡的机制提供新的实验依据。
材 料 和 方 法
1细胞培养
低分化鼻咽癌上皮细胞(CNE - 2Z)用含10 % 小牛血清、1×105U /L 青霉素和100 mg/L 链霉素的RPMI- 1640生长液常规培养在细胞培养瓶内,置于37 ℃、饱和湿度、5 % CO2培养箱中。隔天传代,操作在培养室超净工作台内进行。
2灌流液
等渗灌流液(isotonic solution,Iso)渗透压为300 mOsmol/L,含(mmol/L) : 70 NaCl,0.5 MgCl2,2 CaCl2, 10N-2-hydroxyethylpiperazine-N’-2-ethanesulfonic acid (HEPES)和140 D- mannitol。47%高渗灌流液(hypertonic solution,Hyper)渗透压为440 mOsmol/L,除溶液中D - mannitol为280 mmol/L 外, 其余成份和等渗液相同。灌流液用三羟甲基氨基甲烷(Tris base)缓冲液调pH值至7.4,用冰点渗透压计(osmomat030,Gonotec) 检测渗透压。
3试剂
蟾蜍灵由暨南大学药学院提供,用二甲基亚砜(dimethyl sulphoxide,DMSO)配制成20 mmol/L 储存液,在- 4 ℃ 保存。他莫昔芬购自Sigma,实验前用甲醇将他莫昔芬配制成50 mmol/L 原液,在临用前用灌流液将蟾蜍灵和他莫昔芬分别稀释至1 μmol/L 和20 μmol/L。
4膜片钳实验
4.1电极内液 电极内液含(mmol/L): 70 N -methyl - D - glucamine chloride (NMDG - Cl),1.2 MgCl2,10 HEPES,1 ethylene glycol bis(2-aminoethyl) tetraacetic acid (EGTA),140 D - mannitol 和2 adenosine - triphosphate (ATP)。用Tris base缓冲液调pH至7.25,用D - mannitol 调渗透压至300 mOsmol/L,过滤除菌后分装,于- 20 ℃ 保存, ATP在实验前加入。
4.2全细胞膜片钳记录 CNE-2Z细胞按常规用0.25 %胰酶消化后,将吹打成的单细胞混悬液接种在22 mm 小玻片上,置37 ℃、5 % CO2培养箱中培养1 h 后,取出玻片置于特制圆形灌流槽中做全细胞膜片钳实验。用EPC - 7膜片钳放大器(List Electronic)记录单个的CNE-2Z细胞全细胞电流。记录电极使用硼硅酸盐毛细玻璃管,在微电极拉制器( PB-7)上分2步拉制成微电极,充注电极内液后的微电极尖端电阻约5-10 MΩ。电流和电压信号用CED 1401(Cambridge)数字化(采样频率3 kHz) ,实验数据用EPC (CED, Cambridge)软件分析。根据细胞膜电容和全细胞电流大小,求出标准化后的全细胞电流密度(pA/pF)。钳制电压模式:细胞被钳制在氯平衡电位,由EPC软件包产生指令,以0 mV、±40 mV和±80 mV顺序循环往复,每一电位持续200 ms,两电位之间间隔4 s。所有实验在室温下(20 ℃- 24 ℃)进行。
4.3蟾蜍灵激活氯电流 将细胞玻片安放在灌流槽中,全细胞记录形成并测定细胞电容之后,先继续用等渗灌流液灌流2-3 min,记录稳定的基础电流,然后加入含1 μmol/L 蟾蜍灵的等渗灌流液以激活电流,并记录激活电流的潜伏期(基础电流强度值从开始灌流蟾蜍灵到增大1倍所需的时间)。
4.4氯通道阻断剂抑制氯电流 待蟾蜍灵激活细胞膜电流达到峰值并平稳2 min 后,再加20 μmol/L他莫昔芬,待氯电流被抑制达到最小值并平稳2 min 后,分析和计算氯通道阻断剂他莫昔芬对蟾蜍灵激活的氯电流抑制效应。
4.5蟾蜍灵激活氯电流的容积敏感性 当蟾蜍灵激活细胞电流达到峰值并稳定2 min 后,换为含1 μmol/L 蟾蜍灵的47 %高渗灌流液,观察细胞容积缩小对蟾蜍灵激活氯电流的影响。
5统计学处理
结 果
1蟾蜍灵缓慢激活CNE-2Z细胞电流
当CNE-2Z细胞浸浴在等渗灌流液中时,细胞膜基础电流强度很小而且平稳。细胞平均电流密度在+ 80 mV 电压钳制下为(5.11 ± 0.81) pA/pF,在- 80 mV电压钳制下为(-5.43 ± 0.83) pA/pF(n=8)。
在等渗灌流液中加入1 μmol/L 蟾蜍灵后,可缓慢激活细胞膜离子通道,产生一电流,见图1,不同细胞电流激活的潜伏期长短不一,差别较大,一般在5 min-15 min范围内,潜伏期均值为(12.1 ± 6.4)min(n=8)。
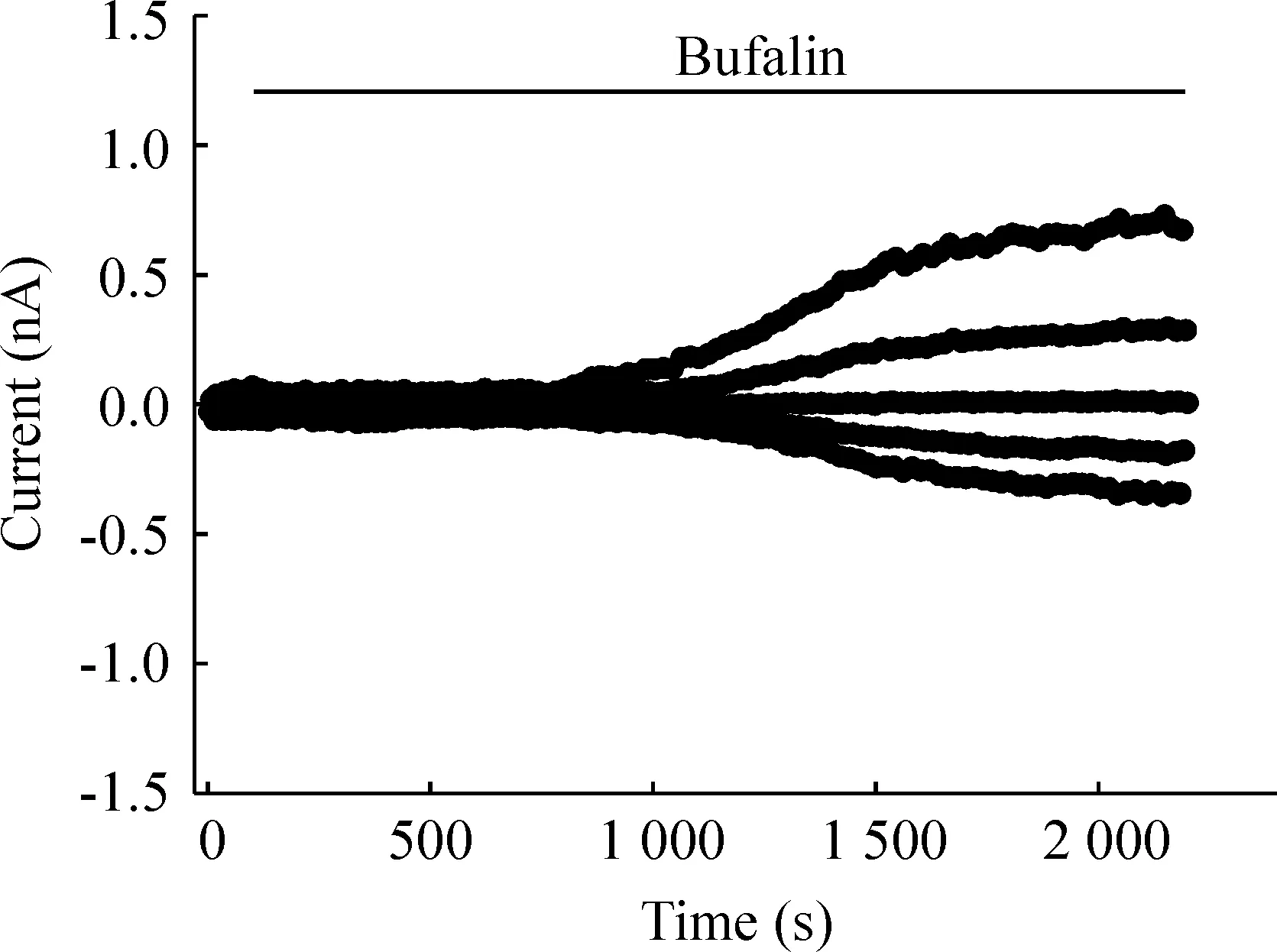
Figure 1. The time course of bufalin-activated chloride currents in CNE-2Z cells.Membrane potentials were repeatedly clamped at 0,±40 and±80 mV.
2蟾蜍灵激活电流的特征
如图2 所示,蟾蜍灵激活的电流表现为外向优势,无明显时间依赖性和电压依赖性失活。当电流缓慢增加至峰值并稳定时,其外向电流密度在+80 mV电压钳制下为(42.06 ± 5.88) pA/pF,内向电流在-80 mV 电压钳制下为(22.77 ± 2.73) pA/pF,见图3,外向电流比内向电流大80 %左右,内外向电流密度差异显著(Plt;0.01)。
因为灌流液和电极内液中均不含有K+,而Na+和Ca2+在实验条件下的平衡电位超过+ 200 mV,而蟾蜍灵激活电流的翻转电位为(- 7.98 ± 1.43)mV,见图3,接近本实验条件Cl-平衡电位的理论值(- 0.9 mV),且在不同钳制电压下的电流方向与Cl-运动的方向一致,因此提示蟾蜍灵诱导CNE-2Z细胞的电流是氯电流。
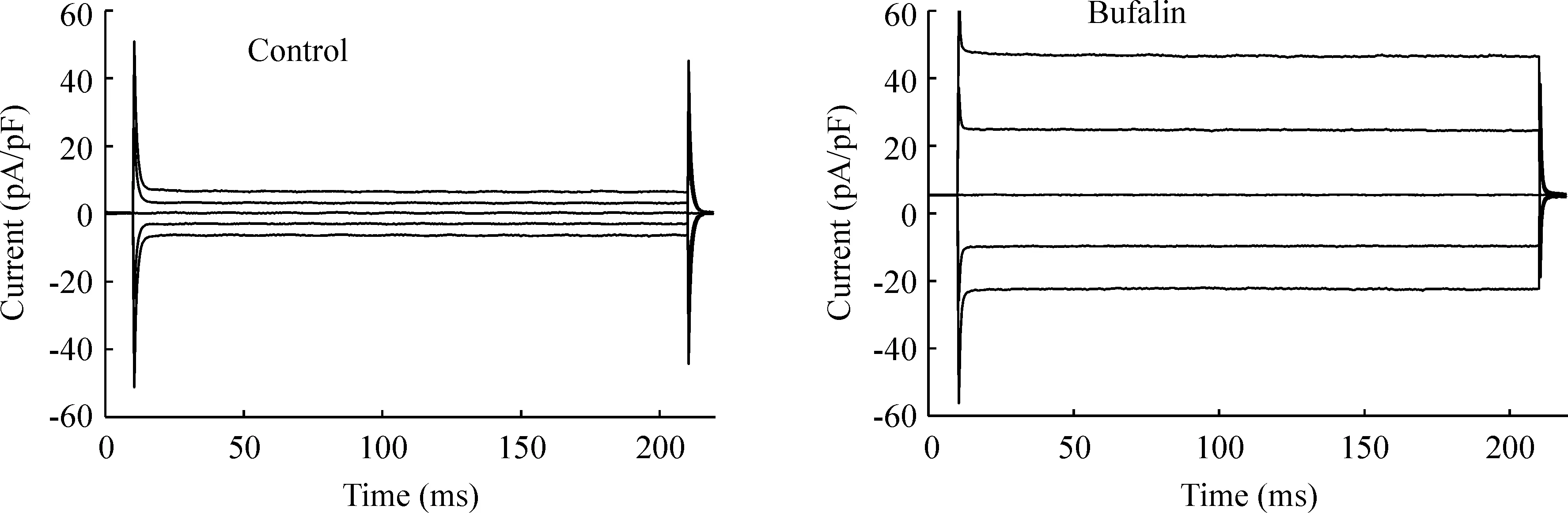
Figure 2. The typical current traces induced by bufalin in CNE-2Z cells.Membrane potentials were repeatedly clamped at 0,±40 and±80 mV.
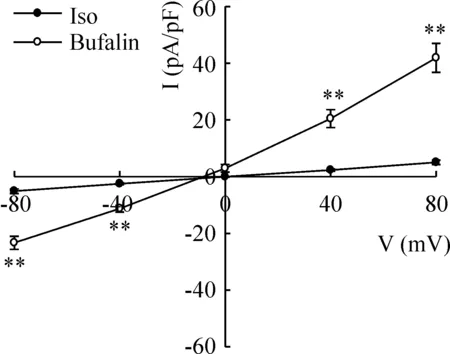
Figure 3. The current - voltage ( I - V) relationship of the bufalin - activated current in CNE-2Z cells. ±sE.n=8.**Plt;0.01 vs Iso. Iso: isotonic solution.
3他莫昔芬对蟾蜍灵激活氯电流的抑制作用
他莫昔芬是常用的氯离子通道阻断剂,可完全抑制47 %低渗灌流液诱导的CNE-2Z 细胞产生容积激活性氯电流。本实验观察了细胞外灌流20 μmol/L他莫昔芬对蟾蜍灵激活的氯电流作用,图4A显示了他莫昔芬作用于同一细胞前后的电流全过程。结果表明, 20 μmol/L 他莫昔芬可迅速而完全地抑制蟾蜍灵激活的氯电流(Plt;0.01),在他莫昔芬的作用下,蟾蜍灵激活的外向细胞电流密度峰值从(42.06 ± 5.88) pA/pF迅速减少至(2.58 ± 0.98) pA/pF(+80 mV),内向电流密度峰值从(-22.77 ± 2.73) pA/pF快速下降至 (-2.52 ± 0.34) pA/pF(-80 mV),见图4B。本结果进一步证实蟾蜍灵激活的电流是一个氯通道介导的氯电流。
4蟾蜍灵激活氯电流的容积敏感性
当等渗灌流液加入1 μmol/L 蟾蜍灵后, 细胞膜氯通道开放,氯电流增大,见图5A。而当膜电流增加至峰值并稳定后, 再换为含蟾蜍灵的47 %高渗灌流液, 细胞发生皱缩,细胞容积缩小,可见电流显著减小,见图5B,表明蟾蜍灵诱导的Cl-电流对细胞容积变化敏感。
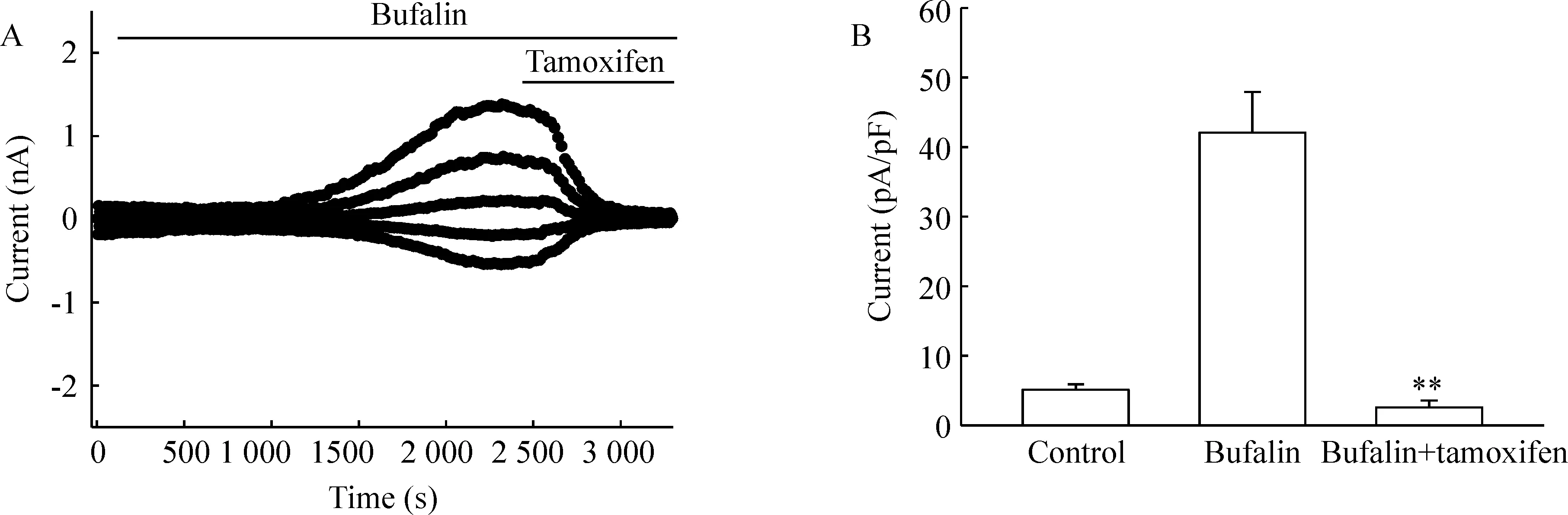
Figure 4. Inhibition of bufalin-activated Cl- currents by the chloride channel blocker tamoxifen in CNE - 2Z cells.A: the time course of inhibition of bufalin-activated chloride currents by tamoxifen; B:the mean currents recorded before (control) and after treatment with bufalin alone or with bufalin plus tamoxifen±sE.n= 8.**P lt; 0.01 vs bufalin.
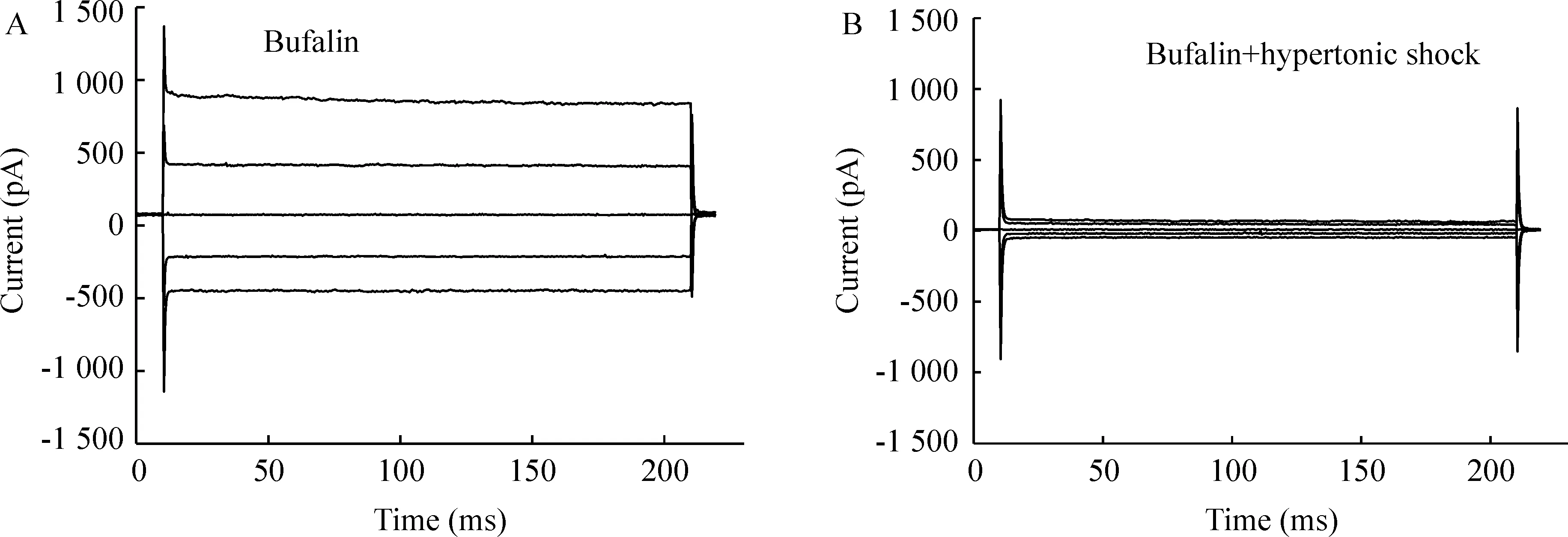
Figure 5. Inhibition of bufalin-activated Cl- currents by the cell shrinkage induced by extracellular hypertonic shocks.A: current traces recorded in the isotonic solution containing bufalin; B: current traces recorded in 47 % hypertonic solution containing bufalin.
讨 论
蟾蜍灵是从动物蟾蜍的皮肤和耳后腺提取和分离、被认为具有地高辛样免疫活性的成分,也是目前临床用于治疗肝癌、胰腺癌等肿瘤的药物华蟾素注射液的有效成分之一。蟾蜍灵能够抑制细胞膜上Na+-K+-ATP酶,使细胞内Na+浓度升高,进而促发Na+-Ca2+交换,增加细胞内Ca2+浓度。而Ca2+作为细胞内第二信使,其浓度升高后可通过进一步激活蛋白激酶或离子通道等方式,产生以靶蛋白构象变化为基础的级联反应和细胞功能改变。目前多数文献认为蟾蜍灵抑制肿瘤细胞增殖主要与诱导细胞分化[6]、阻滞细胞周期及诱导肿瘤细胞凋亡[1,7]有关,但其作用机制尚未完全清楚。
我们前期的研究表明,容积激活性氯通道是在细胞外低渗或细胞内高渗而导致细胞肿胀时被激活,氯离子外流,伴随水的外流,这是细胞调节性容积回缩的主要机制之一[8]。在等渗状态下,容积激活性氯离子通道和细胞容积改变参与调节细胞增殖、细胞周期及细胞凋亡等生命活动。例如在细胞周期进程中,细胞容积是逐渐增大的,容积改变将影响胞内包括参与DNA合成的各种酶等大分子有机物浓度,尤其是在G1/S期转换点。而细胞可通过不同周期的调节性容积回缩能力改变来调节和维持细胞容积平衡[3],参与细胞周期进程调节。使用氯通道阻断剂他莫昔芬、三磷酸腺苷和5-硝基-2-(3-苯丙胺基)苯甲酸[5-nitro-2-(3-phenylpro-pylamino) benzoic acid,NPPB]可以抑制鼻咽癌细胞增殖,阻滞细胞周期,并抑制由顺铂诱导的细胞凋亡[5]。蟾蜍灵能抑制肿瘤细胞增殖、阻滞细胞周期及诱导细胞凋亡,但氯通道是否为蟾蜍灵作用的靶点,目前尚未清楚。
本研究用全细胞膜片钳的方法,直接观察在等渗状态下蟾蜍灵对CNE-2Z细胞氯离子通道的作用。实验结果表明,细胞外灌流蟾蜍灵可以缓慢激活1个氯电流,该电流在不同钳制电压下其电流方向和Cl-运动方向一致,其翻转电位接近Cl-的平衡电位,该电流可被氯通道阻断剂他莫昔芬完全抑制,细胞外高渗导致细胞皱缩可使该通道关闭,Cl-外流显著减少。本实验结果表明蟾蜍灵激活的是氯通道介导的氯电流,该电流的部分特征与我们前文报道的容积激活性氯电流相似[9],如具有外向优势及无明显时间依赖性失活和电压依赖性失活,对细胞容积缩小敏感等。但与细胞外低渗激活的容积激活性氯电流相比,蟾蜍灵激活氯电流的潜伏期更长,外向优势更明显,外向电流比内向电流增大约80%。CNE-2Z细胞容积激活性氯电流的潜伏期为1 min-2 min, 不同细胞的潜伏期差别较小[9],而蟾蜍灵激活氯电流的潜伏期长达10多分钟,且不同细胞的潜伏期差别较大。
虽然蟾蜍灵激活的氯电流和容积激活性氯电流部分特征相似,但两者激活的条件不同,容积激活性氯电流是在低渗环境中被激活,而蟾蜍灵激活的氯电流却是在等渗环境中产生,而且产生电流的潜伏期较长,这提示蟾蜍灵激活氯通道和低渗激活氯通道的类型和途径可能不完全相同。Na+-K+-ATP酶对维持细胞渗透压和细胞容积稳定有重要作用[10],蟾蜍灵能抑制其活性,使胞内Na+浓度升高,同时,由于胞内膜电位负值减少,胞外Cl-内流,使胞内Cl-浓度增加。胞内Na+、Cl-浓度增加,可使胞浆渗透压升高,这可能会引起细胞容积增大从而激活容积激活性氯通道。此外,蟾蜍灵也可能会在细胞容积不变的等渗状态下,通过某些途径直接激活氯通道。蟾蜍灵激活的氯离子通道的分子本质,有待进一步的探讨。
[1] 张 宁,汪 晨,顾 伟,等. 蟾毒灵对人肝癌细胞HepG2细胞周期的影响及其机制研究[J]. 现代肿瘤医学,2010,18(3): 439-442.
[2] 田 昕,罗 颖,刘云鹏,等. 蟾蜍灵诱导HL-60细胞凋亡过程中对Bcl-2、Survivin、Smac /DIABLO表达的影响[J]. 中华血液学杂志, 2006, 27 (1) : 21 - 24.
[3] Wang L, Chen L, Zhu L, et al. Regulatory volume decrease is actively modulated during the cell cycle [J]. J Cell Physiol, 2002, 193 (1) : 110 - 119.
[4] Chen L, Zhu L, Jacob TJ, et al. Roles of volume-activated Cl-currents and regulatory volume decrease in the cell cycle and proliferation in nasopharyngeal carcinoma cells [J]. Cell Prolif, 2007, 40 (2): 253 - 267.
[5] 范爱辉,陈丽新,毛建文,等. 阻断氯通道对鼻咽癌细胞凋亡和细胞增殖的影响[J]. 广东医学, 2006, 27(12) : 1804 - 1806.
[6] Jing Y, Watabe M, Hashimoto S, et al. Cell cycle arrest and protein kinase modulating effect of bufalin on human leukemia ML1 cells [J]. Anticancer Res, 1994, 14 (3A) :1193 - 1198.
[7] Masuda Y, Kawazoe N, Nakajo S, et al. Bufalin induces apoptosis and influences the expression of apoptosis - related genes in human leukemia cells[J]. Leuk Res, 1995, 19 (8) : 549 - 556.
[8] 王立伟, 陈丽新, 朱林燕, 等. Cl-在鼻咽癌细胞调节性容积回缩中的作用[J]. 中国病理生理杂志, 2002,18 (5) : 490 - 493.
[9] Chen L, Wang L, Zhu L, et al. Cell cycle-dependent expression of volume-activated chloride currents in nasopharyngeal carcinoma cells [J]. Am J Physiol Cell Physiol, 2002, 283(4):C1313-C1323.
[10]吴博威. 细胞的基本功能[A]. 见:朱大年 主编.生理学[M].第7版.北京:人民卫生出版社,2008.13-14.
Bufalinactivateschloridechannelsinpoorlydifferentiatednasopharyngealcarcinomacells
LUO Hai-bing1, LI Hua-rong2, LIU Shan-wen2, PENG Shuang2, LIU Zhen- feng2, YE Wen-cai3, ZHANG Dong-mei3, CHEN Li-xin2, WANG Li-wei2
(1DepartmentofPhysiology,GuangdongMedicalCollege,Zhanjiang524023,China;2SchoolofMedicine,3CollegeofPharmacy,JinanUniversity,Guangzhou510632,China.E-mail:wangliweic@sohu.com;chenlixinw@sohu.com)
AIM: To investigate the activation of chloride channels induced by bufalin and the properties of the channels in poorly differentiated nasopharyngeal carcinoma (CNE-2Z) cells.METHODSThe technique of whole-cell patch clamp was used to record the chloride currents and to analyze the characteristics of the currents in CNE-2Z cells.RESULTSA chloride current was slowly activated by extracellular application of bufalin (1 μmol/L). The activation of the current was slower than that of the volume-activated chloride current, with an activation latency of(12.1±6.4) min. The reversal potential of the current was close to the calculated Cl-equilibrium potential (ECl= - 0.9 mV). The chloride current was outward-rectified and did not show significant time-dependent or voltage-dependent inactivation. The chloride channel blocker tamoxifen completely inhibited the outward and inward currents. The current was also completely inhibited by extra-cellular application of 47% hypertonic solution.CONCLUSIONBufalin activates chloride channels and induces a chloride current in CNE-2Z cells. Compared with the volume-activated chloride current in CNE-2Z cells, the activation latency of the bufalin-induced current is longer and the outward rectification is more obvious.
Bufalin; Nasopharyngeal neoplasms; Chloride channels
1000-4718(2011)04-0672-05
R739.63
A
10.3969/j.issn.1000-4718.2011.04.010
2010-12-30
2011-02-24
国家自然科学基金资助项目 (No.30771106; No.30870567; No. 30871267; No.90913020; No.U0932004);广东省自然科学基金资助项目(No. 07005974);广东医学院青年基金资助项目(No.XQ06013)。
△通讯作者 王立伟 Tel: 020-85220260;E-mail: wangliweic@sohu.com; 陈丽新 Tel: 020-85228865;E-mail: chenlixinw@sohu.com

