FAK-shRNA重组逆转录病毒载体的构建及稳定表达细胞株的筛选*
阿力亚, 林 武, 何 强
(中山大学附属第一医院肝胆外科, 广东 广州 510080)
FAK-shRNA重组逆转录病毒载体的构建及稳定表达细胞株的筛选*
阿力亚, 林 武, 何 强△
(中山大学附属第一医院肝胆外科, 广东 广州 510080)
目的研究利用RNA干扰技术,以黏附斑激酶(FAK)为靶基因,构建FAK-shRNA重组逆转录病毒载体,将其导入包装细胞Phoenix中,筛选出稳定产生FAK-shRNA病毒的细胞克隆,以病毒上清感染并筛选FAK表达沉默的细胞株,观察其对相关蛋白表达的影响。方法体外合成能转录产生靶向FAK短发夹RNA(shRNA)的寡核苷酸并定向克隆入pSuper.retro逆转录病毒载体,以脂质体法转染Phoenix细胞株,待筛选稳定克隆成功后收获病毒上清,感染人肝癌细胞株HCC-LM3,以嘌呤霉素筛选得到抑制FAK表达的稳定细胞株后用Western boltting鉴定FAK表达的抑制效果及相关蛋白表达情况。结果构建了重组逆转录病毒载体pSuper-FAK并抑制了人肝癌HCC-LM3细胞内FAK蛋白的表达。在下调FAK表达的细胞株中p-Akt和p-MAPK1/2表达明显受到抑制。下调FAK的细胞株迁移和侵袭能力下降,细胞周期多被阻止在G0/G1期,细胞凋亡增多,增殖率明显下降。结论重组逆转录病毒载体pSuper-FAK转染包装细胞Phoenix后,其产生的FAK-shRNA病毒可以抑制HCC-LM3细胞内的FAK蛋白表达并抑制Akt及MAPK1/2磷酸化。下调FAK后可以对肿瘤细胞的生物学行为产生明显影响。
黏着斑激酶; RNA干扰; 逆转录病毒载体; 肝肿瘤
黏着斑激酶(focal adhesion kinase,FAK)是一种非受体酪氨酸激酶,它在细胞间及细胞与细胞外基质黏附中起关键作用。研究证明,FAK在乳腺癌、宫颈癌、直肠癌、甲状腺癌、前列腺癌、喉癌、舌癌和肺癌中表达量增高,高表达FAK通常与差的病理分型和预后相联系,并且已经在一些实体肿瘤如乳腺癌中探索了其活化机制以及其通过下游信号转导通路参与细胞周期调控、黏附、侵袭、转移等的作用方式。但是对于肝癌中FAK介导肿瘤细胞生物学活性的相关研究甚少,目前尚不清楚FAK在肝癌细胞侵袭、转移、增殖、生存、凋亡过程中所处地位。本实验以肝癌细胞株为研究对象,构建质粒转染并筛选出稳定低表达FAK的细胞株,为后续研究打下研究基础。
材 料 和 方 法
1材料
1.1主要试剂 逆转录病毒载体pSuper.retro由广东省人民医院病理生理研究部惠赠,限制性内切酶BamHⅠ、HindⅢ、T4 DNA连接酶购自TaKaRa;大肠杆菌菌株E.coliDH5α由广东省人民医院病理生理研究部惠赠;脂质体Lipofectamine2000购自Invitrogen;质粒提取试剂盒购自Tiangen;质粒纯化试剂盒购自Qiagen;上、下游引物由上海博尚生物有限公司合成。FAK兔抗人抗体购自Santa Cruz,Akt、p-Akt、MAPK1/2、p-MAPK1/2抗体购自Cell Signal;Transwell小室和培养瓶购自Corning;细胞培养基DMEM/F12和胎牛血清购自Gibco;嘌呤霉素购自Sigma;matrigel 购自BD。
1.2细胞株 人肝癌细胞株HCC-LM3由广东省人民医院病理生理研究部惠赠;包装病毒细胞株Phoenix 购自Orbigen。
2方法
2.1逆转录病毒载体的设计及合成 根据GenBank数据库提供的FAK基因序列(GI:439874),按shRNA的设计原则设计目的shRNA序列, BLAST对比分析。构建质粒3’端酶切位点之前加入Pol III聚合酶终止信号TTTT,以Loop(9 nt的茎环结构)相连,两端分别加入酶切位点BamHⅠ和HindⅢ,正义链5’-GATCCGCCACCTGGGCCAGTATTATTTCAAGACGATAATACTGGCCCAGGTGGTTTTTTGTCGACA-3’,反义链3’-GCGGTGGACCCGGTCATAATAAAGTTCTGCTATTATGACCGGGT-CCACCAAAAAACAGCTGTTCGA-5’。
2.2逆转录病毒载体的构建 将合成的正、反义链经过变性、复性后形成双链FAK-shRNA,定向克隆入逆转录病毒载体pSuper.retro后,转化大肠杆菌菌株E.coliDH5α,以氨苄青霉素(100 mg/L)筛选出阳性克隆,提取质粒。
2.3重组质粒FAK-shRNA 的鉴定 重组质粒用BamHⅠ与HindⅢ酶进行双酶切,酶切产物行0.8%琼脂糖凝胶电泳。选取阳性克隆纯化后送到上海博尚生物公司测序鉴定,命名为FAK-pSuper-shRNA。
2.4重组质粒转染包装病毒细胞株 将包装病毒细胞Phoenix接种到6孔板中,1×105cells/well,完全培养基培养12 h后更换无血清DMEM/F12培养1 h,分别使用空载体pSuper.retro、pSuper-FAK质粒各5 μg,脂质体Lipofectamine2000 6 μL /well转染Phoenix。转染6 h后更换完全培养基,48 h后加入1 mg/L嘌呤霉素,筛选3-4周获得阳性克隆。细胞株命名为293T-Phoenix-pSuper-FAK及293T-Phoenix-pSuper-control。
2.5重组逆转录病毒感染HCC-LM3细胞株 将筛选获得的Phoenix阳性克隆培养至90%融合后换成无嘌呤霉素的完全培养基,24 h后收集细胞上清。HCC-LM3细胞株接种到6孔板中,每孔加入1 mL Phoenix细胞上清滤液, 37 ℃、5%CO2条件下继续培养24 h,更换含1 mg/L嘌呤霉素的完全培养基筛选,每3-4 d换液,约40 d后筛选完成。所产生的细胞株分别命名为LM3-pSuper-FAK及LM3-pSuper-control。
2.6Western blotting检测FAK蛋白的沉默及Akt、p-Akt、MAPK1/2、p-MAPK1/2表达情况 将筛选后的HCC-LM3细胞株接种到6孔板中,培养至每孔1×105细胞时,收集细胞。用细胞裂解液裂解,Bradford蛋白浓度测定试剂盒检测蛋白浓度,上样量25 μg总蛋白, 10% SDS聚丙烯酰胺凝胶电泳,将蛋白质转移到PVDF 膜,用含5%脱脂奶粉的T-TBS 37 ℃封闭1 h,分别加入兔抗人FAK、Akt、p-Akt、MAPK1/2和p-MAPK1/2 单克隆抗体(1∶1 000 稀释, Santa Cruz)或兔抗人GAPDH单克隆抗体(1∶8 000稀释,Santa Cruz) 4 ℃孵育过夜。T-TBS漂洗5 min×3次;兔抗辣根过氧化物酶标记Ⅱ抗(1∶7 000稀释,Santa Cruz)4 ℃孵育45 min; T-TBS漂洗5 min×3次;SuperSignal West Femto(Pierce)敏感曝光试剂盒曝光底片显影。
2.7细胞迁移实验 在Transwell下室的DMEM培养液中加入10%血清,在Transwell上室分别滴加1×105LM3-pSuper-FAK及LM3-pSuper-control细胞悬液(无血清)。将上室置于下室之中, 在37 ℃温箱孵育24 h后取出上室,以棉签将残留在上室内表面上的细胞轻轻拭去。上室用PBS洗涤后,迁移至上室膜外上的细胞用0.1%结晶紫染色,以清水洗3遍,显微镜下(×100)计算迁移细胞数, 结果取5个视野细胞计数的平均值。
2.8细胞侵袭实验 操作按Corning公司Transwell书明书进行,铺matrigel按照BD公司说明书进行。在Transwell上室分别滴加5×104LM3-pSuper-FAK及LM3-pSuper-control细胞悬液(无血清)。在37 ℃温箱孵育36 h后取出上室,以棉签将残留在上室内表面上的细胞轻轻拭去。上室用PBS洗涤后,迁移至上室膜外上的细胞用0.1%结晶紫染色,以清水洗3遍,显微镜下(×100)计算迁移细胞数, 结果取5个视野细胞计数的平均值。
2.9流式细胞仪检测 LM3-pSuper-FAK及LM3-pSuper-control细胞的细胞周期和凋亡 将LM3-pSuper-FAK及LM3-pSuper-control细胞分别制成单个细胞悬液,70%预冷乙醇固定, PBS洗涤,再用碘化丙啶(propidium iodide,PI)处理备检。用ProfileⅡ型流式细胞仪,在488 nm 激发波长下测定细胞DNA,分析细胞周期及检测细胞早期凋亡情况。
3.0MTT检测 LM3-pSuper-FAK及LM3-pSuper-control细胞的细胞增殖率将LM3-pSuper-FAK、LM3-pSuper-control及未处理的LM3细胞消化,调整细胞悬液浓度,细胞计数后每孔加入200 uL铺96孔板使待测细胞调密度至1 000 cells/well,设置凋零孔(培养基、MTT、二甲基亚砜)及空白对照孔(培养液、二甲基亚砜),边缘孔用PBS填充。37 ℃培养箱孵育48 h后,每孔加入20 uL MTT溶液4 h,每孔加入150 uL二甲基亚砜,避光置于摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪A570处测量各孔的吸光度值。
3统计学处理
结 果
1测序鉴定重组质粒
将提取的重组质粒送交上海博尚生物公司测序,测序结果发现目的片段成功连接于载体中,见图1。
Figure 1. The DNA sequence of a recombinant.
2Westernblotting检测FAK蛋白的沉默
经Western blotting检测分析表明,内参为均一显影的条带,FAK显影条带密度不同,见图2。未处理组及对照组FAK蛋白表达量与LM3-pSuper-FAK组比差异显著, LM3-pSuper-FAK 组蛋白表达量明显减少。
3沉默FAK对LM3中Akt、p-Akt、MAPK1/2、p-MAPK1/2表达的影响
经Western blotting检测分析表明,下调FAK后可见p-Akt和p-MAPK1/2蛋白表达明显减少,Akt及MAPK1/2未见明显改变,见图3。
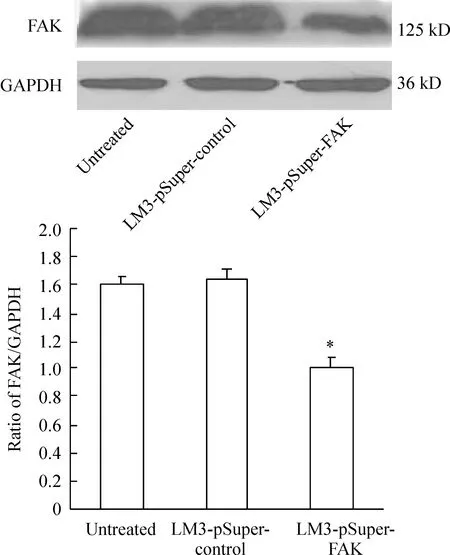
Figure 2. Western blotting analysis of FAK in HCC-LM3 cells±s.n=3.*Plt;0.05 vs LM3-pSuper-control group.
4下调FAK表达对LM3细胞迁移侵袭的影响
经过Transwell 实验检测分析表明,下调FAK后可见LM3-pSuper-FAK组迁移率及侵袭能力明显下降。迁移至下室的细胞数目对照组为(52.12±11.38) cells/视野,实验组为(22.67±4.36) cells/视野,见图4。穿过metrigel的细胞数对照组为(23.53±4.54)cells/视野,实验组为(5.34±0.73)cells/视野,两组比较差异显著(Plt;0.05),见图5。
5下调FAK表达对LM3细胞的细胞周期和凋亡影响
经过流式细胞仪检测分析表明,LM3-pSuper-FAK组凋亡细胞数占总检测细胞数的(6.00±1.23)%,LM3-pSuper-control组为(0.88±0.12)%,两者比较差异显著(Plt;0.01)。LM3-pSuper-FAK G0/G1期比率是(64.0±2.4)%,相对LM3-pSurper-control组(44.8±1.6)%,有更多的细胞阻滞在G0/G1期,S期细胞数量明显减少,见图6。
6下调FAK对LM3细胞增殖率的影响
MTT实验结果表明(图7),下调FAK表达的人肝癌细胞LM3-pSuper-FAK、LM3-pSuper-control细胞的增殖抑制率分别为(27.97±0.34)%和(5.45±0.22)%,两组相比差异显著(Plt;0.01)。

Figure 3. Western blotting analysia the expression of Akt,p-Akt,MAPK and p-MAPK protein in HCC-LM3 cells. ±s. n=3. **Plt;0.01 vs LM3-pSuper-control group.
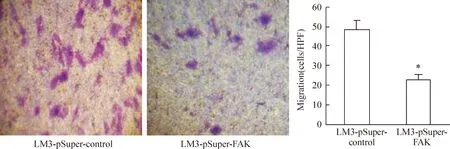
Figure 4. LM3-pSuper-FAK and LM3-pSuper-control cells were added into the upper chamber of the Transwell chamber without matrigel.After 24 h 37 ℃ incubation, the cells in the lower chamber were counted(crystal violet staining,×100).±s. n=5. *Plt;0.05 vs LM3-pSuper-control group.
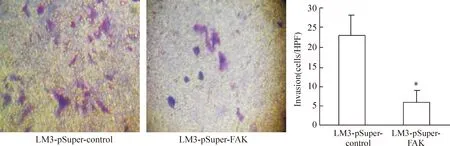
Figure 5. LM3-pSuper-FAK and LM3-pSuper-control cells were added into the upper chamber of the Transwell chambe with matrigel.After 36 h 37℃ incubation, the cells in the lower chamber were counted(crystal violet staning,×100).±s. n=5. *Plt;0.05 vs LM3-pSuper-control group.

Figure 6. Cell cycle and apoptosis tested by flow cytometry±s. n=3.*Plt;0.05, ** Plt;0.01 vs LM3-pSuper-control group.

Figure 7. The proliferation of LM-3 cells after knowndown of FAK. .n=3.**Plt;0.01 vs LM3-pSuper-control group.
讨 论
黏着斑激酶(FAK)在肿瘤的迁移、增殖、生存、侵袭、转移和血管形成及白血病等起着重要的调控作用[1-6]。本课题探讨了应用RNA干扰(RNA interference, RNAi)技术对FAK基因进行沉默并筛选出稳定表达细胞株,并观察其对肝癌细胞相关蛋白表达的影响。
RNAi是指在生物体细胞内,外源性或内源性的双链RNA 引起与其同源mRNA的特异性降解,抑制其相应基因的表达,其作为一种新兴的逆向遗传研究方法,与传统的基因疗法相比具有高效、高特异性及无毒副作用等特点[7]。构建shRNA表达载体基于具有合适启动子的载体或转录元件,在细胞体内经过酶切持续生成大量的siRNA,其抑制目的基因的效果与合成siRNA的相似,但更加稳定。逆转录病毒载体能将外源基因有效地整合到宿主细胞基因组中,并随细胞分裂而传给后代,获得包装细胞株后可以稳定的得到含有目的载体的病毒颗粒,而且未经包装时为缺陷性病毒,不具有完整功能,只有经包装细胞系为其提供结构蛋白组分,二者相互补偿后才能包装成具有完整功能的病毒颗粒,因此感染靶细胞后不能扩增,具有很高的安全性[8]。
本实验构建了针对FAK基因的shRNA表达载体FAK-pSuper-shRNA,并成功筛选稳定表达细胞株,得到不同抑制率的FAK阳性克隆,以Western blotting观察FAK蛋白表达量的变化,结果显示FAK-pSuper-shRNA重组质粒的干扰组能明显降低FAK蛋白的表达。相对使用化合物或反义寡核苷酸等方法,利用病毒介导的RNAi更具效率,且可以得到持续传代的稳定表达,有利于保持实验数据的稳定性。在进行细胞株筛选的过程中我们也发现,对于人肝癌细胞株LM3,下调FAK后其生长缓慢,我们猜测相对于瞬时转染,在筛选稳定表达细胞株时除去FAK本身对细胞增殖能力的影响外,还有细胞内环境在适应FAK低表达的过程中需要调动其他信号通路来补偿FAK的功能的原因,那么可能在这种稳定表达细胞株继续检测敲除FAK对细胞内信号通路影响时,实验结果会和瞬时转染或利用特异性抑制剂所产生的结果存在区别,有研究以瞬时转染进行RNA干扰,同样可以较高效率抑制FAK蛋白表达[9],但是稳定表达细胞株因其具有实验结果稳定性,可以为今后的研究打下基础。
Akt又称蛋白激酶B(protein kinase B,PKB),是一种丝氨酸/苏氨酸激酶,在细胞存活途径中起重要作用。Akt的活化形式是磷酸化,其有2个磷酸化位点,只有当2个位点完全磷酸化后才能使Akt完全活化。Akt作为PI3K/Akt 信号通路中与人类恶性肿瘤相关的下游主要效应靶基因,它可以活化许多不同类型的效应底物,对细胞生存、细胞周期进程,细胞生长等有很大的影响,活化的Akt在抑制细胞的凋亡、促进细胞的增殖、促进细胞的运动和侵袭方面起重要作用,与肿瘤发生发展密切相关。已经有研究发现在多种肿瘤中均有Akt及其磷酸化过度表达及活化[10]。并且在活化过程中可以诱导caspase-3抑制蛋白survivin的表达,其还可以在无ERK信号通路参与的情况下促进线粒体释放细胞色素C,激活内源性的信号通路[11]。有研究表明当Akt过度激活后,可以促进抗凋亡基因bcl-2表达,抑制促凋亡基因bax表达,从而使细胞对化疗药物敏感性降低[12]
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶。MAPK1/2是发现最早、研究最广的MAPK家族成员。在哺乳动物细胞中,它参与细胞周期、细胞增殖与分化、衰老和凋亡、基因转录等多种细胞生命事件的调控,磷酸化为其活化形式。MAPK1/2 在一系列反应如生长因子和有丝分裂等刺激中被激活,同时其持续活化最终促进细胞增殖和恶性转化。p-ERK1/2 的下调则可促进细胞生长和生长刺激基因转录的抑制。目前已经发现 MAPK在一些恶性肿瘤中被明显激活[13]。
本研究结果表明,当下调FAK表达之后,Akt及MAPK表达无明显改变,但其磷酸化明显被抑制,说明在肝癌细胞LM3中,FAK可以影响Akt及MAPK的活化程度,通过下调FAK表达,可以对恶性肿瘤中异常激活的信号通路产生影响,并起到抑制肿瘤的作用。同时通过细胞迁移、侵袭实验发现,下调FAK之后肿瘤细胞迁移、侵袭能力下降。流式细胞仪检测下调FAK后的LM3细胞主要停留在G0/G1期并且细胞凋亡增多。MTT实验也证明下调FAK表达可使细胞增殖率下降。
以FAK基因为作用靶点,构建稳定低表达FAK基因的人肝癌细胞株LM3,并探讨了RNAi对于该基因表达的抑制作用及沉默该基因表达后对相关蛋白表达和肿瘤细胞生物学特性的影响,为下一步实验打下基础并为肝癌的基因治疗提供理论依据。
[1] Donato DM, Ryzhova LM,Meenderink LM,et al.Dynamics and mechanism of p130Cas localization to focal adhesions[J]. J Biol Chem, 2010, 285(27):20769-20779.
[2] Wendt MK, Smith JA, Schiemann WP. p130Cas is required for mammary tumor growth and transforming growth factor-β-mediated metastasis through regulation of Smad2/3 activity[J]. J Biol Chem, 2009,284(49):34145-34156.
[3] Zhao J, Zheng C, Guan J. Pyk2 and FAK differentially regulate progression of the cell cycle[J]. Cell Sci,2000,113(Pt 17):3063-3072.
[4] Yamamoto D,Sono Y,Hasegawa M,et al.FAK overexpression upregulates cyclin D3 and enhances cell proliferation via the PKC and PI3-kinase-Akt pathways[J]. Cell Signal,2003,15(6):575-583.
[5] Kurenvoa E,Xu LH,Yang X,et al.Focal adhesion kinase suppresses apoptosis by binding to the death domain of receptor-interacting protein[J]. Mol Cell Biol, 2004,24(10):4361-4371.
[6] 许吕宏,方建培,Le Yi,等.FAK基因沉默诱导白血病细胞凋亡[J].中国病理生理杂志,2010,26(7):1352-1355.
[7] Brummelkamp TR, Bernards R, Agami R. A system forstable expression of short interfering RNAs in mammalian cells[J]. Science, 2002, 296(5567): 550-553.
[9] Yuan Z, Zheng Q, Huang XY, et al. The role of FAK expression inhibition by RNA interference on liver cancer cells[J]. Zhonghua Wai Ke Za Zhi, 2007,45(19):1350-1353.
[10]Saglam O,Garrett CR,Boulware D,et al.Activation of the serine/threonine protein kinase AKT during the progression of colorectal neoplasia[J].Clin Colorectal Cancer,2007,6(9):652-656.
[11]Hu H,Jiang C,Li G,et al.PKB/AKT and ERK regulation of caspase-mediated apoptosis by methylseleninic acid in LNCaP prostate cancer cells[J].Carcinogenesis,2005,26(8):1374-1381.
[12]谢 霞,高 青,王艳丽.抑制PI3K/PKB通路逆转胃癌耐药的作用及其机制[J].第三军医大学学报,2009,31(3):227-229.
[13]赵 杨,赵 林,郭科军,等. 细胞外信号调节激酶在乳腺癌中的表达及意义[J]. 中国医科大学学报,2007,36(3):328-329.
ConstructionofFAK-shRNAretroviralvectorandscreeningofstableHCC-LM3celllinewithpersistentknockdownofFAK
Aliya, LIN Wu, HE Qiang
(DepartmentofHematology,TheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China.E-mail: 1heqiang@hotmail.com)
AIM: To construct a recombinant retroviral vector of short interfering RNA targeting focal adhesion kinase (FAK) gene and to establish a cell line with stable knockdown of FAK.METHODSThe oligonucleotides that transcribed to short hairpin RNA (shRNA) targeting FAK gene were synthesizedinvitro, cloned into retroviral vector pSuper.retro and transfected into Phoenix cell line. The stable clones were screened and high-titer virus was produced. The human hepatocellular carcinoma cell line HCC-LM3 was infected with the virus-rich supernatant. The stable LM3 cell line, which showed significantly to silence FAK and associated proteins, was selected by puromycin.RESULTSThe recombinant retroviral vector was successfully constructed. Persistent knockdown of FAK in the LM3 cell line infected with the supernatant containing the retrovirus was confirmed by Western blotting. Down-regulation of FAK resulted in the inhibition of p-Akt and p-MAPK1/2 expression and led to decreased migration and invasion of the cells. The cell cycle was blocked at G0/G1phase, and apoptosis was increased. The proliferation rate also decreased significantly.CONCLUSIONFAK-shRNA virus generated by recombinant retroviral vector pSuper-FAK can inhibit the protein expression of FAK and phosphorylation of Akt and MAPK1/2 in HCC-LM3 cells. Down-regulation of FAK shows a significant impact on biological behaviors of tumor cells.
Focal adhesion kinase; RNA interference; Retroviral vector; Liver neoplasms
1000-4718(2011)04-0688-07
R363
A
10.3969/j.issn.1000-4718.2011.04.013
2010-11-01
2011-02-25
广东省自然科学基金资助项目(No.07001638)
△通讯作者 Tel:020-87755766-8214;E-mail:1heqiang@hotmail.com

