丹桂中花青素提取工艺的优化*
史玉敏,陈洪国,严 恒
(1.咸宁学院 化学与生命科学院,湖北 咸宁 437000;2.湖北省商品质量监督管理站,湖北 武汉 430032)
丹桂中花青素提取工艺的优化*
史玉敏1,陈洪国1,严 恒2
(1.咸宁学院 化学与生命科学院,湖北 咸宁 437000;2.湖北省商品质量监督管理站,湖北 武汉 430032)
实验以丹桂为试材,对其提取条件进行了研究,考察了温度、液料比、乙醇浓度、提取时间对丹桂花中原花青素提取率的影响。实验结果表明:在50℃水浴中,以35%乙醇和35%丙酮的混合液作为提取液,用7:1的液料比提取45.2min为桂花花青素的最佳提取工艺。
丹桂;花青素;提取工艺
花青素(anthocyanidin)是一类广泛存在于植物中的水溶性色素,属于类黄酮化合物。自然条件下游离的花青素极少见,而常与一个或多个葡萄糖、鼠李糖、半乳糖、木糖、阿拉伯糖等通过糖苷键形成花色苷(anthocyanin)。花色苷是一类具有保健功能的活性成分,大量研究表明:花色苷具有很强的抗氧化作用,可以清除体内的自由基,降低氧化酶的活性;降低高血脂大鼠的甘油脂水平,改善高甘油脂脂蛋白的分解代谢;抑制胆固醇吸收,降低低密度脂蛋白胆固醇含量;抗变异、抗肿瘤、抗过敏、保护胃粘膜等多种功能[1-4]。
花青素在植物中广泛存在,最突出的作用就是使植物呈现五彩缤纷的颜色。在葡萄籽、山楂皮、苹果、茄子皮、紫薯、玫瑰花、黑(红)米、牵牛花等都含有大量的花青素[8-11]。另外桂花也是花青素的一种资源,桂花花青素的含量从初期到盛花期不断升高,到盛花期达到最大值,盛花期后逐渐下降,这种变化趋势与桂花开花和衰老过程中花瓣的色泽变化一致,表明桂花在开花进程中花瓣色泽深浅的变化是由花瓣色素含量变化所引起的[12]。桂花(Osmanthus fragrans Lour)属木犀科植物,是中国特有的常绿阔叶灌木或小乔木经济树种。随着我国中部崛起战略的实施,咸宁的桂花资源以其重要的生态价值和经济价值得到了越来越多的关注。咸宁盛产桂花,名扬华夏,而桂花品种众多、质地优良、产量丰富、香浓横溢,有“中华桂花之乡”的美誉[13]。据资料记载桂花中花含芳香物质,如γ-癸酸内酯、α-紫罗兰酮、β-紫罗兰酮、反-芳樟醇氧化物、顺-芳樟醇氧化物、芳樟醇、壬醛以及β-水芹烯、橙花醇、二氢-β-紫罗兰酮等常见化学成分,而且含有花青素[12]、类胡萝卜素、香豆素、挥发油等活性成分。,花青素来源于自然界,种类众多,作用广泛,毒副作用低,已成为现在抗氧化剂研究及开发的一大热点,并将在预防和治疗心血管疾病中发挥越来越大的作用,如果能够合理地开发利用,极有经济价值,是具有广阔发展前景的植物药。
本文利用紫光光度计法对丹桂中总原花青素的含量进行了定量。考察了温度、液料比、乙醇浓度、提取时间对丹桂花中原花青素提取率的影响,为丹桂花青素最佳提取条件确定提供参考。
一、材料与方法
1.实验材料、试剂、仪器
材料:选取咸宁学院桂花园内盛花期丹桂鲜花;于下午4-5时采摘,带回实验室,剥除花梗,去杂质,留花瓣进行试验。
试剂:无水乙醇、丙酮、石油醚(以上试剂均为分析纯);
仪器:TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任有限公司);
2.实验方法
花青素提取工艺优选实验:选取提取温度、提取液及其浓度、液料比、提取时间四项不同的因素,单因子逐步优化进行提取。通过测定从桂花中提取花青素的提取率,确定桂花花青素的最佳提取工艺[14-16]。
花青素测定方法:采用紫外可见分光光度法[17-18]在波长为530nm处测得吸光值(Abs),按下式计算花青素的含量:花青素含量(%)=(Absx100x7.2)/(Wx0.366)x100% 其中:100为提取液体积(mL),W为桂花粉末质量(mg)。
二、结果与讨论
1.不同提取温度对丹桂花青素提取率的影响
实验结果:由图1可知,随着温度的升高,在280nm处的OD值渐渐升高,50℃时达到最高,然后随着温度的升高而下降。一般来说,冷提的杂质少,热提的效率高。温度升高,分子运动速度加快,渗透,扩散溶解速度加快。同时,高温可以引起细胞膜结构的变化,使花青素由丹桂外层细胞转移到溶剂中。因此,随着提取温度的升高,原花青素的提取效率也升高。但温度过高会是原花青素的结构被氧化破坏,从而导致其提取效率也降低。y=ax2+bx+c x(℃)在图上任意取三点 ,把这三个点代入方程中计算出:a=1/3000;b=2/1500;c=0.3根据公式( -b/2a,4ac-b2/4a)即(50,0.47)当x=50时,y值最大即提取率最大 。
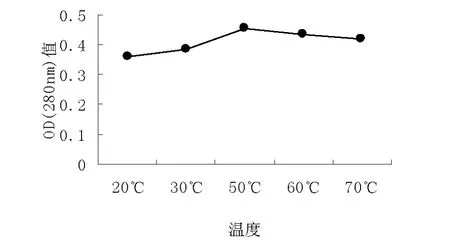
图1 不同温度对原花青素提取率的影响
2.不同提取液及浓度对丹桂花青素提取率的影响
如表1所示:当提取液为35%乙醇和35%丙酮的混合液时,桂花花青素的提取率最高。此外当提取液中含有丙酮溶液时提取率较高,这是因为花青素分子含有多个苯环和醚键,油溶性较强,同时又有大量的羟基连接在分子骨架上,在水中具有很好的溶解性,拥有油水双溶性的丙酮与之相互匹配,花青素的溶解度增加,提取率提高,但丙酮的沸点为56℃,而最佳提取温度为55℃,此时大部分丙酮已经挥发,所以用乙醇和丙酮的混合液为提取液效果较好。
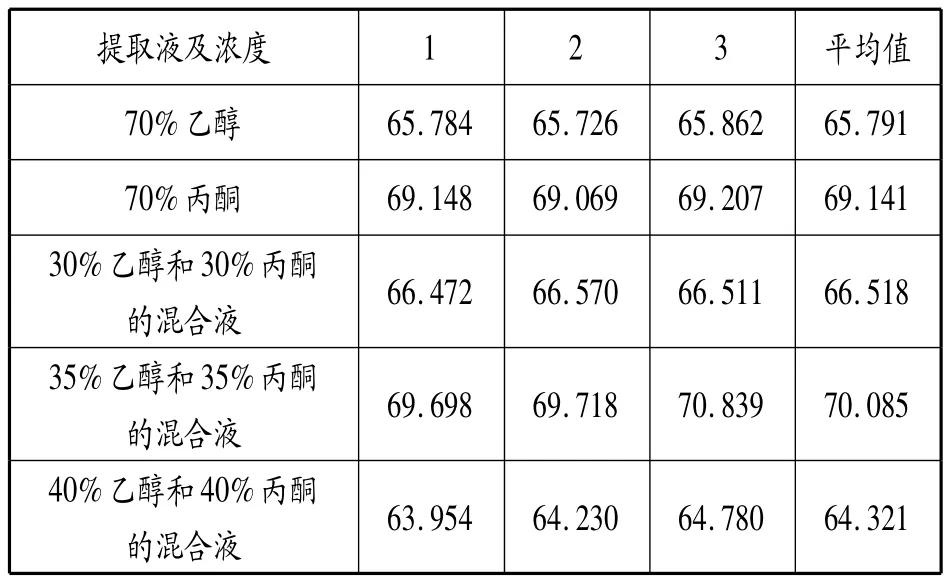
表1 不同提取液及浓度对桂花花青素提取率的影响
当乙醇和丙酮的混合液浓度达到一定浓度时,花青素溶解度最大,提取率最高。而后,再增加其浓度,花青素的提取率反而减小。这是由于一些醇溶性杂质,亲脂性强的成分溶出量增加,这些成分与花青素竞争和乙醇-水分子结合而引起的。
3.不同液料比对丹桂花青素提取率的影响
实验结果:y=ax2+bx+c在图上任意取三点,把这三个点代入方程中计算出:a=17/8;b=-33/2;c=0.72顶点公式( -b/2a,4ac-b2/4a)即(7.12,0.68)当 x=7.12 时,y值最大即提取率最大。当x取整数值x=7时,y值最大。
由图2可知,随着液料比的增大,在280nm处的OD值逐渐升高,在液料比为7:1时,OD值达到最大,然后随着液料比的增加而略有下降。料液比实际上是溶剂用量的大小。一般来说,溶剂用量越大,提取率就越大,但是料液比过大会造成溶剂和资源的浪费,并给后续的浓缩带来困难。
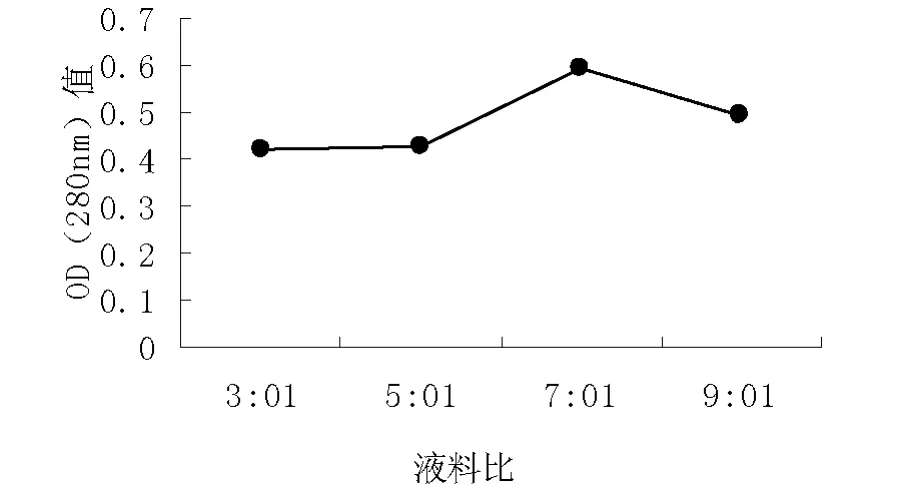
图2 不同液料比对原花青素提取率的影响
4.不同提取时间对丹桂花青素提取率的影响
时间对花青素提取率的影响由图3所示:y=ax2+bx+c x(min)在图上任意取三点,把这三个点代入方程中计算出:a=2/375;b=1/6;c=0.445 顶点公式( -b/2a,4acb2/4a)即(45.2,0.61)当 x=45.2 时,y值最大即提取率最大。
在提取时间未达到45.2min时,桂花中花青素的提取率随提取时间的延长而增大,当提取时间为45min时从桂花中提取花青素的提取率最高。280nm处的OD值达到最大,随着时间的增加,OD值没有明显的增加反而下降。原花青素的提取率随时间的不同而不同,当达到一定的提取时间时,由于丹桂内外有效成分浓度达到平衡,使得提取率最高。这是由于当达到一定的提取时间时,桂花内外有效成分浓度达到平衡,使得提取率最高。但如果提取时间过短,花青素来不及从桂花细胞中溶出,也会影响提取率。而随着提取时间的进一步延长,其提取率有所下降,这是由于花青素在溶剂中长时间受热,可能是部分酚结构被破坏。
通过对提取温度、提取液浓度、液料比、提取时间单因素进行实验,确定最佳提取工艺为:在50℃水浴中,以35%乙醇和35%丙酮的混合液为提取液,在液料比为7:1的条件下对桂花提取45.2min,此时花青素平均提取率为62%。

图3 不同提取时间对原花青素提取率的影响
三、结论
影响花青素提取率的因素很多,如提取温度、提取液浓度、液料比、提取时间及不同的提取液、pH 等等[12-13]。本实验表明:以35%乙醇和35%丙酮的混合液作为提取液,在50℃水浴中,以液料比为7:1的条件对桂花提取45.2min效果最佳,此时花青素平均提取率为62%。
其主要原因分析如下:用丙酮作为提取液比乙醇作为提取液提取率较高,但由于丙酮的沸点为56℃,而最佳提取温度为50℃,此时大部分丙酮已经挥发,所以用乙醇和丙酮的混合液为提取液效果较好。而用35%乙醇和35%丙酮的混合液作溶剂,是因为有机溶剂的溶解能力好,穿透细胞能力强。随着其浓度的增加,提取率增大。当有机溶剂浓度达到一定浓度时,花青素溶解度最大,提取率最高。而后,再增加其浓度,花青素的提取率减小。这是由于一些亲脂性强的成分溶出量增加,这些成分与花青素竟争而引起的;花青素的提取率随时间的不同而变化,当达到一定的提取时间时,由于桂花内外有效成分浓度达到平衡,使得提取率最高。由于花青素在溶剂中长时间受热,可能是部分酚结构被破坏,随着提取时间的进一步延长,其提取率有所下降,若提取时间过短,花青素来不及从桂花细胞中溶出,也会影响提取率;一般来说,提取剂用量越大,提取率就越大,但提取剂用量达到一定程度,桂花中花青素已基本全部溶出,再增加提取剂用量,不仅会造成提取剂和资源的浪费,还给后序的浓缩带来困难;总的说来,冷提的杂质少,热提的效率高,温度升高,分子运动速度加快,渗透、扩散溶解速度加快。而且,高温可以引起细胞膜结构的变化,使花青素由桂花外层细胞转移到溶剂中。因此,随着提取温度的升高,花青素的提取率也升高。但是温度过高会使花青素的结构被氧化破坏,从而导致其提取率的降低。
[1]陈洪国,刘顺枝.湖北咸宁地区桂花开花和衰老过程中花瓣的某些生理生化指标变化[J].植物生理学通讯,2006,42(1):112~115.
[2]陈洪国.桂花开花进程中花瓣色素、可溶性糖和蛋白质含量的变化[J].武汉植物学研2006,24(3):231~235.
[3]刘邻渭.食品化学[M].北京:中国农业出版社,1998.116~21.
[4]陈晓玲.植物药中原花青素的抗氧化作用[J].中国中药杂志,2003,28,(8):700 ~702.
[5]剧红梅,曲梓怡,王召令,苏利强,徐明.原花青素的抗氧化作用与临床康复[J].中国组织工程研究,2007,11,(16):3155 ~3157.
[6]Kamei H,Hashimoto Y.Anti- tumor effect ofmethanol extracts from red and white wines[J].CancerBiotheraphy and Radiopharmacology1,1998,11,(4):273 ~27.
[7]Bridle P.Anthocyanins as natural food colours-selectd Aspects[J].Food Chem,1997,58,(1 -2):103 ~9.
[8]Obi F,Usenu L.Prevention of Carbon tetrachloride - induced hepatotoxicity in the Rat by H.rosa2 sinensis is anthocyanin extract administered in ethanol[J].Toxicology,1998,131,(2 -3):93 ~8.
[9]李升锋,徐玉娟,张友胜,吴继军,唐道邦,温靖.玫瑰茄花青素提取条件优化研究[N].广东农业科学,2006,(11):83 ~85,88.
[10]刘通讯,金宁,孙寒潮.山楂原花青素的提取纯化工艺及其组分鉴定[J].食品与发酵工业,2006,32,(12):142~144.
[11]吕丽爽.葡萄籽中低聚原花青素提取工艺初探[J].食品工业科技,2002,23,(1):17 ~19.
[12]吴琼英周卫靖.苹果中原花青素的提取及其抗氧化活性研究[J].食品科技,2006,31,(12):42 ~45.
[13]陈洪国.桂花开花进程中花瓣色素、可溶性糖、可溶性蛋白质含量的变化[J].武植物学研究,2006,24,(3):231~234.
[14]陈洪国,汪华.我国桂花资源的研究和利用及咸宁桂花发展现状[N].咸宁学院学报,2004,24,(3):116~118.
[15]吴春,陆海燕,李健.葡萄籽原花青素的提取工艺研究[J].食品工业,2004,25,(3):22 ~23.
[16]罗宝生,戴万生.大黄原花青素提取纯化工艺研究[J].云南中医中药杂志,2007,28,(1):36 ~38.
[17]刘桂玲,李海霞,郭宾会,张鹏.不同提取方法对甘薯花青素含量测定的影响[N].中国农学通报,2007,23,(4):91 ~94.
[18]傅武胜,黄剑锋.紫外分光光度法测定葡萄籽提取物中的原花青素含量[J].食品研究与开发,2002,23,(6):90~92.
[19]戚向阳,黄红霞,巴文广.苹果中原花青素提取工艺的研究[J].食品工业,2003,24,(3):63 ~65.
[20]BettiV.Study of the mechanism whereby anthocyanosides potentiate the effect of catecholamines on coronary vessels[J].Fitoterapia,1985,54,(2):67 ~72.
[21]陈晓玲.植物药中原花青素的抗氧化作用[J].中国中药杂志,2003,28,(8)700 ~702.
[22]剧红梅,曲梓怡,王召令,等.原花青素的抗氧化作用中国组织工程研究[J].与临床康复,2007,11,(16):3155~3157.
Q81
A
1006-5342(2011)04-0026-03
2011-02-21
咸宁市科学技术研究项目:桂花黄酮提取工艺优化及抗氧化活性的研究(2010018);咸宁学院2010年校级科研项目:桂花中黄酮类物质提取与纯化的研究(KY10050)

