糖皮质激素受体在豚鼠耳蜗的分布及声损伤对其表达的影响
王斌 韩朝 迟放鲁 田洁
·基础研究·
糖皮质激素受体在豚鼠耳蜗的分布及声损伤对其表达的影响
王斌 韩朝 迟放鲁 田洁*
目的研究糖皮质激素受体(GR)在豚鼠耳蜗的分布及声损伤对豚鼠耳蜗GR表达的影响。方法将豚鼠随机分为2组:实验组豚鼠在强度115 dB SPL的白噪声中暴露3 h。暴露结束后2 h,断头取耳蜗。对照组豚鼠不做处理,取耳蜗。制备耳蜗冷冻切片,采用免疫荧光技术观察豚鼠耳蜗的GR表达情况,并进行荧光强度半定量分析。结果①豚鼠耳蜗GR主要的阳性部位:螺旋韧带、血管纹、骨螺旋缘、Corti器及螺旋神经节。螺旋韧带、血管纹、骨螺旋缘及螺旋神经节等区域的GR荧光强度差异无统计学意义(Pgt;0.05),上述各区域的GR荧光强度与Corti器的GR荧光强度差异有统计学意义(Plt;0.05)。②声损伤后,豚鼠耳蜗的GR荧光强度在骨螺旋缘、Corti器及螺旋神经节较对照组差异无统计学意义(Pgt;0.05);螺旋韧带、血管纹区域荧光强度较对照组明显减低,差异有统计学意义(Plt;0.01)。结论GR分布于豚鼠耳蜗的螺旋韧带、血管纹、Corti器和螺旋神经节,其中螺旋韧带、血管纹表达最强,Corti器表达最弱;声损伤降低耳蜗各区域GR的表达,以血管纹、螺旋韧带最明显。(中国眼耳鼻喉科杂志,2011,11:86-89)
糖皮质激素受体;耳蜗;声损伤;豚鼠
糖皮质激素(glucocorticoid,GC)主要通过被动扩散的方式结合于糖皮质激素受体(glucocorticoid receptor,GR),激素-受体复合物最终进入细胞核影响蛋白的合成代谢。因此GC的作用需要GR的介导,而内耳GR可能是应激时有用的标志物[1]。已有学者[2]应用酶联免疫吸附试验(enzyme link immunosorbent assay,ELISA)、原位杂交、免疫组织化学方法研究GR在内耳的表达,同时应用分子生物学的方法研究噪声对豚鼠内耳GR mRNA水平的影响,但是直观地观察噪声暴露后豚鼠内耳GR的分布及表达变化尚罕见报道。我们利用免疫荧光技术初步观察GR在豚鼠耳蜗的分布及声损伤对豚鼠内耳GR表达的影响。
1 材料与方法
1.1 仪器及试剂 仪器:丹麦Brüel amp; Kjr 1405型噪声发生器,德国Sartorius公司BS224S型电子分析天平,德国Sartorius公司PB-10型pH计,德国Leica公司冷冻切片机,德国Leica公司MPS30荧光倒置显微镜,德国Leica公司连续变倍体视显微镜。试剂:兔抗豚鼠GR抗体(Abcam公司),羊抗兔IgG-TRITC(华美生物工程公司)。其余试剂为国产分析纯。
1.2 动物及分组 健康纯白红目豚鼠36只,耳廓反射正常,体质量200~250 g,雌雄不拘。由上海市实验动物中心提供。随机分为实验组与对照组,每组18只。实验组予噪声暴露,暴露结束后2 h断头取耳蜗。正常对照组不做处理,取耳蜗。
1.3 方法
1.3.1 噪声暴露 将动物置于通风良好的小型隔音箱内(箱壁由双层钢板组成,中间填充泡沫隔音材料),箱内背景噪声40 dB SPL。噪声由噪声发生器(Bamp;K 1405)产生,经功率放大器(FJG600-1)放大后,输入扬声器。扬声器置于箱内侧壁和顶壁。用 4145微型话筒连接 Bamp;K2610频率放大器监测声压,测试系统用124 dB活塞发生器校准。隔音箱内任何点声压均匀度误差不超过±1 dB。噪声为白噪声,强度为115 dB SPL,暴露时间3 h。
1.3.2 豚鼠耳蜗冷冻切片的制备 将豚鼠快速断头取双侧听泡。取耳蜗,置于预冷的4%多聚甲醛中。打开圆窗、前庭窗(卵圆窗)及蜗尖,用吸管从蜗尖处向耳蜗内灌流固定液,将耳蜗置于该固定液中4 ℃ 4 h以上。然后用磷酸缓冲液(phosphate-buffered saline,PBS)冲洗耳蜗并放入10%乙二胺四乙酸钠脱钙10 d,每天换脱钙液。PBS冲洗后,将标本依次移入10%、15%、20%蔗糖PBS中进行梯度脱水。而后置于最佳切削温度包埋剂中包埋过夜,平行于耳蜗纵轴行8 μm恒冷冷冻切片。将切片贴于已经涂胶(多聚赖氨酸)处理的载玻片上,以备免疫荧光染色。
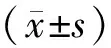
1.4 统计学处理 采用SPSS11.0统计软件分析所获得的数据,单因素方差分析比较耳蜗不同区域荧光强度。
2 结果
2.1 GR在豚鼠耳蜗的分布 观察对照组的36耳切片,GR阳性细胞在荧光显微镜下呈现红色荧光,且在豚鼠耳蜗各个部位均有不同程度染色,主要位于螺旋韧带、血管纹、骨螺旋缘、Corti器及螺旋神经节(附4页图1)。
选择图像的一定区域进行耳蜗GR荧光强度的测量。对螺旋韧带、血管纹、骨螺旋缘、Corti器及螺旋神经节等每个区域选择2个部位,采用计算机自带扫描分析软件测定荧光强度,对收集的荧光倒置显微镜图像进行荧光半定量分析,对非特异性的背景染色荧光强度也进行测量。由于每张切片的特定区域(如螺旋韧带),荧光的阳性区域强度基本一致,但是特定区域之间(如螺旋韧带与Corti器之间)荧光强度相差较大;所以在对每一特定区域(如螺旋韧带)中选取2个部位时,选取有阳性荧光的区域即可。GR的荧光强度减去背景荧光强度即为该区域GR表达的平均荧光强度。不同区域荧光强度的比较,间接反映了不同区域GR的表达情况。螺旋韧带、血管纹、骨螺旋缘以及螺旋神经节区域GR荧光强度无明显差别,上述各区域与Corti器的GR荧光强度差别明显(附4页图2)。
2.2 声损伤对豚鼠耳蜗GR表达的影响 观察噪声暴露组的36耳切片,与对照组豚鼠耳蜗GR组织分布区域一致,在螺旋韧带、血管纹、骨螺旋缘、Corti器以及螺旋神经节均可见GR表达呈现的红色荧光,但是螺旋韧带、血管纹区域荧光强度明显减低(附4页图3~5,封三图6)。
对照组及实验组耳蜗各区域GR表达经图像分析,进行耳蜗GR荧光强度测量。正常组与声损伤组不同区域荧光强度的比较,间接反映了声损伤对豚鼠耳蜗GR表达的影响。骨螺旋缘、Corti器以及螺旋神经节较对照组差异无统计学意义(Pgt;0.05),而螺旋韧带、血管纹区域荧光强度较对照组明显减低,差异有统计学意义(Plt;0.05),提示白噪声115 dB SPL,连续暴露3 h对骨螺旋缘、Corti器以及螺旋神经节GR的表达无明显影响,却显著抑制了螺旋韧带、血管纹区域GR的表达(封三图7)。
3 讨论
GC主要由肾上腺皮质分泌,是机体重要的应激激素和临床上常用的抗感染、抗免疫反应药物,GR在其效应的发挥过程中起着关键作用。GR和甲状腺激素受体、维A酸受体、性激素受体等一样,属于核激素受体超家族成员,分布于除红细胞以外的几乎所有的有核细胞。 同时GR也是一种核转录调控因子,调控多种基因转录的激活和抑制。因此,GR一直是医学领域的一个研究热点。
应用免疫学技术研究发现,GR在内耳表达的分布具有不均衡性。运用组织化学原位杂交检测发现,大鼠GR表达水平在螺旋韧带最高,在血管纹和Corti器显著低于螺旋韧带。运用ELISA检测人内耳组织,证实GR在内耳螺旋韧带组织表达水平最高,其次是Corti器组织,而血管纹最低[3]。运用免疫组织化学技术检测,豚鼠耳蜗GR的表达主要位于螺旋韧带、血管纹、Corti器和螺旋神经节,其中螺旋韧带的III型纤维细胞表达水平最高[4]。本实验运用免疫荧光技术进行检测发现,正常豚鼠耳蜗GR分布于螺旋韧带、血管纹、Corti器和螺旋神经节,其中螺旋韧带、血管纹表达最强,Corti器表达最弱,与上述结果基本一致。虽然应用的方法(组织化学原位杂交、ELISA、免疫组织化学技术、免疫荧光技术)不同,实验的对象(大鼠、豚鼠、人)有所差异,定量检测方法不一致(分子杂交、计算机图片灰阶分析、免疫荧光半定量分析),研究结果提示,GR在不同部位的表达强度次序上略有差别;但是这些实验结果的共性是GR在内耳的分布具有不均衡性,螺旋韧带表达最强。
在机体其他组织系统的研究显示,GC靶组织中GR的数量决定了组织对GC的生物学反应程度[5]。因此,GC对异源性内耳组织的效应与其GR的数量呈正相关。虽然本研究应用免疫荧光技术不能对GR数量进行精确的定量分析,但是应用计算机图像分析软件可对GR进行荧光强度半定量分析。不同区域间如果荧光强度差别具有统计学意义,则表明GR数量具有显著差别。本实验与既往研究相似,螺旋韧带GR的表达最强。
螺旋韧带区域存在3种纤维细胞,从上到下分别是Ⅰ、Ⅱ、Ⅲ型纤维细胞。Shimazaki等[4]的研究发现,这些纤维细胞均有GR表达,而以Ⅲ型纤维细胞最强。可以推测这些细胞对GC的生物学应答最强。但是Ⅲ型纤维细胞的功能尚不清楚。最近推测,螺旋韧带纤维细胞在耳蜗液体及离子平衡方面发挥作用。这种推测基于Na+-K+-ATP酶以及缝隙连接蛋白26(connexin 26,Cx26)的形态学观察。位于Ⅱ型纤维细胞的Na+-K+-ATP酶提示,K+从底部细胞吸收进入螺旋韧带纤维细胞,K+沿着Ⅰ型细胞及Ⅱ型细胞间的缝隙连接顺浓度梯度进入血管纹底部及中间细胞。富含Na+-K+-ATP酶的血管纹边缘细胞将K+泵入,之后沿着浓度梯度进入内淋巴。实验性内淋巴积水、迷路炎、气压性中耳炎的耳蜗,在Ⅰ型及Ⅱ型纤维细胞中Cx26免疫染色减弱。这些发现提示,螺旋韧带的纤维细胞与内耳某些功能障碍有关,而螺旋韧带纤维细胞中GR的表达提示,GC对于治疗这些功能障碍可能有效。
研究发现,耳蜗毛细胞GR表达不很显著,但是邻近的支持细胞也呈现GR阳性表达,提示GC治疗并不完全直接作用于耳蜗感觉细胞。
基于以上发现,我们认为GR在耳蜗的表达是不均衡的,GC在耳蜗的不同区域会产生不同的效应,针对多种内耳疾病的受损区域完善GC治疗的明确指征将成为可能。
应激状态下,比如过度的声刺激,对内耳GR表达的影响也得到一些学者关注。Terunuma等[2]将豚鼠分别暴露于2 kHz纯音110、120、130 dB SPL声强中10 min,在暴露后即刻,2、6、24 h应用反转录-聚合酶链反应检测过度声刺激对内耳GR表达变化的影响,发现暴露于120 dB SPL即刻、2 h及暴露于130 dB SPL 2、6 h的豚鼠,耳蜗GR mRNA水平明显下降。然而这一现象的确切机制尚不清楚。GR在耳蜗各区域分布不均衡,那么声损伤后各区域GR的表达有什么变化呢?本实验研究发现,115 dB SPL白噪声暴露3 h,噪声暴露结束2 h后螺旋韧带和血管纹GR的表达明显减少,差异有统计学意义(Plt;0.05),说明声损伤后GR表达的减弱与耳蜗功能受抑制有关。
Rarey等[6]报道,经噪声暴露之后的大鼠,Corti器的GR明显减少,而血清皮质酮水平明显升高,认为内耳GR表达可能是内耳组织对应激反应的有用标志物。先前的研究证实,血清GC能够在培养的IM-9淋巴细胞和大鼠胰腺腺泡AR42细胞调节GR mRNA水平[7]。因此,有理由推论声刺激提高了血清GC水平,下调了耳蜗GR mRNA水平。
Na+-K+-ATP酶主要分布于耳蜗血管纹的边缘细胞、螺旋韧带的II型纤维细胞以及缘上、纹上区域细胞;Ca2+-ATP 酶主要分布于螺旋韧带的I型纤维细胞。Na+-K+-ATP酶及Ca2+-ATP 酶对维持耳蜗正常功能发挥重要作用。研究发现,噪声暴露之后,Na+-K+-ATP酶及Ca2+-ATP 酶的活性明显下降[8],内淋巴Ca2+显著上升。因此,Na+-K+-ATP酶及Ca2+-ATP 酶活性减少将损害内淋巴液的构成,而且对感音神经性听力障碍发挥重要作用。在内耳,血清GC水平的升高与螺旋韧带和血管纹Na+-K+-ATP酶活性的降低有关[9]。因此作者认为,GC在调节Na+-K+-ATP酶活性方面发挥作用,后者在过度声刺激后活性降低。这些结果表明,GC对维持耳蜗离子平衡起重要作用,GR的表达水平可能影响内耳的代谢系统。
虽然GC已经广泛应用于治疗快速进行性双侧内耳功能障碍,如突发性聋、耳鸣、梅尼埃病、自身免疫性内耳疾病等,但是目前对GC在内耳的信号传导通路知之甚少。在细胞水平,GC通过结合GR发挥效应。GR是具有正性或负性调节某些基因能力的转录因子,属于类固醇激素受体家族。GR在细胞质中与伴侣蛋白结合在一起,保持其非激活形式。GC进入细胞,结合于GR。此时,GR与伴侣蛋白分离。2个激素受体结合物转移入核内。在细胞核内,GR结合到GC反应元件,调节GC的应答基因[10]。下丘脑-垂体-肾上腺轴是中心的控制调节系统,链接着中枢神经系统和激素系统。下丘脑-垂体-肾上腺轴的元素包括下丘脑的室旁核,其神经元合成和分泌加压素和促皮质释放素,活化肾上腺GC的合成和释放。因此,肾上腺皮质释放GC是由下丘脑和垂体调节的,由皮质醇的量呈现负反馈机制。 动物暴露于噪声时,一系列的生理和神经内分泌改变被激发,下丘脑-垂体-肾上腺轴的激活导致GC的释放。报道显示,小鼠正常状态下,皮质类固醇的含量为10 ng/mL;听力损伤停止后即刻(6~12 kHz,100 dB SPL,45 min),皮质类固醇水平升高15倍,之后快速恢复到正常水平[11]。
预先通过应激激活下丘脑-垂体-肾上腺轴,导致内源性皮质类固醇升高,或者给予外源性或者地塞米松,会对随后的听损伤具有保护作用。美替拉酮(皮质类固醇合成阻滞剂)联合RU486(GR拮抗剂)阻断下丘脑-垂体-肾上腺轴会加重听损伤后的听力损失[12],而地塞米松预处理对动物具有听保护作用[11]。因此,本实验的结果为临床上应用GC预防及治疗内耳疾患方面的研究提供了进一步的方向。
[1]Meltser I,Tahera Y,Canlon B.Glucocorticoid receptor and mitogen-activated protein kinase activity after restraint stress and acoustic trauma[J].J Neurotrauma,2009,26(10):1835-1845.
[2]Terunuma T,Hara A,Senarita M,et al.Effect of acoustic overstimulation on regulation of glucocorticoid receptor mRNA in the cochlea of the guinea pig[J].Hear Res,2001,151(1-2):121-124.
[3]Rarey KE.Curtis LM.Receptors for glucocorticoids in the human inner ear[J].Otolaryngol Head Neck Surg,1996,115(1):38-41.
[4]Shimazaki T,Ichimiya I,Suzuki M,et al.Localization of glucocorticoid receptors in the murine inner ear[J].Ann Otol Rhinol Laryngol,2002,111(12):1133-1138.
[5]Sumbaev VV,Iasinskaia IM.Effect of DDT on the interaction of cortisol with glucocorticoid-binding proteins in rat brain[J].Ukr Biokhim Zh,2000,72(3):114-117.
[6]Rarey KE,Gerhardt KJ,Curtis LM,et al.Effect of stress on cochlear glucocorticoid protein:acoustic stress[J].Hear Res,1995,82(2):135-138.
[7]Rosewicz S,McDonald AR,Maddux BA,et al.Mechanism of glucocorticoid receptor down-regulation by glucocorticoids[J].J Biol Chem,1988,263(6):2581-2584.
[8]Hsu CJ,Shau WY,Chen YS,et al.Activities of Na+,K+-ATPase and Ca2+-ATPase in cochlear lateral wall after acoustic trauma[J].Hear Res,2000,142(1-2):203-211.
[9]Hsu CJ,Chen YS,Shau WY,et al.Impact of activities of Na+-K+-ATPase and Ca2+-ATPase in the cochlear lateral wall on recovery from noise-induced temporary threshold shift[J].Ann Otol Rhinol Laryngol,2002,111(9):842-849.
[10]Beato M,Herrlich P,Schütz G.Steroid hormone receptors:many actors in search of a plot[J].Cell,1995,83(6),851-857.
[11]Tahera Y,Meltser I,Johansson P,et al.NF-kappaB mediated glucocorticoid response in the inner ear after acoustic trauma[J].J Neurosci Res,2006,83(6):1066-1076.
[12]Mori T,Fujimura K,Yoshida M,et al.Effects of glucocorticoid receptor antagonist on CAPs threshold shift due to short-term sound exposure in guinea pigs[J].Auris Nasus Larynx,2004,31(4):395-399.
2010-12-20)
(本文编辑 杨美琴)
试题1.答案:D。基质性角膜炎病程中会引起角膜混浊、变薄、瘢痕、出血等,但不会引起角膜中央基质层水肿。
试题2.答案:A。见于经静脉吸毒者的血管内,会引起结晶样视网膜病变。
试题3.答案:D。JCA按照起病和前6个月累及的关节范围可分为3种类型:少数关节起病的JCA;多数关节起病的JCA;全身症状起病的JCA。见《临床眼科学》(Jack J.Kanski著,第4版,徐国兴译)第272页。
Distributionofglucocorticoidreceptorincochleaofguineapigsandtheeffectsofacoustictraumaonitsexpression
WANGBin,HANZhao,CHIFang-lu,TIANJie*.DepartmentofOtorhinolaryngology,EyeEarNoseandThroatHospital,FudanUniversity,Shanghai200031,China
Corresponding author:CHI fang-lu,Email:chifanglu@yahoo.com.cn
ObjectiveTo explore the distribution of glucocorticoid receptor(GR) in cochlea of guinea pigs and the effects of acoustic trauma on its expression.MethodsAlbino guinea pigs were randomly divided into 2 groups:experimental group and control group.Noise exposure (white noise,115 dB SPL,3 h) was exerted in experimental group.Decapitation and cochlear separation was done 2 hours after noise exposure.Empty treatments were done in the control group.Frozen sections were prepared.Immunofluorescent technique fixing and fluorescence intensity semiquantitative analysis were detected for studying the distribution of GR in cochlea of guinea pigs and the effects due to the acoustic trauma.Results①The fundamental positive positions of GR were located in spiral ligament,stria vascularis,spiral limbus,organ of Corti and spiral ganglions.For fluorescence intensity of GR,there was no significant difference in spiral ligament,stria vascularis,spiral limbus and spiral ganglions(Pgt;0.05).However,there was significant difference between these positions and organ of Corti(Plt;0.05).② The fluorescence intensities of GR located in spiral limbus,organ of Corti and spiral ganglions were similar in noise exposure group and control group(Pgt;0.05).The fluorescence intensities of GR in spiral ligament,stria vascularis were much lower in noise exposure group (Plt;0.01).ConclusionsThe distribution of GR in cochlea of guinea pigs were located in spiral ligament,stria vascularis,spiral limbus,organ of Corti and spiral ganglions.The highest and least position were lateral wall and organ of Corti respectively.Acoustic trauma could decrease GR expression in all positions of cochlea,particularly in spiral ligament and stria vascularis.(Chin J Ophthalmol and Otorhinolaryngol,2011,11:86-89)
Glucocorticoid receptor; Cochlea; Acoustic trauma; Guinea pigs
复旦大学附属眼耳鼻喉科医院耳鼻喉科*实验中心上海 200031
迟放鲁(Email:chifanglu@yahoo.com.cn)

