弥散加权成像联合磁共振波谱分析在脑梗死中的应用研究
李 伟,龙晚生,罗学毛,陈曼琼,兰 勇,胡茂清
广东省江门市中心医院放射科(江门市,529030)
弥散加权成像(Diffusion Weighted Imaging,DWI)和磁共振波谱分析(Magnetic Resonance Spectroscopy,MRS)是评估脑梗死和IP的新技术。本研究通过对72例不同期脑梗死患者行DWI和MRS检查,探讨脑梗死DWI和MRS的特点与影响因素,及二者结合对评估脑梗死的临床价值。
1 材料与方法
1.1 临床资料
2008年1月~2011年5月临床疑是脑梗死且生命体征较平稳,结合影像学表现确诊为脑梗死患者72例,男40例,女32例,年龄43~83岁,平均(60.7±8.5)岁。其中超急性期(<6h)10例、急性期(6h~3d)16例、亚急性期(3d~14d)20例、慢性期(>14d)26例。
1.2 仪器与方法
采用Philips Achieva 1.5T双梯度超导磁共振扫描仪,梯度场强为66mT/m和33mT/m,梯度切换率为90mT/(m.s)和180mT/(m.s),SENSE 正交头部8通道鸟笼式线圈,扫描包括MRI平扫、DWI和MRS。
MRI平扫包括T1WI轴位和矢状位扫描(TR/TE=690/15ms、激励次数 2、矩阵 192 ×256),T2WI轴位扫描(TR/TE=4200/90ms、激励次数1、矩阵192×256),T2WI轴位 FLAIR扫描(TR/TE=11000/135ms、TI=1800ms、激励次数 1、矩阵 256 ×256),上述序列层数20、层厚5mm、层间距1mm、视野23cm。DWI采用单次激发平面回波序列,轴位扫描,弥散方向为 x、y、z,层数 20,层厚 5mm,层间距1mm,矩阵256 ×256,视野23cm,激励次数2,TR/TE=2000/70ms,b 值分别为 0、1000s/mm2,扫描时间0min22s。MRS为二维多体素或单体素的点解析波谱,化学位移选择饱和法进行压水压脂。TR/TE=1500/144ms,多体素兴趣区80mm×80mm,25个采集点,激励次数1,成像时间2min39s;单体素容积为20mm3,激励次数1,成像时间4min52s。
1.3 数据处理
按照Wild等[1]把病灶分为核心区、内缘区(病灶边缘内1个体素且高信号区>50%)、外缘区(病灶边缘内1个体素且高信号区<50%)、周围区(紧邻病灶的1个体素的正常区)和对侧镜像区(远离病灶的对侧正常脑组织)。
在DWI像上,分别在脑梗死核心区、内缘区、外缘区、周围区及对照侧镜像区选择3个点测量表观弥散系数(Apparent Diffusion Coefficient,ADC)值,并取平均值代表该处的ADC值。
MRS原始数据采集后在操作台进行后处理,包括水参照后处理、过滤、零充填插值、傅立叶转换、频率飘移矫正、基线矫正、相位矫正、曲线适配等步骤。在横轴面图像上取梗死病灶最大层面,测定梗死核心区、内缘区、外缘区、周围区及对侧镜像脑区的代谢物氮 -乙酰天门冬氨酸(N-acety aspartate,NAA)、肌酸(Creatine,Cr)、乳酸(Lactate,Lac)和胆碱复合物(Choline,Cho)的浓度及相互比值。
原料:(蛋糕体)水40克,玉米油 40毫升,细砂糖和低筋面粉各40克,鸡蛋4个、栗子奶油馅适量、褐色朗姆 80毫升、吉利丁 1片、板栗蓉100克、淡奶油150克(栗子蛋糕奶油抹面酱)、水20毫升、蛋1个、蛋黄1个、细砂糖70克、无盐黄油125克、板栗蓉50克
1.4 统计学处理
使用SPSS 13.5统计分析软件包,对梗死核心区、内缘区、外缘区、周围区的 ADC、Lac、NAA、Cr、Cho、NAA/Cr、Lac/Cr、Lac/NAA 值与对侧镜像区进行t检验,比较核心区、内缘区、外缘区、周围区各值的差异,以P<0.05为差异具有统计学意义。
2 结果
2.1 脑梗死常规MRI表现
10例超急性期脑梗死,T2WI、T1WI未检出一例(0%),FLAIR检出4例(40%),病灶稍高信号(图1);16例急性期脑梗死,T2WI、T1WI检出7例(43.8%),T2WI呈高信号,T1WI呈低信号,FLAIR检出13例(81.3%),病灶呈较高信号(图2);20例亚急性期患者,T2WI、T1WI全部检出,T2WI呈高信号,T1WI呈低信号,FLAIR全部检出,病灶呈高信号(图3);26例慢性期患者,T2WI、T1WI全部检出,T2WI呈高信号,T1WI呈低信号,FLAIR全部检出,16例呈高信号,8例呈等高信号(图4),2例呈等低信号(表1)。
2.2 脑梗死DWI表现
10例超急性期脑梗死在DWI上全部呈高信号(图1),核心区的ADC值明显低于对侧镜像区(P<0.05);16例急性期脑梗死在DWI上,有14例呈高信号(图2),2例呈等高信号,梗死核心区的ADC值明显低于对侧镜像区(P<0.05);20例亚急性期脑梗死在DWI上,有15例表现为高信号(图3),5例表现为稍高信号,梗死核心区的ADC值明显低于对侧镜像区(P<0.05);26例慢性期梗死在DWI上,10例呈高信号,10例呈等高信号(图4),6例呈等低信号,梗死核心区的ADC值明显低于对侧镜像区(P<0.05)。ADC值按核心区、内缘区、外缘区、周围区逐渐增高,核心区最低,周围区最大,与对侧镜像区无统计学差异(P>0.05);超急性期、急性期、亚急性期和慢性期梗死区的ADC值经历了一个先下降、再升高、直至恢复正常的过程(表2)。各期梗死核心区的ADC值与周围区有统计学差异(P<0.05),与内缘区则无明显差异(P>0.05);内缘区与周围区在超急性期和急性期有统计学差异(P<0.05),在亚急性期和慢性期无统计学差异(P >0.05)(表3)。
2.3 脑梗死MRS表现
72例脑梗死有69例检测到了明显升高的Lac峰,表现为病变侧1.33ppm处的特征性倒置双峰。超急性期、急性期、亚急性期和慢性期梗死区的Lac先升高、再下降的过程,NAA先下降、再升高的过程,Cr基本上没有什么变化,Cho有一定的上升,但不明显;梗死核心区的Lac/Cr值和Lac/NAA值明显高于对侧镜像区,但NAA/Cr值明显低于对侧镜像区(P<0.05)。Lac、Lac/Cr、Lac/NAA 值按核心区、内缘区、外缘区、周围区逐渐下降,即核心区最大,周围区最小,与对侧镜像区无统计学差异(P>0.05);NAA、NAA/Cr值按核心区、内缘区、外缘区、周围区逐渐上升,即核心区最小,周围区最大,与对侧镜像区无统计学差异(P>0.05)(表4)。各期梗死核心区的Lac/Cr、NAA/Cr、Lac/NAA值与周围区有统计学差异(P<0.05),与内缘区则无统计学差异(P>0.05);外缘区与周围区在急性期的Lac/Cr、NAA/Cr、Lac/NAA值和在超急性期的Lac/NAA值有统计学差异(P<0.05),其他无统计学差异(P>0.05)(表5)。
图1为发病3小时32岁男性超急性脑梗死患者,T2WI、T1WI、FLAIR 未发现病灶,DWI显示左侧脑干梗死灶,梗死区的ADC值明显低于右侧对应正常位置;MRS图中NAA下降,1.33ppm处出现倒置的Lac双峰,Cho略上升。图2为发病48小时50岁男性急性脑梗死患者,T2WI、T1WI未显示病灶,FLAIR、DWI显示右侧基底节区脑梗死灶,DWI比FLAIR显示的范围大,梗死灶的ADC值明显低于左侧对应位置;MRS图中NAA显著下降,1.33ppm处出现倒置巨大的Lac双峰,Cho略下降,Cr无变化。图3为发病8天,88岁女性亚急性脑梗死患者,显示右侧放射冠梗死灶,FLAIR和DWI比T2WI、T1WI显示的范围大且清晰,梗死灶的ADC值明显低于左侧对应位置;MRS图中NAA显著下降,1.33ppm处出现倒置的Lac双峰,Cho略上升,Cr有一定程度的下降。图4为发病21天,60岁男性慢性期脑梗死患者,显示左侧基底节区大片梗死灶,FLAIR和DWI比T2WI、T1WI显示的范围大且清晰,梗死灶的ADC值明显低于右侧对应正常位置;MRS图中NAA下降,1.33ppm处出现倒置的Lac双峰,Cho上升显著,Cr有一定程度上升。
3 讨论
3.1 影响DWI、MRS质量的因素
DWI的影响因素主要有①b值,越高,DWI权重越大,但图像信噪比降低;②扩散系数,DWI信号除受水分子扩散的影响外,还受运动、呼吸、灌注等生理因素的影响,因此采用ADC来描述活体的扩散状况,即ADC值增加,DWI信号降低;③T2穿透效应,它可造成扩散受限的假阳性,因此消除T2穿透效应是十分必要的;④各向异性,在一定程度上也可影响DWI信号。此外,梯度保真性、系统稳定性、磁场均匀度、线圈均匀性与磁敏感差别等均会影响DWI成像效果。
MRS的影响因素主要有①磁场均匀性,在行MRS前需对兴趣区做匀场;②压水压脂性能,可避免水信号掩盖及扭曲代谢物的微弱信号;③体素位置和大小,位置应尽量避免脂肪、脑脊液、骨组织、大血管及颅内含气的窦道等,大小依据病灶范围;④TE与TR,长TR允许更多纵向弛豫,使更多磁化分量恢复到平衡位置,长TE侧重T2较长的物质,短TE侧重T2较短的物质;⑤异物,会对磁场的均匀性造成很大的影响,从而造成假像谱线;⑥病人移动,极易造成波谱的不真实性;⑦组织代谢物浓度,必须达到一定的浓度,才有足够的信号强度加以分析;⑧波谱采集链,直接决定着整体采集时间的长短和体素的大小。

图1 超急性脑梗死Fig.1 Hyperacute cerebral infarction
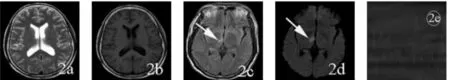
图2 急性脑梗死Fig.2 Acute cerebral infarction

图3 亚急性脑梗死Fig.3 Subacute cerebral infarction
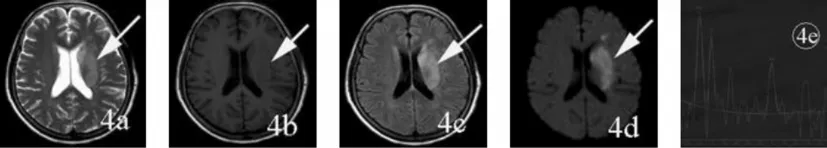
图4 慢性期脑梗死Fig.4 Chronic cerebral infarction

表1 不同方法对各期脑梗死检出情况(例)Tab.1 The detection of different methods in cerebral infarction(cases)

表2 不同期脑梗死各区域ADC值比较Tab.2 The ADC values compared in different region of cerebral infarction at different period
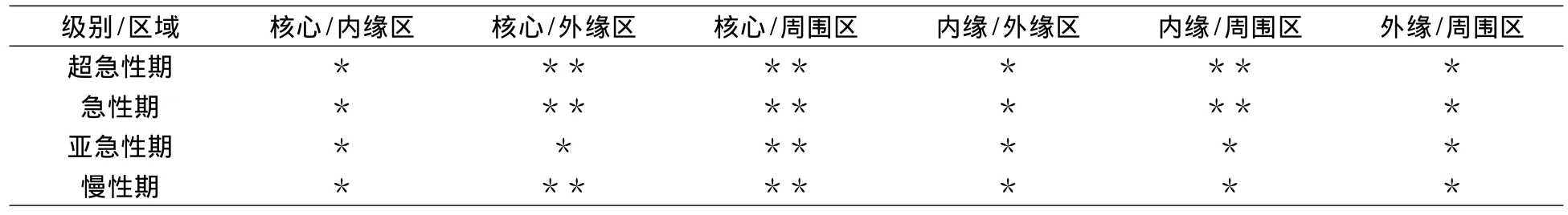
表3 不同区域ADC值两两比较Tab.3 The ADC values compared between every two regions
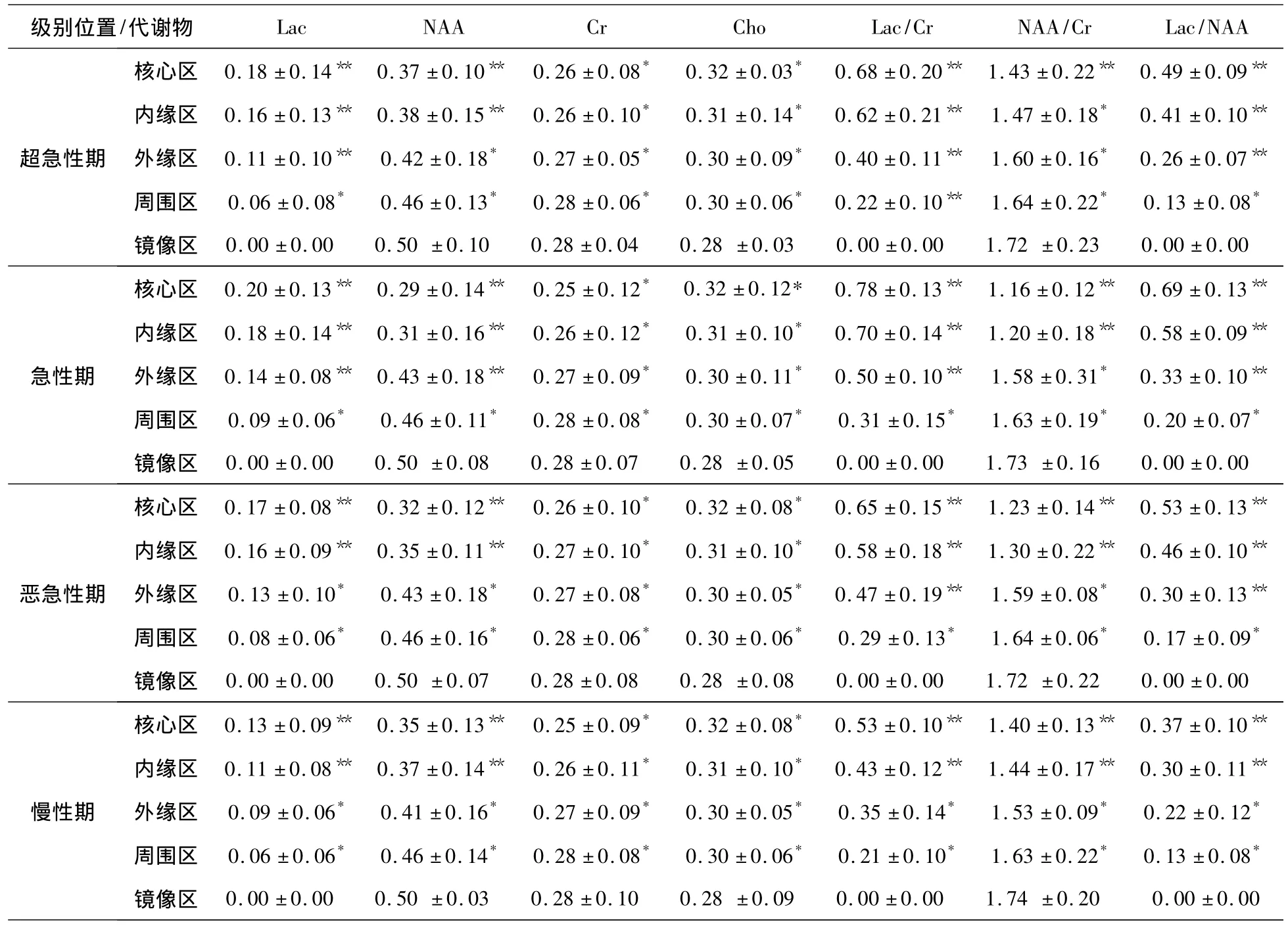
表4 不同期脑梗死各区域代谢物含量比较Tab.4 The metabolite content compared in different region of cerebral infarction at different period
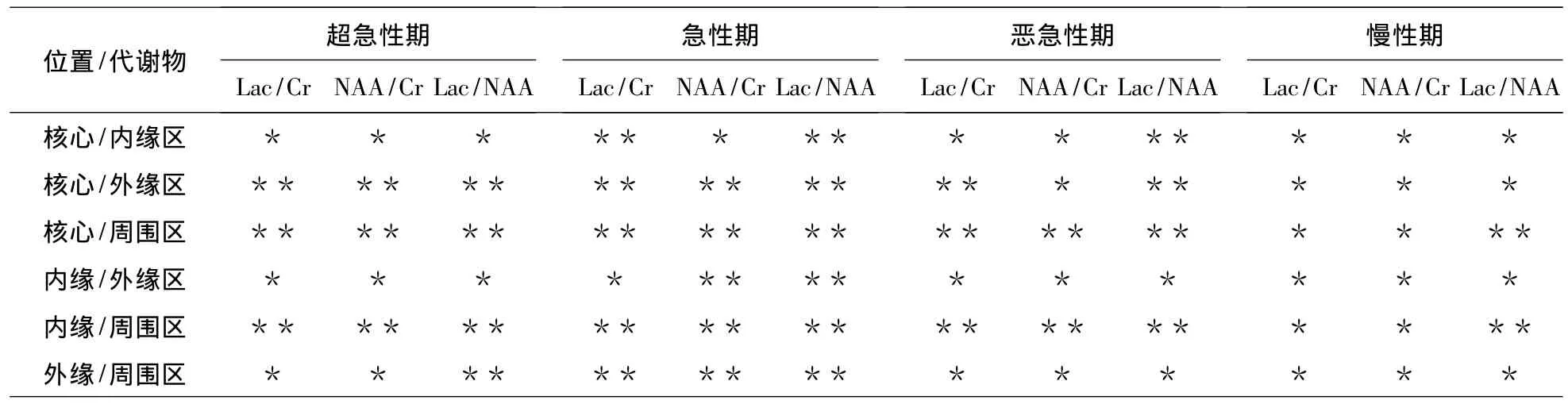
表5 不同区域代谢物两两比较Tab.5 The metabolite content compared between every two regions
3.2 DWI在不同期脑梗死中的价值
DWI可明确超急性期和急性期脑梗死的脑缺血改变,对脑梗死的早期诊断具有十分重要的意义。b值越高,产生的弥散梯度场越强,造成信号下降越大,病灶显示越清晰。ADC值可代表水分子在组织内的弥散能力,水分子的弥散运动越强,ADC值越大[2]。
超急性期脑梗死首先表现为线粒体出现有氧代谢障碍,细胞内Na+和Ca2+含量增加,成高渗透状态,产生细胞毒性水肿,组织内水含量及T2时间没有明显变化,所以T1WI、T2WI无明显异常改变,但梗死区内水分子扩散强度下降,导致ADC值降低,在DWI上呈现高信号[3]。本组10例超急性期脑梗死,常规 T1WI、T2WI未检出1例,FLAIR检出4例,DWI全部检出,且病灶显示范围更大更清晰,梗死核心区的ADC明显低于对侧镜像区(P<0.05)。
急性期脑梗死出现血管内皮细胞损伤,血脑屏障破坏,开始形成血管源性脑水肿,梗死区组织水含量增加,T2弛豫时间逐步延长,此时T1WI、T2WI有可能显示缺血的脑组织,水分子的扩散发生不同的变化,表现在ADC值较超急性期有所上升。本组16例急性期脑梗死,T2WI、T1WI检出7例,FLAIR检出13例,DWI全部检出,病灶呈高信号,且病灶显示范围更大更清晰,梗死核心区的ADC值明显低于对侧镜像区(P<0.05)。
亚急性期脑梗死表现为血管内皮细胞损伤,血脑屏障破坏,血管源性脑水肿逐步加大,梗死区组织水含量进一步增加,T2时间足够长,T1WI、T2WI可显示缺血的脑组织,ADC值较急性期有进一步上升。本组20例亚急性期脑梗死,T2WI、T1WI全部检出,FLAIR全部检出,DWI全部检出,梗死核心区的ADC值明显低于对侧镜像区(P<0.05)。
慢性期脑梗死逐渐坏死融解、囊变液化,限制扩散的障碍物进一步降解,水分子在相同时间内有更大的扩散空间,ADC值持续增加,逐步接近正常值,在DWI上以高信号和等高信号为主。本组26例慢性期脑梗死,T2WI、T1WI全部检出,FLAIR全部检出,DWI全部检出,梗死核心区的ADC值明显低于对侧镜像区(P<0.05)。
同期脑梗死的ADC值按核心区、内缘区、外缘区、周围区逐渐上升;超急性期、急性期、亚急性期和慢性期梗死区的ADC值经历了一个先下降、再升高、直至恢复正常的过程;梗死核心区的ADC值与周围区有统计学差异(P<0.05),与内缘区无统计学差异(P>0.05);内缘区与周围区在超急性期和急性期有统计学差异(P<0.05),在亚急性期和慢性期无统计学差异(P>0.05),表明IP存在于内缘区、外缘区和周围区的交叉地带。
3.3 MRS在不同期脑梗死中的价值
MRS是利用核磁共振J-耦合现象和化学位移作用,检测组织内的一些化合物含量和代谢物浓度,从而反应组织细胞的代谢状况。脑的代谢物主要有位于1.33ppm处的Lac峰,只有局部脑血流量低于一定值时,才能测到 Lac峰;位于 2.02ppm处的NAA峰,是神经元特有的内标记物,其浓度下降说明有神经元的死亡;位于3.02ppm处的Cr峰,参与体内能量代谢,总水平较稳定,可作为内标准;位于3.2ppm处的Cho峰,参与细胞膜的合成与降解,被认为是髓鞘崩解的标志物,其浓度增高与细胞膜转化率和细胞的稠密程度有关。
靳令经等[4]认为脑梗死MRS的特征性变化是早期出现Lac峰,升高程度反应脑缺血的严重程度,且脑梗死核心区 NAA水平明显降低,Cho和Cr变化不明显或轻度下降;白旭等[5]认为Lac与NAA的综合分析对于区别梗死区的IP有重要的价值,Lac升高但 NAA变化不明显的区域为 IP,而Lac升高同时NAA明显下降的区域为不可逆损伤区。
梗死核心区的NAA/Cr在超急性期有明显降低,且随缺血时间的延长呈进行性下降,在急性期降到最低点,随后在亚急性期、慢性期逐步恢复;Lac/Cr、Lac/NAA在超急性期内显著升高,标志着脑供血严重不足,无氧糖酵解发生,在急性期内达到峰值,然后在亚急性期、慢性期内逐步下降,这可能与梗死区细胞的死亡、缺血梗死区的再灌注和Lac从病灶中扩散有关[6]。
内缘区的NAA/Cr、Lac/Cr和Lac/NAA的变化与梗死核心区相同,各期间组均无统计学差异(P>0.05),表明该区域也是不可逆的梗死组织,但是在急性期内,内缘区NAA/Cr下降程度较梗死核心区稍轻,Lac/Cr、Lac/NAA在急性期的中期才达到峰值,笔者认为此兴趣区在一定时期内可能存在梗死组织与IP相混杂的交界带,由内向外的组织缺血缺氧有减轻的趋势。
外缘区的NAA/Cr在超急性期和急性期的早期与对侧镜像区之间有统计学差异(P<0.05),下降较明显;Lac/Cr、Lac/NAA升高,且与梗死核心区和内缘区存在统计学差异(P<0.05),提示在急性期早期,外缘区的细胞能量能够维持离子泵功能基本正常,结构完整,但存在无氧代谢,反映该区域在此期间可能是IP。
周围区的 NAA/Cr、Lac/Cr、Lac/NAA 与对侧镜像区之间均无统计学差异(P>0.05);虽在超急性期、急性期的Lac/Cr、Lac/NAA有升高,但在亚急性期、慢性期就逐步下降,该区域为相对正常的脑组织。
笔者认为Lac升高和 NAA下降是超急性脑梗死核心区最主要的表现,Lac结合NAA对于区别梗死区与缺血半暗带有重要的价值,即 Lac升高且NAA正常或轻度下降的区域可能为IP,而Lac升高且NAA明显降低的区域可能为不可逆损伤区,与Demougeot等[7]的研究一致。
急性期的Lac由核心区至周围区逐步减低,外缘区与周围区有统计学差异(P<0.05),表明Lac下降程度超过NAA,为DWI高信号区域,即外缘区存在着一定程度的无氧酵解,提示IP的存在;亚急性期和慢性期NAA变化与急性期类似,Lac在亚急性期梗死外缘区与对侧镜像区无统计学差异(P>0.05),说明外缘区脑组织已不存在明显的缺氧。慢性期各部位间Lac无统计学差异(P>0.05),但外缘区Lac略低于内缘区域,整体呈交错排列,同期病灶边缘的Cho均接近于正常组织,提示病变由外向内胶质细胞增生、组织修复。
本研究表明超急性期、急性期、亚急性期和慢性期梗死区的Lac经历先升高、再下降的过程,NAA先下降、再升高的过程,Cr基本上无变化,Cho有一定的下降,但不明显。Lac、Lac/Cr、Lac/NAA 值按梗死核心区、内缘区、外缘区、周围区逐渐下降,周围区与对侧镜像区无统计学差异(P>0.05);NAA、NAA/Cr值按梗死核心区、内缘区、外缘区、周围区逐渐上升,周围区与对侧镜像区无统计学差异(P>0.05);外缘区与周围区在急性期的Lac/Cr、NAA/Cr、Lac/NAA值和在超急性期的Lac/NAA值有统计学差异(P<0.05),其它无统计学差异(P>0.05),说明IP存在于外缘区和周围区的交叉地带。
4 结论
总之,DWI是诊断超急性期脑梗死的重要方法,可在有效的再灌注时间窗内清晰显示梗死灶,MRS能反映缺血脑组织的代谢物的变化情况,二者结合能够更加全面地评估IP和更精确地对脑梗死进行临床分期和定位,能够为临床溶栓治疗确定时间窗及选择适当的治疗措施提供重要依据。
[1]Wild JM,Wardlaw JM,MarshallI,et al.N -acetylaspartate distribution in proton spectroscopic images of ischemic stroke:relationship to infarct appearance on T2 weighted magnetic resonance imaging[J].Stroke,2000,31(12):3008-3014.
[2]Tong ZY,Toshiaki Y,Wang YJ.Proton magnetic resonance spectroscopy of normal human brain and glioma:a quantitive in vivo study[J].Chin Med J,2005,118(15):1251-1257
[3]Beauchamp NJ,Barker PB,W ang PY,et al.Imaging of acute cerebral ischemia[J].Radiology,1999,212(2):307-324.
[4]靳令经,杨振燕,陈斐,等.急性期脑梗死的磁共振化学位移成像研究[J].中华神经科杂志,2004,37(4):296-299.
[5]白旭,张云亭.急性脑梗死的1H-MRS[J].临床放射学杂志,2005,24(1):7 -11.
[6]Graham GD,Hwang JH,Rothman DL,et al.Spectroscopic assessment of alterations in macro molecule and small molecule metabolites in human brain after stroke[J].Stroke,2001,32(12):2797 -2802.
[7]Demougeot C,Walker P,Beley A,et al.Spectroscopic data following stroke reveal tissue abnormality beyond the region of T2 weighted hyper intensity[J].J Neurol Sci,2002,199(1):73 -77.