花状氧化锌纳米晶的制备及其电化学传感研究
贾向东 陆 峰 刘 燕 朱俊杰*,
(1南京大学化学化工学院,生命分析化学教育部重点实验室,南京 210093)
(2南京林业大学化学与材料科学系,南京 210037)
花状氧化锌纳米晶的制备及其电化学传感研究
贾向东1,2陆 峰1刘 燕1朱俊杰*,1
(1南京大学化学化工学院,生命分析化学教育部重点实验室,南京 210093)
(2南京林业大学化学与材料科学系,南京 210037)
本文以丙三醇为反应溶剂,在氢氧化钾体系中制备了两种花状氧化锌纳米晶,讨论了不同实验条件对氧化锌纳米晶形成影响,通过改变氢氧化钾浓度、反应温度和体系中水含量等条件来调节材料形貌,探讨了花状氧化锌纳米晶可能的形成过程。用X射线粉末衍射、扫描电子显微镜、紫外可见光谱等分析技术对制备的氧化锌纳米晶进行了表征。结果表明两种花状纳米晶均具有六方纤锌矿结构。进一步地,将血红蛋白与花状氧化锌纳米晶混合修饰到电极上构建了新型生物传感器,该传感器能实现血红蛋白的直接电子传递,对过氧化氢具有良好的响应,在1×10-6~1.2×10-4mol·L-1浓度范围内呈线性关系。
花状氧化锌;纳米材料;直接电化学;生物传感
0 引 言
宽禁带和高激子束缚能是氧化锌应用的基础,而氧化锌纳米晶的上述特性与体材料不同,原因在于纳米晶拥有高比例的表面原子,这些键级缺失的高能量的表面原子是纳米晶奇特性质的结构基础。尽管氧化锌纳米晶的制备方法很多[1-2],但液相化学合成方法以其低成本、反应条件温和、修饰方法简便等诸多优点成为研究者的优先选择。通过采用不同的前驱体、溶剂、pH可以合成不同形貌的氧化锌纳米晶[3]。合成分散性能良好的不同结构的氧化锌纳米晶及其相关性质的研究,将有助于氧化锌纳米材料的进一步应用[4]。
氧化锌纳米材料液相合成大致分为水相、有机相和混合溶剂体系。水相体系的合成常需要加入表面配体作为分散剂,不同的配体由于其结合的优势晶面不同使得制备的氧化锌具有不同的形貌。常用的配体有油酸[5]、柠檬酸或草酸[6-7],表面活性剂如烷基苯磺酸[8]等。但由于氧化锌纳米材料在水相体系的分散能力较差,得到的粒子多为单晶的组装体。有机相体系通常为醇类[3,9-15]、二甲亚砜[16]或它们与水的混合物,有些体系也需要加入表面配体如三乙醇胺[3]、多乙烯多胺[10]以改进分散性。因此,如何控制生长晶向、结晶速度对合成不同结构的氧化锌纳米晶是非常重要的。
基于氧化还原蛋白或酶的直接电子传递所构建的生物电化学传感器一直以来吸引了科学工作者的广泛关注,因为这类传感器能够很好地克服过高的实际应用电位的缺陷以及避免各种干扰反应的存在[17-18]。然而,氧化还原蛋白或酶与基底电极之间的直接电子传递往往是相当困难的,一是因为多数蛋白质分子的电化学活性中心深藏在分子内部,分子和电极之间的直接电子转移往往比较困难,二是直接吸附在电极表面的生物分子其空间排布方式不利于电子传导[19-20]。为此,相当多的研究致力于改善氧化还原蛋白或酶的电活性中心与基底电极之间的电子传输效率。其中,将电子传递体植入蛋白结构是一种非常有效的手段,能够提供快速的电子传递速率[21-22]。但是,这种方法程序过于复杂,难免限制其在传感器构建中的广泛及实际应用。目前的研究表明,选择特殊的电极材料固载氧化还原蛋白能够促进蛋白质分子在电极上实现直接电子转移,如类生物膜薄层[23]、聚合物膜[24]、中孔性二氧化硅[25]、碳纳米管[26]、无机粘土[27]、半导体纳米颗粒[28-29]等用以改善氧化还原蛋白或酶的异源性电子传递。
本文以丙三醇为溶剂体系,制备了两种花状氧化锌纳米晶,并讨论了不同实验条件对氧化锌纳米晶形成的影响,分析了花状氧化锌纳米晶可能的形成过程。进一步地,将血红蛋白与花状氧化锌纳米晶混合修饰到电极上构建了新型生物传感器,该传感器实现了血红蛋白的直接电子传递,对过氧化氢具有良好的响应。
1 实验部分
1.1 实验试剂
氯化锌(ZnCl2),上海实意化学试剂有限公司;氢氧化钾(KOH)、丙三醇((HOCH2CH(OH)CH2OH),西陇化工股份有限公司;过氧化氢水溶液(H2O2,30wt%),上海试剂公司;磷酸二氢钠(NaH2PO4·12H2O),磷酸氢二钠(Na2HPO4·2H2O),南京化学试剂有限公司;血红蛋白(Hb),Sigma公司。以上纯试剂均为分析纯,使用之前没有经过再处理。
电化学实验是在CHI 760C(上海辰华公司)上完成的,反应使用三电极系统,实验中玻碳电极作为工作电极,饱和甘汞电极作为参比电极,铂丝电极作为对电极。电解液在实验之前通氮除氧20 min,实验过程中保持氮气氛围。
1.2 花状氧化锌纳米晶的合成
首先制备0.4 mol·L-1的ZnCl2和不同浓度的KOH丙三醇溶液。强力搅拌30 min后将ZnCl2溶液滴加到氢氧化钾溶液中,然后以10℃·h-1的速度缓慢升温,加热至80℃后保持30 min。冷至室温后,在水泵减压下缓慢升温至100℃保持30 min以蒸出体系中的水,制得的产品为乳白色溶胶,以水将溶胶分散液稀释3倍,将底部沉淀以水洗涤至中性,再用无水乙醇洗涤3次,60℃烘干待用。将KOH浓度为0.9 mol·L-1未减压蒸馏的样品记S1,KOH浓度为1.8 mol·L-1的减压蒸馏的样品记为S2,KOH浓度为1.8 mol·L-1未减压蒸馏的样品记为S3。
1.3 花状氧化锌纳米晶的表征
紫外可见光谱在Shimadtsu UV-4350紫外光谱仪上测量;X射线粉末衍射在Shimadzu XRD-600上进行,X-射线源为Cu Kα线,波长0.15418 nm,扫描速率5°·min-1,扫描范围20°~80°;扫描电子显微镜在Hitachi S-4800上进行,加速电压为5 kV。
1.4 花状氧化锌纳米晶的电化学传感研究
1.4.1 ZnO/Hb修饰电极的制备
玻碳电极分别在1.0 μm和0.3 μm Al2O3的麂皮上抛光成镜面,并用超纯水和乙醇超声清洗,干燥待用。将花状ZnO材料(S1)用超纯水稀释至2 mg· mL-1,称取一定量的Hb溶于0.1 mol·L-1的PBS (pH=7.0)制备成浓度为2 mg·mL-1的溶液,保存在4℃冰箱中备用。将上述ZnO悬浮液和Hb溶液等体积混合,充分搅拌后于37℃振荡2 h,取出后放入冰箱静置过夜。将上述混合液10 μL滴至已抛光的玻碳电极表面,得到ZnO/Hb修饰的玻碳电极,室温干燥。然后在修饰的电极表面滴加10 μL(0.5%)的Nafion溶液,待完全干燥后用超纯水冲洗并用于电化学传感研究。1.4.2 ZnO/Hb/GCE修饰电极的循环伏安实验
在氮气保护的0.1 mol·L-1PBS(pH=7.0)溶液中分别以ZnO/Hb/Nafion/GCE和 ZnO/Nafion/GCE作为工作电极进行循环伏安扫描。在ZnO/Hb/Nafion/ GCE作为工作电极的体系中加入 20、40、60、80、100、120和140 μmol·L-1过氧化氢,并进行循环伏安扫描,扫描速率100 mV·s-1。
2 结果与讨论
2.1 花状氧化锌纳米晶的XRD分析

图1 ZnO纳米晶的XRD图Fig.1 XRD patterns of ZnO nanocrystals
制得的3种ZnO样品用X射线粉末衍射仪进行了表征,如图1所示。结果表明S1和S2均属于六方晶系纤锌矿结构,与标准卡片(PDF No.79-2205)相吻合。这些纳米晶有较宽的衍射峰,通过徳拜-谢勒公式对S1和S2样品的(101)峰进行计算,它们的晶粒大小约为20 nm,说明这些纳米晶都是由较小的初级纳米颗粒组成的。S3的XRD图显示产物有氧化锌,但还有许多类似氢氧化锌的吸收峰,说明样品中不纯,含有较多的杂质。
2.2 氧化锌纳米晶的紫外光谱分析
样品S1的紫外吸收光谱,与文献[30]脉冲激光烧蚀法获得的氧化锌类似。制备的氧化锌溶胶在210 nm左右有1个强的吸收峰,而在266与309 nm的2个弱吸收峰。由久保公式推断[31],对于某种特定的纳米材料,随着纳米材料尺寸的减小其能带宽度会增加,从而导致紫外吸收峰向低波长偏移。因此210 nm处的强吸收峰是初级氧化锌粒子表面电子的激发跃迁产生的,2个弱吸收峰为激子的共振吸收[30]。
2.3 氧化锌纳米晶的形貌分析

图2 ZnO纳米晶的扫描电镜图Fig.2 SEM images of ZnO nanocrystals
图2为氧化锌纳米晶S1和S2的SEM照片。从图2A,B可以看出S1样品是直径约2 μm花状聚集体结构,它是由花瓣状的单元组成的紧密堆积体,而这些花瓣状单元又是由更小的颗粒组成,这些颗粒粒径大约20 nm,与XRD计算得到的结果一致。从图2C,D可以发现,样品S2样品也是直径约2.5 μm花状聚集体结构,但它是由厚度均一的纳米片层组装而成的,且这些片层又由更小的颗粒构成,与XRD的结果相吻合。花状氧化锌晶体文献已有报道了[7-8,32-33],但本文报道的两种产物二次粒子小,花瓣之间或片之间结构紧密,分散性好。
2.4 机理探讨
图3为S3的SEM照片,S3为S2未减压蒸馏的样品。图3中S3无明显形貌,另外从XRD分析可以发现S3有很多类似于氢氧化锌的物质,这些物质可能是在较高碱浓度下产生的,我们通过减压蒸馏的操作使这些氢氧化锌杂质脱水从而转变为氧化锌。从图2可以发现,在较低碱浓度的情况下,得到的氧化锌是由花瓣单元组成的花状结构,而在较高碱浓度时得到氧化锌的是片状单元组成的花状结构,碱的浓度对样品的结构与形貌有影响。丙三醇作为配体能够在不同碱浓度下,限制特定晶面的生长,从而促使优势晶面的生长。另外,XRD结果表明,这两种氧化锌都是由20 nm左右的晶粒构成的,在相似的条件下氧化锌在水溶液中通常形成大尺度的棒状结构[8,15],所以这些形貌的形成可能与丙三醇的性质有关,由于丙三醇与晶粒表面的Zn2+形成螯合的六元环从而补偿了较高的表面能,另外丙三醇的高粘度阻止了晶粒的继续生长。根据这些现象我们推测氧化锌形成的机理可能是,氯化锌和氢氧化钾在丙三醇中先形成氢氧化锌,然后在加热的条件下逐渐脱水形成氧化锌的初级小尺寸纳米颗粒,这些小颗粒在不同的氢氧化钾浓度下会沿着不同的方向组装生长,从而形成花瓣状和片状两种不同的形状单元,由于没有稳定剂的存在,这些形状单元又会结合在一起形成花状簇状团聚体,从而得到了S1和S2两种不同形貌的花状氧化锌。

图3 ZnO(S3)纳米颗粒的扫描电镜图Fig.3 SEM images of ZnO nanocrystals(S3)
2.5 氧化锌纳米晶的电化学传感研究
2.5.1 ZnO/Hb/GCE修饰电极的直接电化学
由图4可见,ZnO/Nafion/GCE电极没有出现氧化还原峰,说明在所选择的电位范围内呈电化学惰性,而ZnO/Hb/Nafion/GCE电极则出现了一对较明显的氧化还原峰,表明Hb在ZnO纳米晶上的固定有利于Hb与电极之间的直接电子传递。
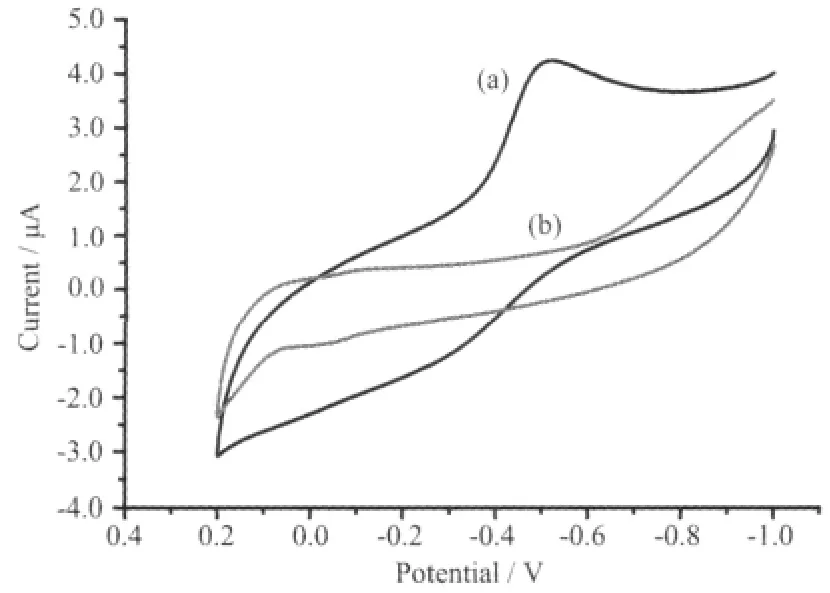
图4 ZnO(S1)修饰电极在氮气饱和的0.1 mol·L-1PBS (pH=7.0)溶液中的循环伏安图,扫描速率:100 mV·s-1Fig.4 Cyclic voltammograms with saturated N2in 0.1 mol·L-1PBS solution(pH=7.0)for ZnO modified electrodes at a scan rate of 100 mV·s-1
2.5.2 ZnO/Hb/GCE修饰电极对过氧化氢的催化

图5 ZnO/Hb/Nafion/GCE电极在氮气保护的0.1 mol· L-1PBS(pH=7.0)中分别加入20、40、60、80、100、120和140 μmol·L-1过氧化氢的循环伏安图,扫描速率:100 mV·s-1Fig.5 Cyclic voltammograms with saturated N2in 0.1 mol ·L-1PBS(pH=7)solution for ZnO/Hb/Nafion/GCE modified electrode with the concentration of H2O2 20,40,60,80,100,120 and 140 μmol·L-1, respectively,at a scan rate of 100 mV·s-1
图5为在pH 7.0的磷酸盐缓冲液中加入过氧化氢前后ZnO/Hb/Nafion/GCE修饰电极的循环伏安曲线,其还原电流随着过氧化氢的加入增大,在最佳条件下,如图6,ZnO/Hb/Nafion/GCE修饰电极对过氧化氢的响应线性范围为1~120 μmol·L-1,线性拟合方程为icat(μA)=0.09249c(μmol·L-1)+4.045,相关系数为0.991。当H2O2浓度高于120 μmol·L-1时,催化电流值几乎不变,这是典型的米氏动力学的特征。

图6 催化电流与过氧化氢浓度的关系曲线Fig.6 Relationship between current and concentration of H2O2
3 结 论
以氯化锌和氢氧化钾为原料,在丙三醇体系中合成了2种花状氧化锌纳米晶。在较低碱浓度时得到的氧化锌是由花瓣单元组成的花状结构,而在较高碱浓度时得到的氧化锌是片状单元组成的花状结构。进一步地,将血红蛋白与花状氧化锌纳米晶混合修饰到电极上构建了新型生物传感器,该传感器能实现血红蛋白的直接电子传递,对过氧化氢具有良好的响应。
[1]Przybyszewska M,Zaborski M.Przemysl Chemiczny,2009, 88:154-161
[2]DENG Chong-Hai(邓崇海),HU Han-Mei(胡寒梅),HUANG Xian-Huai(黄显怀).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(3):469-473
[3]Fu Y S,Du X W,Sun J,et al.J.Alloys Compd.,2008,461: 527-531
[4]Wang G,Chen D,Zhang H,et al.J.Phys.Chem.C,2008, 112:8850-8855
[5]Li M G,Bala H,Lv X T,et al.Mater.Lett.,2007,61:690-693
[6]Akhtar M S,Khan M A,Jeon M S,et al.Electrochim.Acta, 2008,53:7869-7874
[7]Wu C L,Qiao X L,Chen J G,et al.Mater.Chem.Phys., 2007,102:7-12
[8]Xie J,Li P,Li Y T,et al.Mater.Chem.Phys.,2009,114: 943-947
[9]Singla M L,Shafeeq M M,Kumar M.J.Lumin.,2009,129: 434-438
[10]Krishnan B,Irimpan L,Nampoor V P N,et al.Physica E, 2008,40:2787-2790
[11]Rani S,Suri P,Shishodia P K,et al.Sol.Energy Mater.Sol. Cells,2008,92:1639-1645
[12]Uekawa N,Iahii S,Kojima T,et al.Mater.Lett.,2007,61: 1729-1734
[13]Zhang H X,Feng J,Wang J,et al.Mater.Lett.,2007,61: 5202-5205
[14]Bitenc M,Orel Z C.Mater.Res.Bull.,2009,44:381-387
[15]Lee S,Jeong S,Kim D,et al.Superlattices Microstruct., 2008,43:330-339
[16]He S,Maeda H,Uehara M,et al.Mater.Lett.,2007,61:626-628
[17]Gorton L,Lindgren A,Larsson T,et al.Anal.Chim.Acta, 1999,400:91-108
[18]Ghindilis A L,Atanasov P,Wilkins E.Electroanalysis,1997, 9:661-674
[19]Heller A.Acc.Chem.Res.,1990,23:128-134
[20]Armstrong F A,Hill H A O,Walton N J.Acc.Chem.Res., 1988,21:407-413
[21]WillnerI,KatzE.Angew.Chem.Int.Ed.,2000,39:1180-1218
[22]Xiao Y,Patolsky F,Katz E,et al.Science,2003,299:1877-1881
[23]Han X,Huang W,Jia J,et al.Biosens.Bioelectron.,2002, 17:741-746
[24]Lu Q,Zhou T,Hu S.Biosens.Bioelectron.,2007,22:899-904
[25]Dai Z,Liu S,Ju H,et al.Biosens.Bioelectron.,2004,19: 861-867
[26]Lu X B,Zhou J H,Lu W,et al.Biosens.Bioelectron.,2008, 23:1236-1243
[27]Mousty C.Applied Clay Sci.,2004,27:159-177
[28]Lu X B,Wen Z H,Li J H.Biomaterials,2006,27:5740-5747
[29]QIAO Ya-Fen(乔亚芬),ZHANG Jun-Song(张俊松),LU Tian-Hong(陆天虹),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2006,22:1282-1284
[30]Chen Q H,Zhang W G.J.Non-Cryst.Solids,2007,353:374-378
[31]Kubo R.Phys.Soc.Jpn.,1962,17:975-986
[32]Jitianu M,Goia D V.Materials Chemistry and Physics,2008, 112:393-397
[33]Wahab R,Ansari S G,Seo H,et al.Solid State Sciences, 2009,11:439-443
Synthesis of Flower-Like Zinc Oxide Nanocrystals and Their Electrochemical Biosensing
JIA Xiang-Dong1,2LU Feng1LIU Yan1ZHU Jun-Jie*,1
(1School of Chemistry and Chemical Engineering,Key Lab of Analytical Chemistry for Life Science(MOE),Nanjing University,Nanjing210093,China)
(2Department of Chemistry and Material Science,Nanjing Forestry University,Nanjing210037,China)
Flower-like zinc oxide nanocrystals were synthesized by mixing KOH and ZnCl2in glycerol solution.The experimental parameters that affected the formation of the nanocrystals were selected,and possible mechanism was discussed.The obtained products were characterized with XRD,SEM techniques and UV-Vis spectroscopy.The results indicated that the flower-like nanocrystals were hexagonal wurtzite structure.In addition,the direct electron transfer between hemoglobin(Hb)and the electrode was realized by immobilizing the protein onto the ZnO nanocrystals.The results showed that the as-fabricated biosensor had a good linear amperometric response to H2O2in the concentration range from 1×10-6to 1.2×10-4mol·L-1.
flower-like zinc oxide;nanomaterials;direct electrochemistry;biosensing
O614.24+1;O613.3;O657.1
A
1001-4861(2011)06-1150-05
2011-04-08。收修改稿日期:2011-04-23。
国家自然科学基金(No.50972058)资助项目。
*通讯联系人。E-mail:jjzhu@nju.edu.cn

