运动、IGF-I诱导骨骼肌适应性肥大的机理研究
朱 晗,赵 华,曾凡星
(1.北京体育大学运动人体科学学院,北京 100084;2.天水师范学院体育学院,甘肃天水 741001)
运动、IGF-I诱导骨骼肌适应性肥大的机理研究
朱 晗1,赵 华2,曾凡星1
(1.北京体育大学运动人体科学学院,北京 100084;2.天水师范学院体育学院,甘肃天水 741001)
目的:采用注射外源性IGF-I和一周跑台运动,观察对大鼠骨骼肌mTOR信号通路的影响,深入探讨IGF-I对运动骨骼肌适应性肥大的机理。方法:8周龄雄性SD大鼠在适应性训练后分为四组:安静组(S)、安静IGF-I组(SI)、运动组(E)、运动+IGF-I组(EI)。运动方式为跑台运动(20m/min,10%,60min/d),每天一次,共7天。外源性IGF-I为小腿后侧肌肉隆起处的皮下注射。用Western Blotting法检测腓肠肌MHC、PI3K、AKt、mTOR、p70S6K蛋白和Akt(Ser473)、mTOR(Ser2448)和p70S6K(Thr389)的磷酸化表达。结果:在一周后,外源性IGF-I显著促进骨骼肌MHC的表达,骨骼肌PI3K、Akt、mTOR蛋白和Akt(Ser473)、mTOR(Ser2448)和p70S6K(Thr389)的磷酸化表达显著增强。运动显著促进mTOR蛋白和Akt(Ser473)、mTOR(Ser2448)和p70S6K(Thr389)磷酸化的表达。对运动的反应,上述信号的磷酸化表达高于蛋白表达。结论:1)一周外源性IGF-I注射明显促进运动骨骼肌mTOR通路的活性;而1周跑台运动与IGF-I具有协同增强效应。2)在运动和注射外源性IGF-I的刺激下,mTOR通路各信号分子的磷酸化表达比蛋白表达更为敏感。建议今后对信号的研究以检测信号分子的磷酸化表达为主。
IGF-I;mTOR通路;骨骼肌肥大;运动
研究证实,磷脂酰肌醇-3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号是骨骼肌蛋白质合成的最主要信号转导通路[1],近年已成为骨骼肌生理学的研究热点之一。目前在体运动的情况下,利用增强骨骼肌中IGF-I来对肌肉内mTOR通路整个上下游信号进行的研究尚不多见,本文应用注射外源性IGF-I结合运动深入观察mTOR信号通路变化特点,希望能较深入阐明IGF-I诱导骨骼肌肥大的机理。
1 材料与方法
1.1 研究对象与分组
健康雄性、SPF级8周龄SD大鼠,体重(177.8±5.4)g,由北京维通利华实验动物技术有限公司提供。国家标准啮齿类动物饲料,分笼饲养,4只/笼。自由饮食,温度维持在22℃~24℃,相对湿度50%~65%。昼夜节律人工控制光照(光照时间为8:00-20:00)。大鼠经适应性训练后,随机分为四组:安静组(S)、安静IGF-I注射组(SI)、1周跑台运动组(E)、运动+IGF-I注射组(EI),每组6只。实验前各组体重无显著差异。
1.2 动物运动方案
正式运动训练前,大鼠在跑台上进行4天的适应性训练,然后休息3天。适应性训练方案见表1。

表1 动物适应性训练方案
正式实验研究共7天,安静组给予常规饲养,运动组大鼠进行7天运动,运动方案为上坡跑(坡度为10%)、速度20m/min,每天训练60min。(根据Bedford经验公式,相当于75%VO2max)[2]。
1.3 IGF-I注射方案
在大鼠小腿后面肌腹隆起处进行皮下注射IGF-I。每次运动后即刻,安静注射组和运动注射组在大鼠小腿后肌腹隆起处的皮下注射IGF-I。安静和运动组分别注射同等剂量的生理盐水。具体剂量安排如表2。
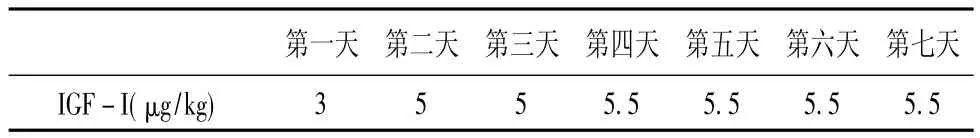
表2 IGF-I注射剂量安排表
1.4 测试样本采集与处理
取材前禁水禁食12h,以0.3ml/100g为剂量,腹腔注射10%水合氯醛麻醉。麻醉后速取后肢腓肠肌。剔除肌腱及筋膜组织,用干净滤纸将其吸干,用锡纸将其包裹后迅速投入液氮,于-80℃冰箱保存待测。
1.5 指标测试方法
蛋白浓度测试(Bradford)配制Bradford工作液:按照《精编分子生物学实验指南》配制[3]。采用Western Blot方法分别测试MHC、PI3K、Akt、mTOR、p70S6K蛋白和Akt(Ser473)、mTOR(Ser2448)、p70S6K(Thr389)磷酸化表达。
Tris-甘氨酸电泳缓冲液、上样缓冲液、电转液、堆积胶和分离胶的配制均参照《Current protocols in protein science》实验方法[4],TBS、TBST、封闭液按照Cell Signaling抗体说明书的要求配制。
取100μg总蛋白配制成上样体系,置95℃沸水中5min,再于4℃中冷却,上样前以3000rpm离心5min。配制分离胶6%(MHC、mTOR)、8%(PI3K、p70S6K)和10%(Akt、β-actin),以及5%浓缩胶。浓缩胶用80V恒压,分离胶换120V恒压电泳。再用半干转将蛋白转到NC膜上,以恒压20V半干转。封闭90min后用加入一抗,不同抗体稀释比例分别为β-actin(购自Santa Cruz公司)为1∶500,Fast Myosin Skeletal Heavy chain antibody[MY-32](Abcam公司)为1∶2000,PI3K抗体(Cell Signaling公司)为1∶1200,Akt抗体(Cell Signaling公司)为1∶1500,Phospho-Akt(Ser473)(Cell Signaling公司)为1∶800,mTOR(Cell Signaling公司)为1∶1000,Phospho-mTOR(Ser2448)(Cell Signaling公司)为1∶800,p70S6K抗体(购自Cell Signaling公司)为1∶1000,Phosphop70S6K(Thr389)(Cell Signaling公司)为1∶1200,然后4℃孵育过夜。次日晨在用TBST洗膜后用不同浓度二抗室温孵育60min。用ECL发光试剂与膜在暗室中反应、曝光。曝光底片用凝胶成像系统的透光进行拍照,用Quantity One图像分析系统分析。将每个条带与相应样品的β-actin条带光密度值进行比较,计算出目的条带的相对含量值。
1.6 数理统计法
运用SPSS 13.0软件对实验检测结果进行实验数据处理。组间比较采用双因素方差分析(UNIANOVA)和单因素方差分析(One-Way ANOVA)。对实验观测点的组间多重比较(Post Hoc)采用LSD或Tamhane’s T2方法分析。P<0.05表示具有显著性差异,P<0.01表示具有非常显著性差异。
2 结果
图1和表3显示:1周外源性IGF-I注射显著促进了骨骼肌MHC表达(F=18.455,P<0.01),1周跑台运动具有促进的趋势(F=0.627,P>0.05)。外源性IGF-I显著促进骨骼肌 PI3K蛋白(F=10.679,P<0.01)、Akt蛋白(F= 31.837,P<0.01)、mTOR蛋白(F=20.114,P<0.01)和Akt (Ser473)(F=6.978,P<0.05)、mTOR(Ser 2448)(F= 11.307,P<0.01)和p70S6K(Thr 389)(F=19.696,P<0.01)的磷酸化表达。运动显著促进mTOR蛋白(F=5.433,P<0.05)和 Akt(Ser473)(F=19.092,P<0.01)、mTOR (Ser2448)(F=23.942,P<0.01)和 p70S6K(Thr 389)(F= 32.541,P<0.01)磷酸化的表达。
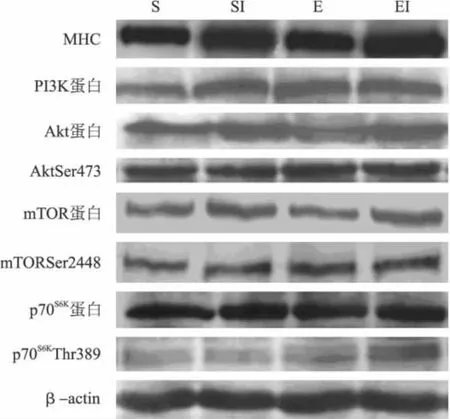
图1 IGF-I和运动干预下MHC和mTOR信号通路表达图
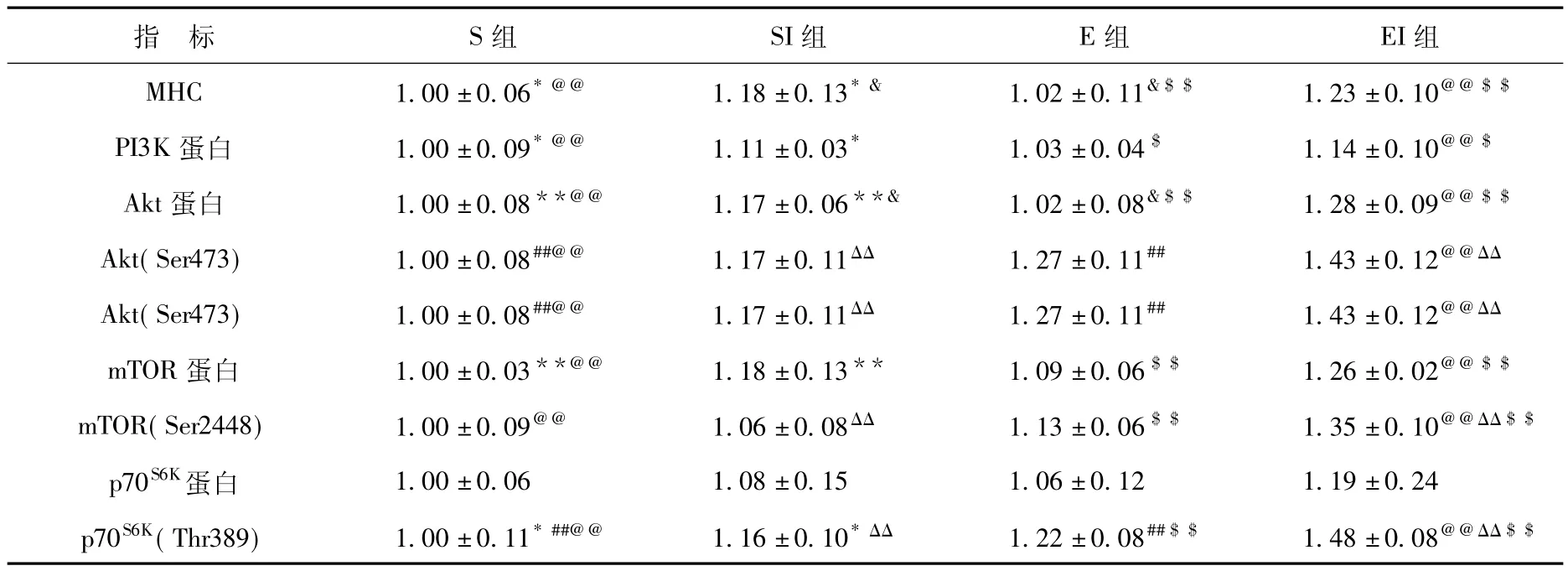
表3 IGF-I和运动干预下大鼠腓肠肌MHC和mTOR通路表达值(相对含量)
实验发现,IGF-I和运动因素间存在相互协同增强效应。具体表现为安静IGF-I注射组(SI)和运动+IGF-I注射组(EI)的MHC均显著高于安静组(S)和运动组(E)(分别为18%和15.7%、23%和20.6%)。SI和EI组的PI3K均显著高于安静组(分别为11%和14%),运动+IGF-I注射组显著高于运动组(10.7%)。SI组和EI组的Akt均显著高于S组和E组(分别为17%和15%、28%和25%)。E组和EI组的Akt(Ser473)磷酸化显著高于S组(27%和43%),EI组显著高于SI组(22.2%)。SI组和EI组的mTOR均显著高于S组(分别为18%和26%)。EI组的mTOR(Ser 2448)磷酸化显著高于S组、SI组和E组(分别为35%、27.4%和19.5%)。EI组的p70S6K(Thr 389)磷酸化显著高于S组、SI组和E组(分别为48%、27.6%和21.3%),SI组和E组显著高于S组(16%和22%)。对运动的反应:Akt蛋白和Akt (Ser473)均值分别为 1.02,1.27;mTOR蛋白和 mTOR (Ser2448)均值分别为 1.09,1.13;p70S6K蛋白和 p70S6K(Thr389)均值分别为1.06,1.22。上述指标的磷酸化表达均高于其蛋白表达。
3 讨论
多年来,对IGF-I的作用已经开展了广泛的研究,均发现IGF-I在肌肉蛋白质合成中发挥了十分重要的作用,但IGF-I诱导蛋白质合成的信号转导机制尚不清楚。以往的研究曾认为,IGF-I可能通过钙调信号起作用。Musaro等[5]对大鼠肌细胞进行L6MLC/IGF-1的培养,然后进行calcineurin质粒转染,之后用钙离子载体和环孢素A进行药物干预。研究发现IGF-I能增强骨骼肌内钙调信号通路,并激活GATA-2和NF-AT,从而促进骨骼肌肥大。而后续的众多研究显示,IGF-I只是与钙离子通道发生协同效应,在IGF-I促进骨骼肌肥大的过程中,钙调信号通路并非居于主导地位。Rommel等[6]用C2C12肌细胞培养,用IGF-I (10ng/ml)、A23187(0.1-10 μM)、LY294002(10μM)、雷帕霉素(20ng/ml)、CsA(5μM)、PD98059等药物以激活或阻断IGF-I相关的信号通路,发现在IGF-I促进骨骼肌肥大的过程中,IGF-I促进肌肉肥大主要是通过Akt所介导的信号通路来完成,并且是通过 Akt介导的 PI3K/Akt/mTOR和PI3K/Akt/GSK3通路发挥作用。
实验研究发现,一周外源性IGF-I注射显著促进骨骼肌MHC表达,而1周跑台运动有促进其表达的趋势。外源性IGF-I显著促进骨骼肌PI3K蛋白、Akt蛋白、mTOR蛋白和Akt(Ser473)、mTOR(Ser 2448)和p70S6K(Thr 389)磷酸化表达。运动显著促进mTOR蛋白和Akt(Ser473)、mTOR(Ser 2448)和p70S6K(Thr 389)(P<0.01)磷酸化的表达。外源性IGF-I和运动因素间存在协同增强效应。同时本研究还发现,在运动和注射外源性IGF-I的刺激下,各信号分子的磷酸化状态比蛋白表达表现得更为敏感。
PI3K是细胞的重要信号蛋白,在许多细胞的生存、增殖、分化、代谢过程中起着非常重要的作用[7],并且与膜泡转运、细胞骨架重组、细胞存活、肿瘤发生、抗凋亡等病理生理过程密切相关[8],同时也是IGF-I介导肌肉蛋白质合成信号转到途径中的关键环节。IGF-I在对卫星细胞池进行调节的过程中,能利用多种信号通道,如钙调磷酸酶/NFAT、促分裂蛋白激酶、磷脂酰肌醇3-激酶(PI3K)等。Coolican等人认为IGF-I激活卫星细胞产生分化是经PI3K通道的介导[9]。本研究发现,外源性的IGF-I能够刺激PI3K蛋白表达量显著性增加(增加约11%),这与其他学者的研究趋于一致。目前的研究认为,生长因子等细胞外信号刺激激活PI3K主要通过两种途径:一是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用,引起二聚体构象改变而激活;二是通过Ras蛋白和p110直接结合使其激活[10]。
Akt是PI3K的下游信号,其激活后可以通过下游的一系列底物促进细胞的生长、增殖等[11]。目前的研究发现IGFI可以诱导Akt磷酸化表达水平增加,并在IGF-I介导的骨骼肌纤维肥大中发挥了重要作用[6,12]。Lai等[13]通过基因转染使成体骨骼肌持续表达有活性的Akt,2-3周后骨骼肌体积明显增大,平均骨骼肌纤维横断面积增加超过两倍,说明IGF-I下游信号Akt的激活足以引起肌肉肥大。本研究发现,对大鼠外源性注射IGF-I可以使Akt蛋白和磷酸化均增加约17%,提示IGF-I通过PI3K信号通路对Akt产生了激活效应。其具体途径可能为:IGF-I与其受体结合活化PI3K,激活的PI3K磷酸化质膜上PIP2,产生第二信使PIP3,PIP3与细胞内含有PH结构域的信号蛋白Akt和PDK1结合,促使PDK1磷酸化Akt蛋白上Ser308位点,导致Akt的活化。Akt活化后,可抑制TSC1-TSC2,后者有抑制mTOR的功能,mTOR能促进蛋白质合成,Akt活化后抑制TSC1-TSC2,使后者对mTOR的抑制作用减弱,最终导致mTOR促进蛋白合成能力增加[14]。
mTOR对于骨骼肌的分化具有重要作用[15,16]。学者们已经通过使用雷帕霉素阻断mTOR信号的方法对mTOR的生物学效应进行了广泛的研究,发现阻断mTOR信号可以阻断运动诱导的I型和II型肌纤维肥大[1]。用雷帕霉素阻断mTOR后,可以阻断骨骼肌肥大效应的95%。研究发现,活化的Akt可以作用于mTOR的Ser2448位点,引起Ser2448位点的磷酸化。这一位点的磷酸化被认为是mTOR活性的标志,可以继而引起其下游信号表达的增加[17]。本研究发现,IGF-I在促进Akt磷酸化水平显著性提高的同时,使mTOR蛋白表达和mTOR(Ser2448)磷酸化分别增加18%和6%。
mTOR的促合成效应主要是通过对p70S6K和4EBP1活化后来实现的。p70S6K和4EBP1是mRNA翻译的关键调控子,它们是mTOR的最具特征性的靶分子,其中p70S6K被认为是骨骼肌蛋白合成的重要生物标志物之一。本研究发现,一周注射外源性的IGF-I能够刺激p70S6K(Thr389)蛋白磷酸化水平显著性增加约16%,但p70S6K蛋白表达未见显著变化。
本实验发现,运动对mTOR信号通路的影响主要偏重于Akt和mTOR活性的影响。运动可能主要通过Akt来影响mTOR信号,从而影响骨骼肌内的蛋白合成过程。本研究发现,在对大鼠进行了1周75%VO2max的跑台训练后,于运动后6小时取材。与安静组相比,运动组大鼠PI3K蛋白表达量增加了3%,Akt(Ser473)磷酸化水平增加27%,mTOR (Ser2448)磷酸化水平增加13%;而局部注射外源性IGF-I对骨骼肌PI3K蛋白、Akt和mTOR的活性均有显著影响,显示出IGF-I对整个PI3K/Akt/mTOR通路均有显著的促进效应。而运动则可能主要通过Akt来影响mTOR信号,从而影响骨骼肌内的蛋白合成过程。
4 结论
1)一周外源性IGF-I注射明显促进运动骨骼肌mTOR通路的活性,且为整体性;而运动与IGF-I具有协同增强效应,且运动对该通路的影响有所侧重。
2)在运动和注射外源性IGF-I的刺激下,通路各信号分子的磷酸化状态比蛋白表达更为敏感。建议以检测信号分子的磷酸化表达为主。
[1]Bodine S C,Stitt T N,Gonzalez M,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J].Nat Cell Biol,2001,11(3):1014-1019.
[2]Bedford T G,Tipton C M,Wilson N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[3]奥斯伯.新编分子生物学实验指南[M].北京:科学出版社,2005:80-250.
[4]Coligan J E,Dunn B M,Speicher D W,et al.Current Protocols in Protein Science[M].Washington:John Wiley&Sons,Inc.,2003: 1403-1540.
[5]Musaro A,McCullagh K J,Naya F J,et al.IGF-1 induces skeletal myocyte hypertrophy through calcineurin in association with GATA-2 and NF-ATc1[J].Nature,1999,400(6744):581-585.
[6]Rommel C,Bodine S C,Clarke B A,et al.Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/mTOR and PI (3)K/Akt/GSK3 pathways[J].Nat Cell Biol,2001,3(11):1009-1013.
[7]Hafizi S,Chester A H,Yacoub M H.Inhibition of human cardiac fibroblast mitogenesis by blockade of mitogen-activated protein kinase and phosphatidylinositol 3-kinase[J].Clin Exp Pharmacol Physiol,1999,26(7):511-513.
[8]Wymann M P,Pirola L.Structure and function of phosphoinositide 3-kinases[J].Biochim Biophys Acta,1998,1436(1-2):127-150.
[9]Wilson E M,Rotwein P.Control of MyoD function during initiation of muscle differentiation by an autocrine signaling pathway activated by insulin-like growth factor-II[J].J Biol Chem,2006,281(40): 29962-29971.
[10]Ward S G,Finan P.Isoform-specific phosphoinositide 3-kinase inhibitors as therapeutic agents[J].Curr Opin Pharmacol,2003(4): 426-434.
[11]Kozma S C,Thomas G.Regulation of cell size in growth,development and human disease:PI3K,PKB and S6K[J].Bioessays,2002,24(1):65-71.
[12]Barton E R,Morris L,Musaro A,et al.Muscle-specific expression of insulin-like growth factor I counters muscle decline in mdx mice[J].J Cell Biol,2002,157(1):137-148.
[13]Lai K M,Gonzalez M,Poueymirou W T,et al.Conditional activation of akt in adult skeletal muscle induces rapid hypertrophy[J].Mol Cell Biol,2004,24(21):9295-9304.
[14]Glass D J.Skeletal muscle hypertrophy and atrophy signaling pathways[J].Int J Biochem Cell Biol,2005,37(10):1974-1984.
[15]Erbay E,Chen J.The mammalian target of rapamycin regulates C2C12 myogenesis via a kinase-independent mechanism[J].J Biol Chem,2001,276(39):36079-36082.
[16]Shu L,Zhang X,Houghton P J.Myogenic differentiation is dependent on both the kinase function and the N-terminal sequence of mammalian target of rapamycin[J].J Biol Chem,2002,277(19): 16726-16732.
[17]Bolster D R,Crozier S J,Kimball S R,et al.AMP-activated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin(mTOR)signaling[J].J Biol Chem,2002,277(27):23977-23980.
Mechanism of Exercise and IGF-I Inducing Skeletal Muscle Adaptive Hypertrophy in Rats
ZHU Han1,ZHAO Hua2,ZENG Fanxing1
(1.Sport Science College,Beijing Sport University,Beijing 100084,China;
2.Physical Education Department,Tianshui Normal University,Tianshui 741001,Gansu,China)
Objective:the purpose of this study was to examine the effect of mTOR signal pathway on Skeletal Muscle A-daptive Hypertrophy in resistance treadmill exercise model through injecting exogenous IGF-I in vivo.Methods:adult male Sprague-Dawley rats(8 weeks old)were randomly divided into 4 groups after adaptive training:sedentary(S),IGF-I group (SI),exercise group(E)and IGF-I plus exercise group(EI).The following treadmill training was applied:20m/min at 10%slope,60 min;once per day,7 days.Rats were treated daily with exogenous IGF-I(5.5 mg/kg,diluted with saline)or saline local subcutaneously for 7 days.The MHC,PI3K,AKt and phosphorylation of Akt(Ser473),mammalian target of rapamycin(mTOR)and phosphorylation of mTOR(Ser2448),p70S6Kand phosphorylation of p70S6K(Thr 389)of gastrocnemius muscle were determined by Western blotting.Results:After 1 week,wet weight and MHC of gastrocnemius muscle was promoted significantly by IGF-I,PI3K,AKt and phosphorylation of Akt(Ser473),mTOR and phosphorylation of mTOR(Ser2448),p70S6Kand phosphorylation of p70S6K(Thr 389)were significantly promoted by IGF-I,and but they were elevated by exercise except PI3K.Conclusions:These results suggest that:1)The mTOR pathway of skeletal muscle was significantly promoted by exogenous IGF-I,and the positive effect was global.Exercise had synergy effect with exogenous IGF-I in vivo,while exercise can synergy improve mTOR pathway with IGF-I.The effect of exercise was particular emphasis on partial elements of mTOR pathway.2)Phosphorylations of mTOR pathway were sensitive than total-molecules.
IGF-I;mTOR pathway;skeletal muscle hypertrophy;exercise
G804.21
A
1004-0560(2011)04-0074-04
2011-06-12;
2011-07-16
国家自然科学基金项目(批准号30671013)。
朱 晗(1980-),女,助理研究员,主要研究方向为运动生理学。
曾凡星(1956-),男,教授,博士生导师,主要研究方向为体育运动中内分泌变化及适应机制研究,E-Mail:fanxingz@china.com.cn。
责任编辑:乔艳春
◂论文选粹

