过碳酸钠/钼酸钠体系对2-氯乙基乙基硫醚的降解机理与动力学研究
张 磊 习海玲 王 琦 左言军 张淑琴
(防化研究院,北京,102205)
过碳酸钠/钼酸钠体系对2-氯乙基乙基硫醚的降解机理与动力学研究
张 磊 习海玲*王 琦 左言军 张淑琴
(防化研究院,北京,102205)
研究了不同温度下过碳酸钠/钼酸钠体系和单一过碳酸钠对芥子气模拟剂2-氯乙基乙基硫醚(2-CEES)降解动力学规律,建立了相应的反应速率方程;利用液质联用技术分析了降解产物,并利用顺磁共振技术检测了过碳酸钠/钼酸钠体系产生的活性成分,推测了反应机理.结果表明,两种体系对2-CEES降解反应均为一级反应,过碳酸钠/钼酸钠体系对2-CEES消毒的活化能为8.36 kJ·mol-1,单一过碳酸钠对2-CEES降解的活化能为44.73 kJ·mol-1,添加钼酸钠能有效降低反应活化能,提高反应速率;主要降解产物为C2H5S(O)C2H4OH、C2H5S(O)C2H4Cl、C2H5S(O2)C2H4OH以及C2H5S(O)C2H3,体系产生的主要活性物种为单线态氧1O2,推测反应同时存在水解与氧化反应.
2-氯乙基乙基硫醚,过碳酸钠,钼酸钠,动力学,机理.
芥子气[1](2,2'-二氯二乙基硫醚,ClCH2CH2SCH2CH2Cl)是一种危害很大的糜烂性毒剂,它能使皮肤和各种组织起泡、糜烂和坏死,有“毒剂之王”之称.过碳酸钠[2](2Na2CO3·3H2O2)俗称固体双氧水,由于具有一定的氧化能力且环境友好、腐蚀性低,科研人员试图将其用于对芥子气降解.20世纪80年代Aubry[3]首次研究发现 Na2MoO4可以催化 H2O2产生单线态氧1O2,提高 H2O2氧化能力,随后他和Bouttemy[4]研究了Na2MoO4/H2O2油包水微乳液体系,氧化能力进一步增强,氧化选择性高达97%.Wagner G W[5]等人将钼酸盐用于军事消毒,研究了K2MoO4/H2O2微乳液降解体系,对芥子气降解的半衰期由42 min缩短到30 s.最近,习海玲研究小组研究表明单一过碳酸钠对芥子气的降解效果不能满足降解要求,过碳酸钠/钼酸钠消毒体系对芥子气具有很好的降解效果[6],但对其动力学规律和反应机理未见报道.
2-CEES(2-氯乙基乙基硫醚,CH3CH2SCH2CH2Cl)的结构与芥子气只相差一个氯原子,毒性却比芥子气小很多,通常被用于芥子气的模拟剂.鉴于毒剂操作的高危险性,本文以2-CEES为探针分子,通过气相色谱(GC)分别测定了过碳酸钠/钼酸钠体系和单一过碳酸钠降解后残余2-CEES的浓度,建立了不同温度下的速率方程,计算了反应活化能;通过液质联用技术(LC-MS)分析了消毒产物,利用顺磁共振(ESR)技术检测了活性物种,推测了降解机理,为芥子气的消毒技术研究提供了基础数据.
1 实验部分
1.1 试剂和仪器
过碳酸钠:工业级,浙江时代金科化工有限公司;钼酸钠:分析纯,广东汕头市西陇化工厂;硫代硫酸钠:分析纯,北京试剂厂;二氯甲烷:分析纯,北京化工厂;甲基膦酸二甲酯(DMMP):0.4 mol·L-1,自制;2,2,6,6-四甲基哌啶(TMP):0.2 mol·L-1,自制;甲醇:分析纯,北京试剂厂;去离子水:实验室自制;2-CEES:98%,Aldrich公司.
Agilent 6890N气相色谱:美国安捷伦公司;Varian NMR System核磁共振仪:美国 Varian公司;Agilent 6520 Accurate-Mass Q-TOF液相色谱-质谱联用仪:美国安捷伦公司;ESR 300E型电子顺磁共振波谱仪:瑞士Bruker公司;DK-S26型恒温水浴锅:上海精密实验设备有限公司;BS210S型分析天平:北京赛多利斯公司.
1.2 实验方法
消毒反应:取15 μL 2-CEES于具塞试管中,配制过碳酸钠质量分数为5%,钼酸钠质量分数为0.5%的降解液,向具塞试管中放入1 mL配制好的过碳酸钠/钼酸钠降解液,置于恒温水浴锅中反应,每隔一定时间取出试管漩涡振荡;加入1 mL 10%硫代硫酸钠溶液终止反应.
GC分析:二氯甲烷溶剂超声萃取上述反应液,萃取液用无水硫酸钠干燥后进行GC分析.色谱条件:FID检测器;HP-5毛细管柱;初始温度60℃,保持0.5 min,以15℃·min-1加热到90℃,保持10 min,再以30 ℃·min-1加热到150 ℃,保持1 min.
LC-MS分析:将降解后反应液加入甲酸,调节pH为弱酸性,直接进样LC-MS分析.仪器条件:安捷伦C18液相色谱柱;流动相:20%甲醇/80%水;离子化方式:ESI;扫描范围:50—1000 amu;流速:0.25 mL·min-1.
ESR分析:单线态氧的检测方法是配制1 mL包含5%过碳酸钠和0.5%钼酸钠的水溶液,加入100 μL TMP溶液,摇匀后用石英毛细管插入溶液中虹吸样品,取出后用橡皮泥密封石英毛细管一端,进样分析.羟基自由基和超氧阴离子的检测方法同上,区别是将TMP溶液替换为DMMP溶液.
2 结果与讨论
2.1 反应动力学模型
2-CEES易发生C—Cl键的亲核取代反应和S原子的氧化反应.速率方程为:

r:反应速率;k:反应速率常数;ca:2-CEES浓度;cb:过碳酸钠浓度;x、y:反应分级数.
由于反应体系中过碳酸钠的量远远大于2-CEES,因此可认为cb为常数,速率方程简化为:

2.2 动力学方程的建立及活化能的计算
根据过碳酸钠/钼酸钠对2-CEES消毒反应动力学实验,测定不同时间残余2-CEES浓度,对lnc-t作图并进行曲线拟合,结果如图1所示.从图1中可得20℃时lnc-t为直线关系,推断反应是一级反应,并得到速率常数 k=0.00940 s-1,建立 20 ℃时反应速率方程为:r=0.00940c(2-CEES),R2=0.9962.
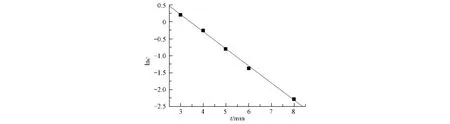
图1 20℃过碳酸钠/钼酸钠体系对2-CEES降解的时间趋势Fig.1 Time course of 2-CEES degradation by sodium percarbonate/sodium molybdate at 20 ℃
根据上述实验方法,测得不同温度下5%过碳酸钠/0.5%钼酸钠体系以及5%单一过碳酸钠对2-CEES消毒反应速率常数,如表1所示.
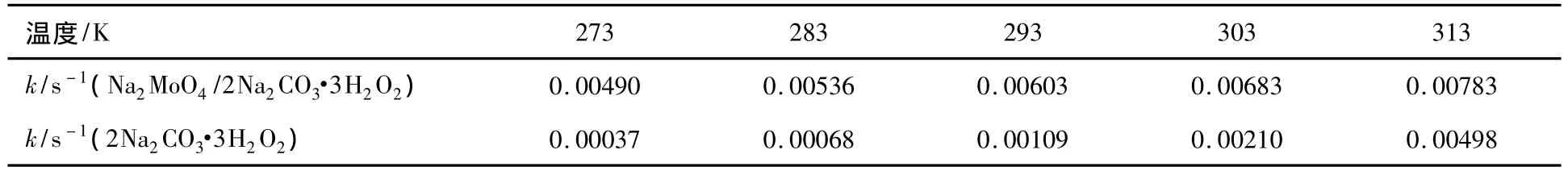
表1 不同温度下消毒反应速率常数Table 1 Degradation reaction rate constants at different temperature
从所得数据中得出两种体系的速率常数均呈现随温度升高而增大的趋势,表明温度升高能够加快反应.对比两种体系的速率常数,可知在相同温度下,加入钼酸钠后反应速率常数增大,表明钼酸钠的加入也能够显著提高反应速率.从数据可证明,在30℃以下时,钼酸钠是提高速率常数的主要因素,30℃以上时温度是提高速率常数的主要因素.
根据Arrhenius公式的不定积分式[7]:

A:指前因子,与碰撞频率有关;R:气体常数;T:温度;Ea:表观活化能;k:速率常数.
由不同温度下的速率常数k值,可做lnk-(1/T)图(图2),进行拟合可得斜率k0,根据式(4)可得:

以此计算过碳酸钠/钼酸钠体系斜率 k0= -1.00591×103,Ea=8.36 kJ·mol-1;单一过碳酸钠体系斜率 k0= -5.38263 ×103,Ea=44.73 kJ·mol-1.

图2不同温度lnk-(1/T)图(Na2MoO4/2Na2CO3·3H2O2及2Na2CO3·3H2O2)Fig.2lnk-(1/T)curves at different temperatures(Na2MoO4/2Na2CO3·3H2O2,2Na2CO3·3H2O2)
2.3 过碳酸钠/钼酸钠体系对2-CEES降解主要产物
对于实际应用,一般研究30 min内的降解反应有意义.因此,为了研究2-CEES的降解反应机理,利用LC-MS技术对2-CEES在过碳酸钠/钼酸钠体系中反应30 min的消毒产物进行了分析,消毒产物结构如下,对应的质谱图如图3所示.
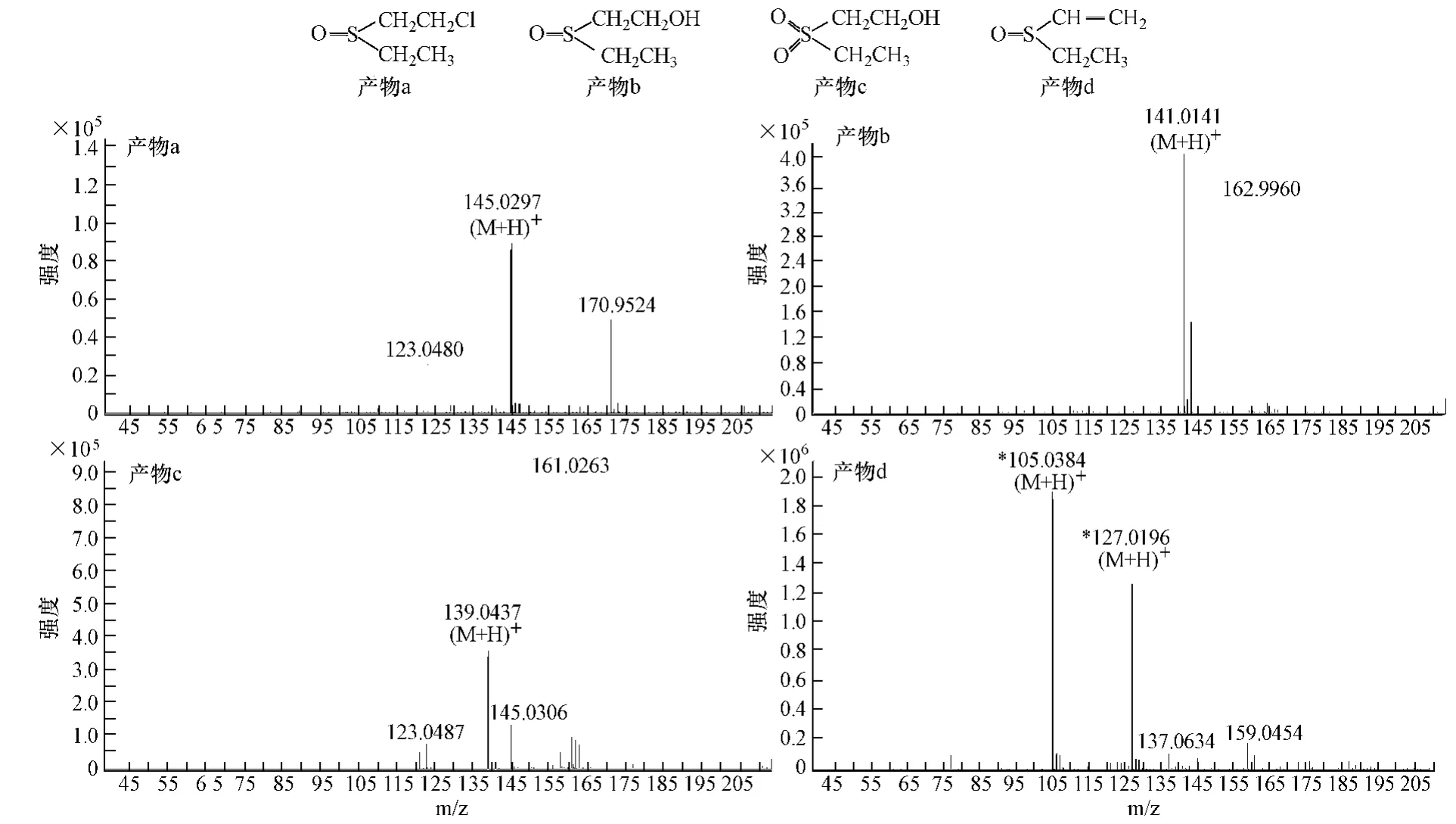
图3 主要降解产物质谱图Fig.3 Mass spectra of the major degradation products
2.4 过碳酸钠/钼酸钠体系活性物种的测定
Aubry[8]认为过氧化氢与钼酸根离子首先生成过钼酸根,随后过钼酸根释放出单线态氧1O2,他们进一步研究表明,过氧化氢在此体系中释放出少量超氧阴离子自由基和Foote[9]研究表明,钼酸钠与过氧化氢反应生成,然后释放出1O2.由于以上研究均是针对过氧化氢且pH值小于10(pH大于10过氧化氢会自然分解),鉴于消毒剂采用的是过碳酸钠/钼酸钠体系,而且pH大于10,在此条件下是否有单线态氧或是其它活性物质生成还需进一步研究确定.
采用顺磁共振技术(ESR)针对过碳酸钠/钼酸钠体系可能产生的单线态氧(1O2)、羟基自由基(·OH)和超氧阴离子自由基(·),分别进行了ESR检测.图4为过碳酸钠/钼酸钠体系单线态氧(1O2)ESR谱图.从图4中可以看出,反应开始就检测到了明显的单线态氧(1O2)ESR信号.随着时间的增长,信号一直增大,15 min信号强度是3 min信号强度的10倍,30 min信号强度是3 min信号强度的20倍.说明单线态氧(1O2)是过碳酸钠/钼酸钠体系的有效氧化成分之一,且生成速度快,持续时间长.ESR捕捉到了少量的羟基自由基(·OH)信号,9 min的信号强度略小于3 min信号强度,15 min时信号基本消失.说明过碳酸钠/钼酸钠体系生成少量的羟基自由基(·OH),且逐渐消失.实验中未检测到超氧阴离子自由基·)的ESR信号,表明过碳酸钠/钼酸钠体系没有生成超氧阴离子自由基.

图4 1O2的ESR谱图Fig.4 The ESR spectra of1O2
2.5 2-CEES 降解机理
通过向过碳酸钠中添加少量的钼酸钠,可使其对2-CEES消毒反应的活化能由44.73 kJ·mol-1降低到8.36 kJ·mol-1,极大地降低了反应难度,提高了反应速率.综合过碳酸钠与钼酸钠的作用机理以及LC-MS检测的主要产物,推测此消毒反应机理为:2-CEES在过碳酸钠/钼酸钠体系中同时发生水解和氧化反应,一方面过碳酸钠与钼酸钠反应生成有效氧成分(1O2),2-CEES在相界面被1O2氧化为a,a再溶解于消毒体系中发生水解反应和消去反应,生成b,b一部分发生消去反应生成d,另外一部分再被1O2氧化为c;另一方面2-CEES在相界面发生水解,其产物C2H5SC2H4OH溶于过碳酸钠/钼酸钠体系被1O2氧化为a,a再重复上述的反应,2-CEES降解机理如下所示:

需要说明的是,检测结果显示产物中含有大量的a和b,说明反应一开始以氧化为主,生成a,随后水解为b;产物中只有少量的c,说明过碳酸钠/钼酸钠体系对2-CEES的反应具有较高选择性,主要选择性生成亚砜,少量生成砜.
3 结论
本实验较为系统地研究了过碳酸钠/钼酸钠体系及单一过碳酸钠对2-CEES的消毒反应动力学,建立不同温度下的速率方程,求得过碳酸钠/钼酸钠体系对2-CEES消毒反应活化能为8.36 kJ·mol-1,单一过碳酸钠对2-CEES的消毒反应活化能为44.73 kJ·mol-1.实验证明,温度的提高和钼酸钠的加入都能提高反应速率.利用LC-MS技术分析了消毒产物,主要消毒产物为C2H5S(O)C2H4OH、C2H5S(O)C2H4Cl、C2H5S(O2)C2H4OH以及C2H5S(O)C2H3,利用ESR技术检测到体系生成的主要活性物种为单线态氧1O2,推测反应机理为以1O2氧化S原子为主,同时存在水解反应.研究结果为过碳酸钠/钼酸钠消毒体系的改进及新消毒剂的研究提供了理论指导.
[1]赵国辉,寿伟椿.军用毒剂化学[M].北京:防化指挥工程学院,1985
[2]宗清文.过碳酸钠的合成及应用[J].实验技术与管理,2000,6:57-59
[3]Aubry J M.Search for singlet oxygen in the decomposition of hydrogen peroxide by mineral compounds in aqueous solutions[J].J Am Chem Soc,1985,107:5844-5849
[4]Aubry J M.Bouttemy,S.Preparative oxidation of organic compounds in microemulsions with singlet oxygen generated chemically by the sodium molybdate/hydrogen peroxide system[J].J Am Chem Soc,1997,119:5286-5294
[5]Wagner G W,Procell L R,Yang Y C,et al.Molybdate/peroxide oxidation of mustard in microemulsions[J].Langmuir,2001,17:4809-4811
[6]习海玲,王琦,陈立坤,等.水基过氧化物复合消毒剂[P].中国:ZL200910121033.0.20110803
[7]董元彦,李宝华,路福绥.物理化学[M].北京:科学教育出版社,2001
[8]Aubry J M.Chemical sources of singlet oxygen.3.Peroxidation of water-soluble singlet oxygen carriers with the hydrogen peroxide-molybdate system[J].J Org Chem,1989,54:726-728
[9]Niu Q J,Foote C S.Singlet molecular oxygen generation from the decomposition of sodium peroxotungstate and sodium peroxomolybdate[J].Inorg Chem,1992,31:3472-3476
KINETICS AND MECHANISM OF THE DEGRADATION REACTION
OF 2-CHLORORTHYL ETHYL SULFIDE BY SODIUM PERCARBONATE/SODIUM MOLYBDATE
ZHANG Lei XI Hailing WANG Qi ZUO Yanjun ZHANG Shuqin
(The Institute of Chemical Defence,Beijing,102205,China)
The kinetics of degradation reaction of 2-chlororthyl ethyl sulfude(2-CEES)in sodium percarbonate/sodium molybdate system and single sodium percarbonate were studied at different temperatures,and the corresponding reaction rate was calculated.The reaction mechanism was proposed based on the analysis of the degradation products by LC-MS and reactive species by ESR.The results show that both systems are first-order reactions.The activation energy of sodium percarbonate/sodium molybdate on 2-CEES degradation is 8.36 kJ·mol-1,and that of single sodium percarbonate is 44.73 kJ·mol-1.The activation energy was reduced and the reaction rate was improved by adding sodium molybdate.The main degradation products are C2H5S(O)C2H4OH,C2H5S(O)C2H4Cl,C2H5S(O2)C2H4OH and C2H5S(O)C2H3.The main reactive species is singlet oxygen.The reaction mechanism is suggested to be a concerted reaction of hydrolysis and oxidation.
2-chloroethyl ethyl sulfide,sodium percarbonate,sodium molybdate,kinetics,mechanism.
2010年12月17日收稿.
*通讯联系人,Tel:66758407;E-mail:fhxihl@163.com

