不同方法提取阴道加德纳菌细菌基因组DNA的比较
姚 虹,吕 治,苏建荣
(首都医科大学附属北京友谊医院临床检验中心,北京100050)
有资料表明,在细菌性阴道炎的微生物菌群中阴道加德纳菌(Gardnerella vaginalis,GV)处于优势地位,数量明显高于其他非正常菌群[1]。目前对GV的实验室诊断随着分子生物学技术的发展,PCR技术以快速,敏感和特异等优点迅速地应用到临床。PCR检测细菌的关键之一是模板的选择,即要确定扩增的目的基因。因此,简单实用的细菌基因组DNA的提取是GV研究的基础。本研究通过多种方法提取GV基因组DNA,然后通过定量检测进行比较,建立一种简单高效的细菌基因组DNA提取的方法。
1 材料与方法
1.1 材料
1.1.1 实验菌株 GV株为卫生部质控株。
1.1.2 试剂 蛋白酶K,溶菌酶,SDS均是Sigma公司生产。
1.1.3 仪器 凝胶成像系统为Bio-Rad Gel Doc 2000型,PCR仪为Biotronic公司AG-9600型,荧光定量PCR扩增仪为ABI7300。CO2培养箱为日本SANYO公司。
1.2 方法
1.2.1 菌株培养 将菌株接种于人血琼脂平板上,5%CO2,35℃培养24小时。挑取单个菌落接种于脑心浸出液液体培养基,CO2培养箱培养至2.0麦氏比浊单位。
1.2.2 细菌基因组DNA提取方法 ①酚-氯仿抽提法 1ml细菌过夜培养液,5 000 rpm离心10min,去上清液,加550μl TE悬浮沉淀,并加50μl 10%SDS,50μl 20 mg/ml蛋白酶 K,混匀,37℃保温1 h。加 150μl 5mmol/L NaCl,混匀。加150μl CTAB/Na-Cl溶液,混匀,65℃保温20 min。用等体积酚:氯仿∶异戊醇(25∶24∶1)抽提 ,5 000 rpm离心 10 min,将上清液移至干净离心管中,用等体积酚∶氯仿(24∶1)抽提,取上清液移至干净试管中,加1倍体积异丙醇,颠倒混合,室温下静止10分钟,沉淀DNA,用70%乙醇漂洗沉淀后,洗干,溶解于100μl TE,-20℃保存[2]。②加热煮沸法 取1 ml细菌过夜培养液,5 000 rpm离心10 min,去上清液,加100μl TE,100℃煮沸10 min,高速低温离心10 min(4℃,12 000 r/min),取上清液-20℃保存[2]。
③溶菌酶-煮沸法 取1 ml细菌过夜培养液,5 000 rpm离心10 min,去上清液,加入溶菌酶100μl(10 mg/ml,1 g溶菌酶溶于10 mmol/LTris-HCL),100℃煮沸10 min,高速低温离心10 min(4℃,12 000 r/min),取上清液-20℃保存[3]。
④碱裂解-煮沸法 取1 m细菌过夜培养液,5 000 rpm离心10min,去上清液,加100μl 0.2 mol/L NaOH,100℃煮沸10min,高速低温离心10min(4℃,12 000 r/min),取上清液-20℃保存[4]。
⑤醋酸钾法 取1 ml细菌过夜培养液 (麦氏比浊为2.0),5 000 rpm离心10 min,丢去上清液,收集菌体。加入400μl裂解液(40mM Tris-醋酸,20 mM醋酸钠,1 mM EDTA,10%SDS,pH7.8)混匀,置于37℃水浴1 h。然后加入200μl 5mol/L的氯化钠溶液,混匀后于高速低温离心10min。取上清液,用苯酚抽提2次,氯仿抽提1次。加两倍体积无水乙醇,1/10体积醋酸钾(3M,pH8.0),高速低温离心10 min,弃上清液,沉淀用70%乙醇洗2次;置于室温干燥后,溶于100μl TE溶液中,置4℃保存备用[5]。
⑥改良溶菌酶-盐析法 将1 ml细菌过夜培养液,5 000 rpm离心10 min,弃上清,加入400μl溶菌酶裂解液[1 g溶菌酶溶于5mmol/L NaCl,20mmol/L Tris2HCl,1mmol/L EDTA,8%蔗糖,20 mg/ml蛋白酶K混合液400μl],加入100μl 10%十二烷基硫酸钠,置56℃水浴箱1 h;然后加入200μl 5 mol/L的氯化钠溶液,混匀后于高速低温离心10 min。取上清液,加两倍体积无水乙醇沉淀DNA,沉淀用70%乙醇洗2次;置于室温干燥后,溶于100μl TE溶液中,置-20℃保存备用。
1.2.3 基因组DNA纯度和浓度测定 使用UV-24019C型紫外分光光度仪检测基因组浓度及OD260/OD280值。
1.2.4 普通PCR对基因组DNA定性检测 GV的引物合成参照文献[6],由上海英俊生物公司合成。序列如下:P1,5’-GGGCGGGCTAGAGTGCA-3’;P2,5’-GAACCCGTGGAATGGGCC-3’,产物条带大小为 332 bp。以 GV质控株为模板,以 P1和 P2为引物,反应体系为 25μl:Taqmix 12.5μl,P1 1μl,P2 1μl,模板2 μl,dH2O 8.5μl。反应条件:95℃10 min,94℃30 S,62℃30 S,72℃30 S,40个循环,72℃7 min。使用2%琼脂糖凝胶进行产物检测。
1.2.5 FQ-PCR测定 对6种方法提取的 GV基因组DNA作荧光定量PCR,引物同上。PCR反应体积为25μl,PCR参数:94℃预变性 5 min,94℃45 s、55℃45 s、72℃1 min,35个循环 ,最后 72℃5 min结束反应。根据Ct值对提取效率进行判断。
2 结果
2.1 定性PCR测定结果 对6种方法提取的GV基因组DNA进行普通PCR,PCR扩增产物经2%琼脂糖凝胶电泳,均可见332 bp左右的特异性条带,具体结果见图1。
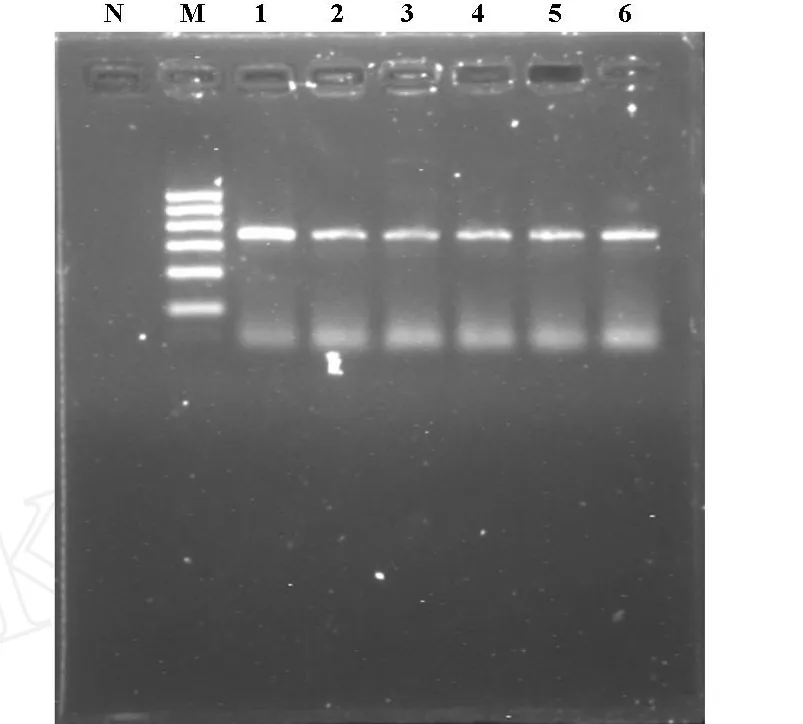
图1 GV标准菌株琼脂糖凝胶电泳
2.2 荧光定量PCR测定结果 对6种方法提取的GV基因组DNA作荧光定量PCR,从左到右,以改良法CT值最低,其次为酚-氯仿抽提法、醋酸钾法、碱裂解煮沸法和溶菌酶煮沸法,加热煮沸法CT值最高。具体结果见图2。

图2 FQ-PCR测定不同方法提取 GV基因组DNA
2.3 不同方法提取DNA的比较
通过多次平行试验表明改良法提取效率最高,酚-氯仿抽提法和醋酸钾法提取效率次之,碱裂解煮沸法和溶菌酶煮沸法提取效率较差,加热煮沸法提取率最低。具体结果见表1。
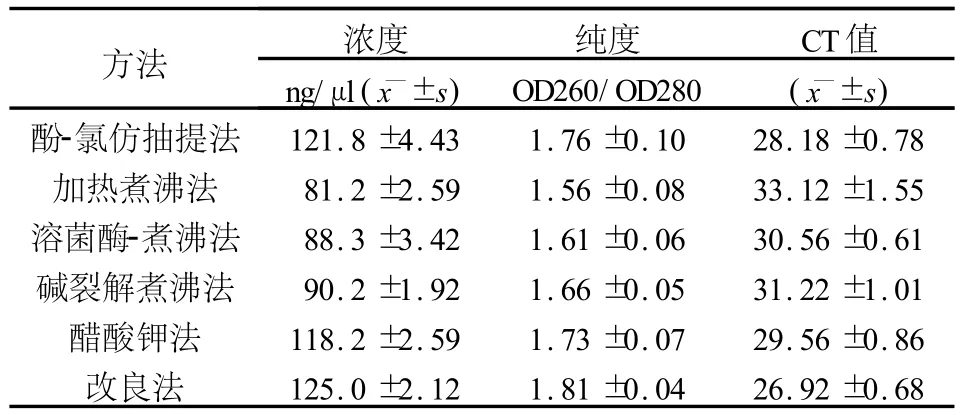
表1 不同细菌基因组DNA提取方法的比较
3 讨论
在临床微生物检验中,常规分离方法是最基础的,也是最广泛的,但是传统的细菌学检验于鉴定的主要依据是形态特征和生理性状,需要进行细菌培养及一系列生化反应或免疫学检测,方法复杂费时,对有些细菌也往往不能给出理想的鉴定结果[6]。随着分子生物学技术的发展,PCR技术以快速,敏感和特异等优点迅速地应用到临床微生物检测领域。PCR检测细菌的关键之一是模板的选择,即要确定扩增的目的基因。因此,简单实用的细菌基因组DNA的提取是分子生物学技术研究和检测临床细菌的基础。
获得一定浓度和纯度的DNA是进行分子生物学研究的基础。破解细胞壁与细胞膜是获得基因组DNA的前提,而蛋白质和核酸物质的分离是获得高质量DNA产物的关键。目前,细菌基因组DNA提取方法有酚抽提法,专用DNA提取试剂盒法,碱裂解法,加热煮沸法,溶菌酶裂解法,SDS裂解法,及其他破壁方法(超声破碎,研磨破碎,反复冻融等)[7]。DNA经典分离方法是酚/氯仿抽提法,该法虽然效率较高,但费时费力,而且其操作中要求多次离心,增加了样品污染的可能性。在DNA溶液中的酚类等有机物质对DNA聚合酶有抑制作用,特别是在PCR扩增过程中会对扩增过程产生抑制作用。由于采用有机溶剂的处理,试剂有一定的毒性,大量应用有害健康,不适合常规应用。加热煮沸法时间短,操作简单,但加热过程中会有少部分DNA降解导致提取效率较低,同时其最大缺陷是无法提取革兰氏阳性菌基因组DNA;碱裂解法是一种简便的细菌基因组DNA提取方法,但该法提取采用强碱具有一定的腐蚀性;SDS裂解法及溶菌酶法一般需要复杂的裂解液体系并借助蛋白酶K和RNA酶的帮助来获得高质量的抽提产物,部分药品及相关酶试剂价格昂贵[8]。DNA专用试剂盒提取法提取细菌基因组DNA效果好但成本较高,临床应用受到限制。
本文对上述其中几种提取细菌基因组DNA方法进行了对比实验,研究结果证实了各种方法的优缺点。加热煮沸法操作简单,但提取效率低。为缩短操作时间,本研究中将溶菌酶法和碱裂解法与煮沸法结合,碱裂解法提取效率要好于溶菌酶法。本实验结果表明单独使用溶菌酶不能达到良好的提取效果。酚氯仿提取法是经典的提取方法,提取效率较好,但操作繁琐,耗时长。虽然DNA得率高,但荧光定量PCR的CT值却偏低,证实了可能有少量酚残留对PCR扩增的抑制作用。醋酸钾法是用SDS破壁,高盐低 PH溶液沉淀蛋白质,用酚氯仿抽提,提取效率稍差。本实验改良法中我们将溶菌酶法和盐析法结合并进行了改良,一次同时加入溶菌酶消化,蛋白酶K降解蛋白,SDS充分裂解细胞并去除有机杂质,然后用饱和氯化钠沉淀蛋白质,并经离心除去,上清直接用乙醇沉淀DNA。该法简化了DNA的抽提步骤,减少了有机溶剂的使用,提取的DNA具有较高的浓度和纯度,适合临床应用,建议各实验室可根据具体要求来合理地选用DNA的提取方法及试剂。
[1]李连青,朱庆义,刘俊芬,等.阴道加德纳菌对细菌性阴道病的病原学诊断评价[J].中华医院感染学杂志,2005,15(2):226.
[2]Witt A,Pet ricevic L,Kaufmann U,et al.DNA hybridization test:rapid diagnostic tool for excluding bacterial vaginosis in pregnant women with symptoms suggestive of infection[J].J Clin Microbiol,2002,40(8):3057.
[3]张龙祥,张庭芳,等编.生化实验方法和技术[M].北京:高等教育出版社,1996.
[4]萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指南(金冬雁译)[M].第2版.北京:科学出版社,1995:463-469.
[5]Antonio MA,SE Hawes,SL Hillier.The identification of vaginal Lactobacillus speciesand the demographic and microbiologic characteristicsof women colonized by these species[J].J Infect Dis,1999,180:1950.
[6]Coyne SR,Craw PD,Norwood AD,et al.Comparative analysis of the schleicher and schuelliso code stix DNA isolation device and the Qiagen QIAamp DNA mini kit[J].JClin Microbiol,2004,42(10):4859.
[7]马蔡昀,童明庆,文 怡,等.细菌性阴道病实验室诊断方法的比较[J].医学临床研究,2005,22(7):919.
[8]余道军,童文娟,陈岳明,等.临床标本细菌基因组DNA提取方法探讨[J].中国微生态学杂志,2007,(19)6:519.

