新霉素的直接竞争酶联免疫分析法
徐乃丰,胥传来,匡 华,屈昌龙,许 阳,彭池方*
(江南大学食品学院,江苏 无锡 214122)
新霉素的直接竞争酶联免疫分析法
徐乃丰,胥传来,匡 华,屈昌龙,许 阳,彭池方*
(江南大学食品学院,江苏 无锡 214122)
首先用碳二亚胺(EDC)法将新霉素(NEO)偶联于载体蛋白-卵清白蛋白(ovalbumin,OVA),合成包被原OVANEO,SDS-PAGE 进行鉴定;用高碘酸钠法连接辣根过氧化物酶(horseradish peroxidase,HRP),制备酶标抗原NEO-HRP并建立直接ELISA检测方法。通过一系列参数的优化,包括包被溶液、封闭溶液、竞争时间、抗体稀释液、pH值、反应温度、显色时间等,最终得到其IC20(抑制率为20%时的标准溶液质量浓度)<1ng/mL、半数抑制量(IC50)为7.6ng/mL,线性方程为y =-0.2798x+0.7456,R2=0.991。直接ELISA总耗时只需大约1h。
新霉素;间接竞争酶联免疫吸附试验;直接竞争酶联免疫吸附试验
动物性食品的安全问题已成为社会各界极为关注的食品安全热点问题。新霉素残留因为其潜在的致癌性以及其他不良作用对人类的健康造成极大的威胁。作为一种重要的兽用抗生素,新霉素在奶牛等家畜的疾病治疗中有较为广泛的应用[1-6]。但是,由于使用不规范等原因、常常导致新霉素在动物性食品中过量残留。新霉素药物残留对人体健康产生有害的影响,主要表现为耐药性增加及肠道菌的紊乱、产生过敏性反应及中毒、干扰激素平衡及癌变、急性中毒、污染环境及生态毒性[7-10]。因此,许多国家和地区都对新霉素制订了最高残留限量[11-13]。本实验旨在研究新霉素残留的间接和直接竞争ELISA检测方法以及实验方案的优化、标准曲线的绘制以及样品回收率的研究,以期为食品安全监督以及技术储备提供一定的参考。
1 材料与方法
1.1 材料与试剂
牛血清蛋白(bovine serum albumin)、卵清白蛋白(ovalbumin)、考马斯亮蓝G250 上海伯奥生物科技公司;辣根过氧化物酶(horseradish peroxidase) 北京拜尔迪生物公司;硫酸新霉素(NEO) 美国Sigma公司;辣根过氧化物酶标记的羊抗兔IgG(HRP-IgG) 康成生物工程公司;NEO抗体 自制;新霉素标准品 中国药品生物制品检定所。
1.2 仪器与设备
AB104-N型电子分析天平 上海Metller Toledo公司;UV-2802PCS紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;101-A型电热恒温鼓风干燥箱 通州市扈通制药机械设备厂;81-2型恒温磁力加热搅拌器 江阴市周庄电器五金厂;KFLO纯水机 厦门凯佛隆公司;Costar96孔8×12可拆酶标板 上海吉泰生物科技有限公司;Anke TGL-16C离心机 上海安亭科学仪器厂;ZD-9556水平摇床 太仓科教器材厂;MuLtiska Mks 酶标仪 芬兰Thermo Labsystems公司;凝胶电泳仪 美国Thermo公司;XevoTM QTof质谱仪、沃特世MassLynx 质谱软件 美国Waters公司。
1.3 方法
1.3.1 包被原的合成
称取20mg新霉素和20mg卵清白蛋白溶于PBS溶液(0.01mol/L,pH7.4)搅拌均匀(20min),称70mg EDC加入到上述混合液中,搅拌反应4h,然后进行透析(20℃条件下用0.01mol/L PBS透析3d,12h换一次透析液),透析结束之后,4℃条件保存。
1.3.2 酶标记抗原的合成
1.3.2.1 HRP酶的活力测定
用碳酸盐缓冲溶液(pH9.2)配制HRP 0.01μ mol/L酶溶液,再稀释10倍,取10μL HRP溶液与100μL TMB底物反应,反应时间分别为30s和1、1.5、2、2.5、3min,用100μL 2mol/L硫酸中止,测吸光度(A)。
1.3.2.2 HRP酶的活化
在试管中加入临时配制的0.1mol/L碳酸盐缓冲液0.5mL,与10mg HRP酶混合;加12mmol/L NaIO4液0.5mL,盖上试管盖,20℃避光反应2h。
1.3.2.3 偶联
15mg NEO溶于2mL 0.1mol/L碳酸盐缓冲液(pH9.2);室温反应3h;加临时配制的NaBH4(用0.1mmol/L NaOH配制成5mg/mL)300μL,室温搅拌反应1h;透析2d,每天换液两次;用1:1比例的甘油避光保存在-20℃的冰箱中;将偶联的酶标抗原(Ag-E)和HRP酶分别做质谱图和高效液相色谱图。
1.3.3 工作浓度的确定
抗体包被:用包被缓冲液(pH9.6)将酶标抗原(Ag-E)系列稀释至250、500、1000、2000、4000、8000、16000、32000倍,在每孔中加100μL,37℃孵育2h。之后取出微孔板倒空孔内溶液,用洗涤缓冲液洗3次,每次3min。
封被:每孔加200mL封闭液,于37℃孵育2h,用洗涤缓冲液洗3次,每次3min。
抗原抗体反应:用抗体缓冲液将抗体(Ab)稀释成不同的倍数(250、500、1000、2000、4000、8000、16000、32000),每孔加入100μL,置于37℃ 30min。倒空液体,用洗剂缓冲液洗3次,每次3min。
加底物显色:于各孔中加入临时配制的显色液(TMB:底物缓冲液=1:5,V/V)100μL,反应15min,于各孔中加入2mol/L硫酸100μL终止反应。
测定A450nm选取最适工作浓度。
1.3.4 标准曲线的建立
通过以上实验选取酶标抗原/抗体(Ag-E/Ab)最适工作浓度为64000/1000和128000/1000;将以最佳稀释度1000的抗体包被96孔酶标板100μL/孔,37℃孵育2h;取出酶标板,回至室温(24℃左右),每孔加200μL、pH7.4、体积分数0.05% Tween-20的PBST洗液,摇床振荡3min,用力甩掉洗液,在吸水纸上拍干,再重复洗涤2次;添加封闭液200μL/孔,37℃孵育2h;取出酶标板,按步骤2洗涤,再放入37℃温育箱内烘干15min;取出酶标板,第一排加50μL/孔的PBS(0.01mol/L)溶液,从第二排起分别加7个质量浓度(1、2.5、5、10、25、50、100ng/mL)的标准溶液(用0.01mol/L PBS稀释)50μL/孔,两个重复;再加入以最佳稀释度的酶标抗原64000、128000倍(用抗体稀释液稀释)50μL/孔,37℃/30min。取出洗3遍,拍干;每孔加入100μL显色液(TMB与底物缓冲液比例1:5),37℃烘箱反应15min,取出每孔加入100μL终止液(2mol/L硫酸),用酶标仪测定450nm处的吸光度(A450nm);求出各浓度的B/B0值,B0为标准溶液为0ng/mL时的吸光度。以B/B0为纵坐标,以标准溶液浓度的对数值为横坐标作图,即得NEO的竞争标准曲线。
2 结果与分析
2.1 新霉素直接ELISA检测方法酶标记抗原的合成
2.1.1 HRP酶的活力测定
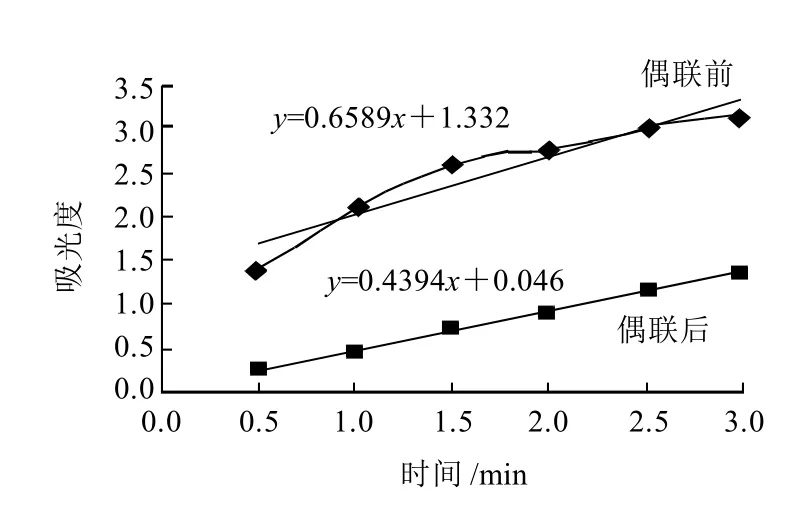
图1 偶联前后酶活力的比较Fig.1 Comparison of enzyme activity before and after coupling
一个酶活性单位定义为每分钟在403nm波长处吸光度的变化为1所需酶的量,酶的比活性为毫克酶蛋白的活性(U/mg)[14-15]。由图1可以看出,HRP酶在不同反应时间中测定吸光度(403nm),标记前后酶活性明显降低,计算得降低到22.1%。
2.1.2 高效液相色谱与质谱图
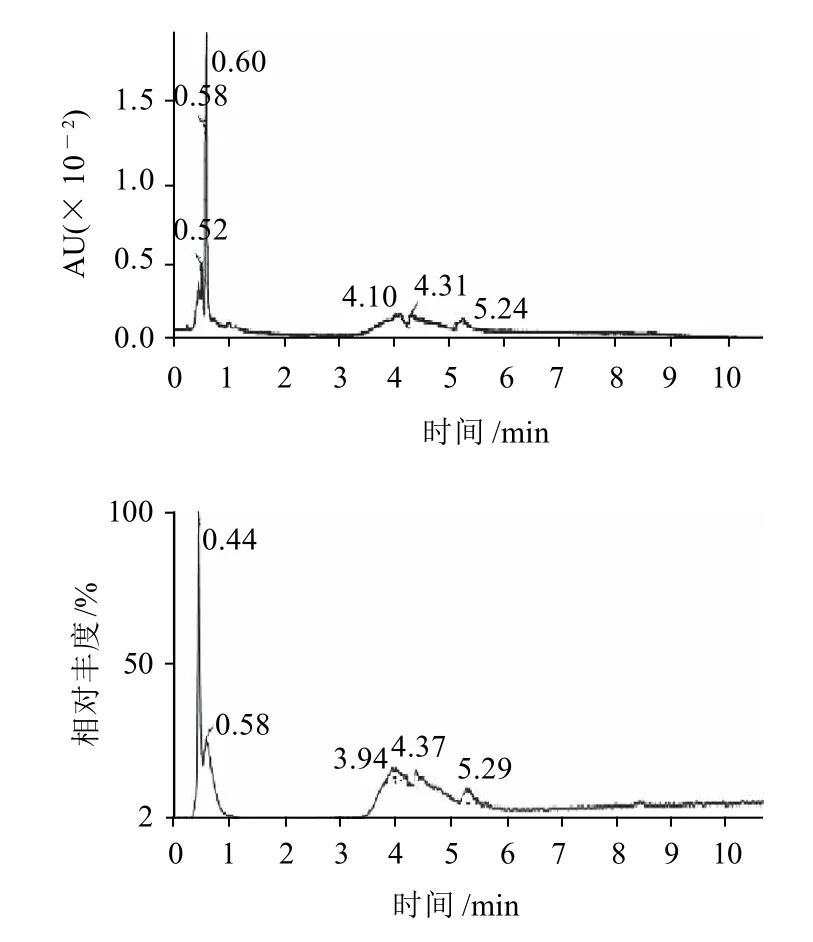
图2 NEO-HRP高效液相色谱-质谱图Fig.2 HPLC-MS chromatograph of NEO-HRP
图3 NEO-HRP峰4.369min的质谱棒状图Fig.3 Mass spectrogram of NEO-HRP at 4.369 min
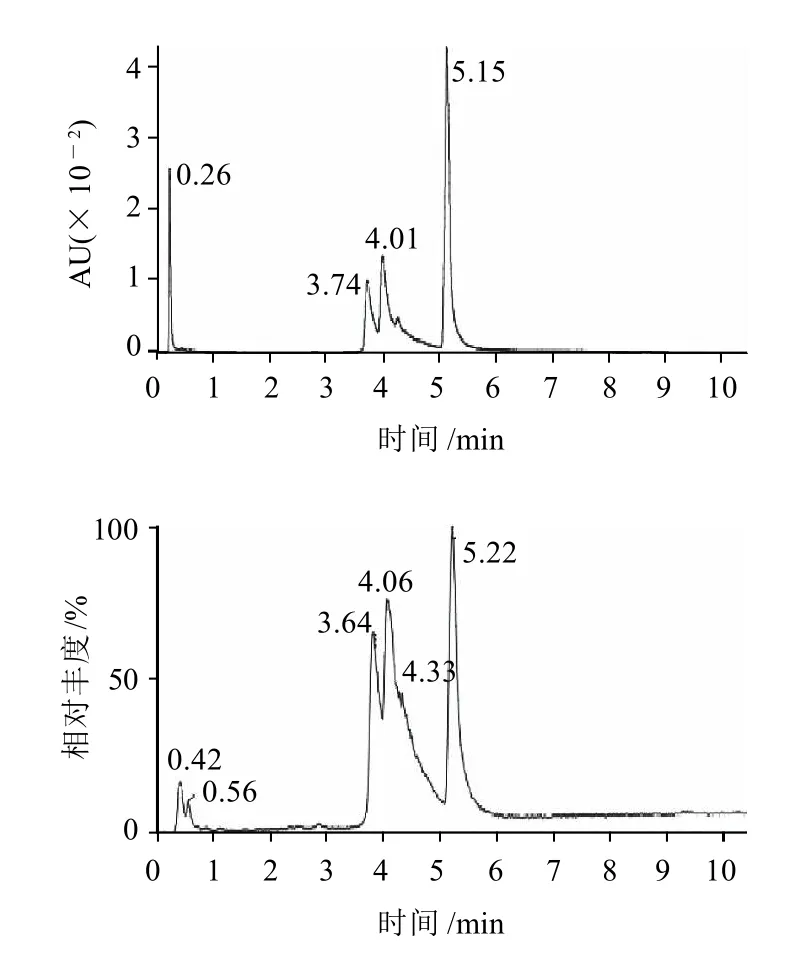
图4 HRP高效液相色谱-紫外检测图Fig.4 HPLC-UV detection of HRP
图5 HRP峰3.842min质谱棒状图Fig.5 Mass spectrogram of HRP at 3.842 min
图6 HRP的相对分子质量(峰3.842 min)Fig.6 Molecular weight of HRP (peak at 3.842 min)
由图5和图6可知,通过Waters MassLynx 质谱软件,根据质荷比计算得到HRP(峰3.842min)的相对分子质量为43136.0。
图7 HRP峰4.063min质谱棒状图Fig.7 Mass spectrogram of HRP at 4.063 min
图8 HRP的相对分子质量(峰4.063min)Fig.8 Molecular weight of HRP (peak at 4.063 min)
由图7和图8可知,通过沃特世 MassLynx 质谱软件,根据质荷比计算得到HRP(峰4.063min)的相对分子质量为41940.0。
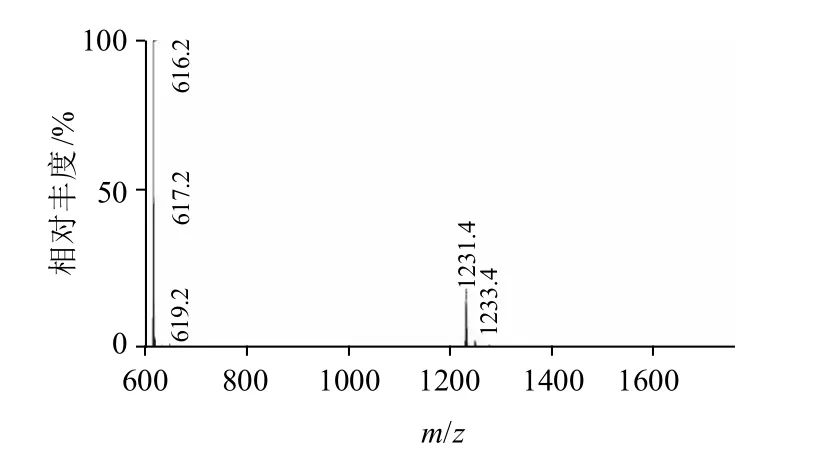
图9 HRP峰5.219min质谱棒状图Fig.9 Mass spectrogram of HRP at 5.219 min
综上,由图2~9可以看出,结果得到了并非单一酶的HRP-NEO偶联物。
2.2 工作浓度的确定
将纯化后的新霉素抗体系列稀释250、500、1000、2000、4000、8000、16000、32000倍,将酶标抗原稀释1000、4000、16000、64000、128000倍。用方阵滴定法确定酶标抗原和抗体的工作浓度,布板方式见表1。
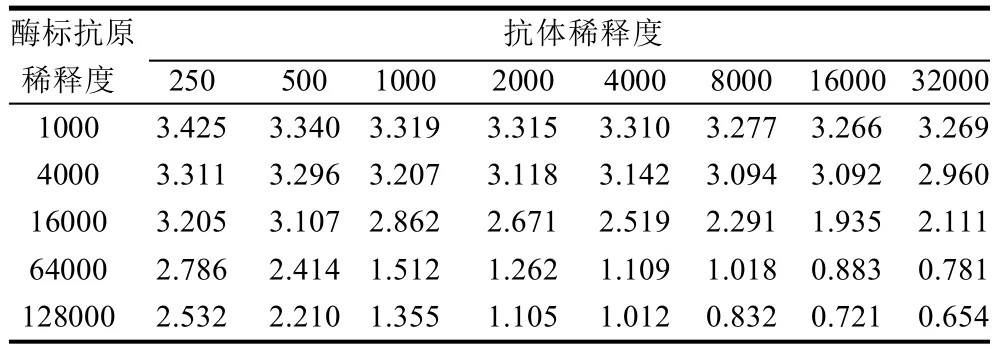
表1 方阵滴定法确定工作浓度Table 1 Determination of working concentration with blocking titration
测工作点以这样的方式布板的好处是可以找出那些符合吸光度的点。实验中发现适当大的稀释度能增加方法的灵敏度,而且适当大的抗体稀释度能够降低抗血清中干扰物质的干扰。因为抗血清经过纯化,浓度稀释了很多倍,因此工作浓度的稀释倍数比纯血清的工作浓度的稀释倍数小得多由表1可见,在酶标抗原稀释度为64000和128000,抗体稀释倍数为1000时,吸光度为1.512和1.355时,可以确定为较佳的稀释度。
2.3 标准曲线的制作
以B/B0为纵坐标,以新霉素标准溶液浓度的对数值(lgC)为横坐标作图,得到新霉素的抑制标准曲线方程为y=-0.2525x+0.6673,R2=0.983,计算得半数抑制量(IC50)为4.7ng/mL,线性范围为1.0~100.0ng/mL。作为用以定量检测的标准曲线,以达到检测的要求。
2.4 直接ELISA方法的优化
本实验分别对下列参数进行优化。实验完全按照优化的顺序进行。每个参数的优化都采用了之前优化的参数作为实验条件。评判的依据很多,本研究采用IC50、Amax以及Amax/IC50来作为整个优化过程的依据。IC50是个很重要的参数,很多文献中都用此来作为判断依据。
2.4.1 包被缓冲液的影响

表2 包被缓冲液的优化Table 2 Optimization of coating buffer
本实验考察两种常用包被液(碳酸盐缓冲液、0.01mol/L PBS)对确定工作浓度的影响。从表2可知,在相同工作浓度下,A随着包被液的不同只有轻微改变,因此,不同的包被缓冲液对于工作浓度的选择影响很小。

表3 包被溶液的优化(Ab1000/Ag64000)Table 3 Optimization of coating antigen (Ab 1000/Ag 64000)
本实验考察两种常用包被液(碳酸盐缓冲液、0.01mol/L PBS)对抑制曲线的影响。从表3可见,Amax随着碳酸盐缓冲液,PBS溶液顺序依次降低。两种包被液对IC50的影响变化很大。以两者的比例Amax/IC50来看,碳酸盐缓冲液的值远大于PBS。因此,碳酸盐缓冲液为较理想的选择。
2.4.2 封闭液的影响

表4 封闭液的优化(Ab1000/Ag64000)Table 4 Optimization of blocking solution (Ab 1000/Ag 64000)
本实验考察3种封闭液:0.1%明胶、1% OVA、1%酪氨酸对标准曲线的影响。从表4可见,Amax随着酪氨酸、明胶、OVA顺序依次降低。3种封闭液对IC50的影响变化很大。以两者的比例Amax/IC50来看,0.1%明胶作为封闭液的值远大于其余两个。因此,0.1%明胶为较理想的选择。
2.4.3 pH值的影响
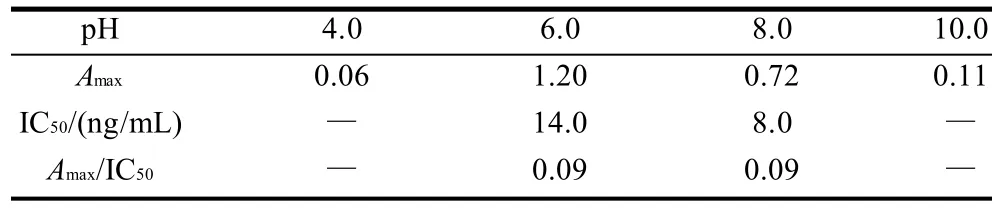
表5 酶标抗体稀释液的pH值对ELISA的影响(Ab1000/Ag64000)Table 5 Effect of pH of labeled antibody diluent on ELISA (Ab 1000/Ag 64000)
从表5可以看到,pH值过低(pH4.0)或过高(pH10.0)均会导致抗体抑制能力的下降,甚至没有抑制。pH6.0~8.0时,IC50抑制较好,故选pH7.4的酶标抗原稀释液为最佳pH值。
2.4.4 竞争时间的影响

表6 竞争时间的优化(Ab1000/Ag64000)Table 6 Optimization of competition time (Ab 1000/Ag 64000)
表6是抗体与新霉素在不同竞争时间内反应所得到的结果。随着时间的增加,Amax有所变化,IC50先随着时间下降而后又上升。因此,选择30min为最佳竞争时间。
2.4.5 温度的影响
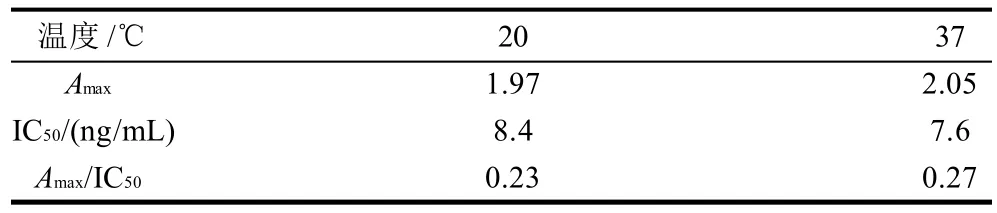
表7 反应温度的优化(Ab1000/Ag64000)Table 7 Optimization of reaction temperature (Ab 1000/Ag 64000)
表7是反应温度分别为20℃和37℃的直接竞争ELISA结果。其中,Amax的值随温度增加而升高。因此,在37℃时,吸光度较高,而且IC50也很理想,所以选择37℃。
2.4.6 显色时间的影响

表8 显色时间的优化(Ab1000/Ag64000)Table 8 Optimization of chromogenic time (Ab 1000/Ag 64000)
表8是显色时间分别为5、15min和25min的ELISA结果。其中,Amax的值随时间增加而增大,然而空白值也随之增加,从0.07增加到0.85左右。因此,显色时间不能再增加,否则,本底将会很高,不可取。在15min时,吸光度较高,而且IC50也很理想,所以选择15min作为显色时间。
当所有相关条件确定后,采用包被缓冲液为pH9.6、0.05mol/L碳酸盐缓冲液,包被时间为2h(37℃),ELISA用的溶液系统为pH7.4,0.01mol/L的PBS溶液,竞争时间为37℃孵育0.5h,显色时间15min,封闭缓冲液为明胶,进行ELISA的综合实验,以B/B0为纵坐标,以新霉素标准溶液质量浓度的对数值(lgC)为横坐标作图,得到新霉素的抑制标准曲线其IC20(抑制率为20%时的标准溶液质量浓度)<1ng/mL、半数抑制量(IC50)为7.6ng/mL,线性方程为y=-0.2798x+0.7456,R2=0.991。适合食品中新霉素的检测应用。
2.4.7 样品回收率的测定
通过计算得牛奶样品中的新霉素添加回收率,如表9所示。

表9 牛奶中的新霉素添加回收率Table 9 Recovery rate of spiked neomycin in milk
由表9可以看出,新霉素在牛奶中的添加值5.0ng/g和50ng/g,添加回收率分别为81.60%和89.88%,添加回收率随添加量的增加而有所增加。
3 结 论
本实验将新霉素半抗原与牛血清白蛋白和卵清白蛋白分别交联制成免疫抗原和包被抗原,以此为基础设计并优化了间接竞争ELISA方法以及直接竞争ELISA方法,主要结论如下:利用戊二醛法合成了NEO的免疫原NEO-BSA,用碳化二亚胺 (EDC)法包被抗原NEOOVA,高碘酸钠法合成酶标抗原NEO-HRP;建立间接竞争ELISA方法检测NEO。最终得到标准曲线方程为y=-0.1405x+1.3753,R2=0.977,半数抑制量(IC50)为9.6ng/mL,线性范围为0.5~50.0ng/mL;建立直接竞争ELISA方法。通过一系列参数的优化,包括包被溶液、封闭溶液、抗体反应时间、抗体稀释液pH值、反应温度、显色时间等,最终得到其IC20(抑制率为20%时的标准溶液质量浓度)<1ng/mL、半数抑制量(IC50)为7.6ng/mL,线性范围为1~100ng/mL,线性方程为y=- 0.2798x+0.7456,R2=0.991。
[1] 张洪丽. 我国食品安全存在的问题及保证食品安全应采取的对策[J].中国商界, 2010, 190(48): 48-49.
[2] 郑明光. 论动物性食品安全[J]. 专家论坛, 2005(3): 6-12.
[3] BLASCO C, TORRES C M, PICO Y. Progress in analysis of residual antiba cterials in food[J]. Trends in Analytical Chemistry, 2007, 26(9):895-913.
[4] 管斌. 水样中新霉素残留分析方法的建立及其在动物性样品分析中的应用[D]. 厦门: 厦门大学, 2007.
[5] 袁宗辉, 操继跃, 郑动才, 等. 饲料药物学[M]. 北京: 中国农业出版社, 2001: 55-61.
[6] 戴自英, 刘裕昆, 汪复. 实用抗菌药物学[M]. 上海: 上海科学技术出版社, 1992: 103-118
[7] WAKSMAN S A, LECHEVALIER H A. Ncomycin, a new antibfotie active agaist strepto mycin resistant bacteria, including tuberculosis organisms[J]. Science, 1949, 109(25): 305-307.
[8] 沈川, 肖希龙. 新霉素在动物机体中的残留及其测定方法[J]. 中国兽药杂志, 1998, 32(2): 53-56.
[9] 刘晓冬, 林洪, 江洁. 动物源性食品中氨基糖苷类抗生素检测技术的研究进展[J]. 安徽农业科学, 2010, 38(8): 4128-4132.
[10] 胡昌勤, 刘炜. 抗生素微生物检定法及其标准操作[M]. 北京: 气象出版社, 2004.
[11] 郭文欣, 王国忠, 李朝华, 等. 链霉素在牛奶中残留检测[J]. 中国兽药杂志, 2001, 35(2): 24-26.
[12] MASAKAZU H, HARUMI K, RIE I. Sensitive microbiological assay of residual antibacterials in meat by microbiological method[J]. Bunseki Kagaku, 2007, 56(12): 1097-1103.
[13] KUSANO T, KANDA M, KAMATA K, et al. Microbiological method for the detection of antibiotic residues in meat using mixed-mode, reverse-phase and cation-exchange cartridge[J]. Shokuhin Eiseigaku Zasshi,2004, 45(4): 191-196.
[14] 黄应平, 蔡汝秀. 一种基于检测酶反应中间体而测定漆酶活性的动力学分析法[J]. 分析化学研究报告, 2002, 30(10): 1187-1191.
[15] 官斌, 袁东星. 牛奶样品中新霉素残留量的离子色谱法测定[J]. 分析试验室, 2006, 26(7): 1-4.
Direct Competitive Enzyme-linked Immunosorbent Assay (ELISA) for Neomycin
XU Nai-feng,XU Chuan-lai,KUANG Hua,QU Chang-long,XU Yang,PENG Chi-fang*
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
The neomycin (NEO) was coupled with ovalbumin (OVA) to form a coating antigen NEO-OVA by EDC method and determined by SDS-PAGE. The NEO was coupled with horseradish peroxidase (HRP) by NaIO4 method to establish enzymatic tracer NEO-HRP and direct competitive ELISA. Then, the parameters coating liquid, pH, incubation time and incubation temperature of direct ELISA were optimized. The IC20 value (20% inhibitory concentration) was less than 1 ng/mL and IC50 value (50% inhibitory concentration) was 7.6 ng/mL. The linear equation was y = -0.2798x +0.7456, R2= 0.991. The total consumption time of direct competitive ELISA was 1 h.
neomycin;indirect competitive enzyme-linked immunosorbent assay;direct competitive enzyme-linked immunosorbent assay
S859.84
A
1002-6630(2011)10-0212-06
2010-07-16
徐乃丰(1984—),男,博士研究生,研究方向为残留物检测。E-mail:xunaifeng217@163.com
*通信作者:彭池方(1975—),男,副教授,博士,研究方向为食品安全。E-mail:pcf2125@yahoo.com.cn

