高通量全自动仪器法测定植物源性食品中甲基托布津残留量
李爱军,王明泰,吴连鹏,牟 峻,卢利军,周 晓,胡婷婷,赵冬晗,姚天玲
(1.吉林出入境检验检疫局,吉林 长春 130062;2.吉林农业大学,吉林 长春 130118;3.长春大成玉米开发有限公司,吉林 长春 130062)
高通量全自动仪器法测定植物源性食品中甲基托布津残留量
李爱军1,王明泰1,吴连鹏1,牟 峻1,卢利军1,周 晓1,胡婷婷1,赵冬晗2,姚天玲3
(1.吉林出入境检验检疫局,吉林 长春 130062;2.吉林农业大学,吉林 长春 130118;3.长春大成玉米开发有限公司,吉林 长春 130062)
建立高效的应用高通量全自动均质仪、全自动净化在线浓缩仪及液相色谱-串联质谱仪测定植物源性食品中甲基托布津残留量的检测方法。试样经高通量全自动均质仪,用乙腈均质提取,经全自动净化在线浓缩仪(凝胶色谱柱、固相萃取柱)净化、在线浓缩后,采用液相色谱-串联质谱仪定量定性分析,外标法定量,液相流动相为甲醇-水,采用电喷雾离子源,定性离子对为m/z 343.0>151.1、m/z 343.0>192.1,定量离子对为m/z 343.0>151,添加0.01~10.0mg/kg的甲基托布津标准品时的回收率为88.4%~97.9%,相对标准偏差(RSD)在1.3%~2.9%之间,最低检出限为0.01mg/kg。该方法特异性强、敏感性高、高通量、全自动、快速高效,可应用于植物源性食品的甲基托布津残留量检测。
高通量全自动;植物源性食品;甲基托布津
甲基托布津(thiophanate-methyl,化学名为1,2-二(3-甲氧碳基-2-硫脲基)苯,CAS号为 23564-05-8,结构式见图1)是一种广谱性内吸低毒杀菌剂,纯品为无色结晶,原粉(含量约93%)为微黄色结晶,比重1.5(20℃)、熔点172℃(分解)、蒸气压949.1×10-8Pa(25℃)。几乎不溶于水,可溶于丙酮、甲醇、乙醇、氯仿等有机溶剂,对酸、碱稳定。它最初由日本曹达株式会社研制开发,对多种植物病害有预防和治病作用,其内吸性比多菌灵强。甲基托布津按其化学结构属取代苯类杀菌剂。
关于植物源性食品中甲基托布津残留量的检测方法,目前有气相色谱法[1-3]、紫外分光光度法[4]、气相色谱法[5-6],这些方法存在过程冗长、试剂用量较大、灵敏度低、检测品种单一、检测低线不能满足国内外限量要求[7]、自动化程度较低、无法定性确证等缺点。本实验在借鉴国际国内液相色谱-串联质谱检测方法[8-12]基础上,建立具有特异性强、敏感性高、高通量、全自动、快速高效等特点,完全符合国内、国际植物源性食品安全的甲基托布津残留量检测方法。
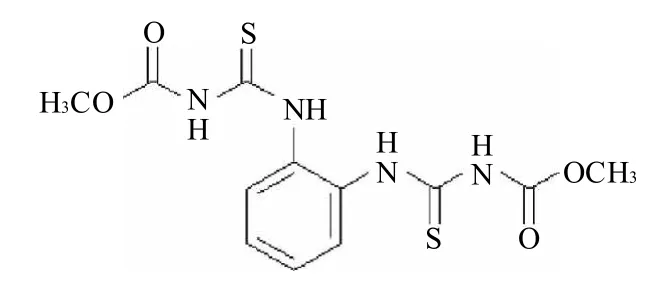
图1 甲基托布津分子结构Fig.1 Thiophanate-methyl molecule structure
1 材料与方法
1.1 试剂与标准品
除有特殊规定外,试剂均为分析纯,水均为二次蒸馏水。乙腈、甲醇、甲苯(均为色谱纯);氢氧化钠溶液(1.0mol/L):称取4.0g氢氧化钠,用水溶解并定容至100mL;乙酸乙酯-环己烷(1:1,V/V);甲苯-乙腈(3:1,V/V);甲醇-水(1:1,V/V);标准储备溶液:准确称取100mg(精确到0.1mg)的甲基托布津标准品,用甲醇-水(1:1,V/V)溶解并定容于100mL容量瓶中;配制成质量浓度为1000μg/mL的标准储备溶液;标准工作溶液:根据需要再用甲醇-水(1:1,V/V)稀释成适用质量浓度的标准工作溶液。
1.2 仪器与设备
API4000液相色谱-质谱/质谱联用仪[配有电喷雾(ESI)源] 美国A&B应用生物技术有限公司;FASTH21高通量全自动均质仪 北京测迪科技有限公司;PreLinc全自动净化色谱仪(配有凝胶净化、固相萃取、在线浓缩系统) 北京绿绵巨贸有限公司;离心机(5000r/min);涡旋混匀器;旋转蒸发仪;氮气吹干仪;电子天平(感量0.001g);0.20μm有机滤膜。
1.3 测定方法
1.3.1 提取
称取5.0g(精确至0.01g)样品于50mL塑料离心管中,加入5mL水,放入高通量全自动均质仪进行自动匀浆,再加入适量氢氧化钠溶液,调试液的pH7~8,并加入2.0g氯化钠,于涡旋混匀器上混匀。先用10mL乙腈提取一次,涡旋混合3min,以5000r/min离心2min。取上层清液于另一25mL离心管中,残渣再加入5mL乙腈,重复提取一次,合并上清液。提取液在氮气吹干仪上40℃条件下浓缩至近1mL。加入10mL乙酸乙酯-环己烷(1:1,V/V),旋转蒸发,近干,加入10mL乙酸乙酯-环己烷(1:1,V/V),待净化。
1.3.2 凝胶色谱(GPC)、固相萃取(SPE)净化
1.3.2.1 凝胶色谱条件
凝胶净化柱:Bio Beads S-X3[700mm×25mm(i.d.)];流动相:乙酸乙酯-环己烷(1:1,V/V);流速:4.7mL/min;样品定量环:10mL;预淋洗时间:10min;凝胶色谱平衡时间:5min;收集时间:21~28min。
1.3.2.2 凝胶色谱净化步骤
将10mL待净化液按上述条件进行净化,收集组分于40℃在线浓缩至1mL,待固相萃取净化。
1.3.2.3 固相萃取(SPE)净化
将氨基活性碳复合固相萃取小柱连接到全自动净化色谱仪,设定净化程序:用6mL甲苯-乙腈溶液预淋洗,加入1mL凝胶净化浓缩液(1.3.2.2节),控制流速为1.5mL/min,并用20mL甲苯-乙腈溶液洗脱,待在线浓缩。
1.3.2.4 在线浓缩
收集所有流出液,在线浓缩并用甲醇-水溶液定溶至1.0mL,过0.20μm有机相微孔滤膜后,供液相色谱-串联质谱仪测定。
1.4 色谱条件
色谱柱:Aglient XDB C18[150mm×2.1mm(i.d.),3.5μm];流动相:甲醇溶液;流速:0.5mL/min;进样量:1 0μL;柱温:3 0℃。
1.5 质谱条件
离子源:电喷雾(ESI)离子源,正离子模式;扫描方式:多反应监测(MR M)。其他参数:电喷雾电压(IS):5500V;离子源温度(TEM):450℃;辅助气1压力(GS1):40psi;辅助气2压力(GS2):50psi;气帘气压力(CUR):15psi;碰撞气(CAD):7psi;入口电压(EP)和出口电压(CXP):10V;气帘气(CUR):10psi。检测离子对、去簇电压(DP)、碰撞能量(CE)见表1。

表1 甲基托布津的选择离子对和优化参数Table 1 Selected ion pairs and optimized parameters for the mass spectral analysis of thiophanate methyl
1.6 液相色谱-串联质谱测定
1.6.1 标准曲线
分别从质量浓度为1000μg/mL的标液中吸取0.1、0.5、2.5、4.0、5.0mL,用50mL空白基质溶液定容,此时溶液中甲基托布津质量浓度分别为0.20、1.00、5.00、8.00、10.00μg/mL。注入进样瓶中进行色谱测定,按1.4节色谱条件进行分离,以质量浓度为横坐标、吸收峰面积为纵坐标绘制标准曲线。以保留时间及离子对m/z 343.0>151.1、m/z 343.0>192.1进行定性,离子对m/z 343.0>151.1为定量离子,外标法定量。
1.6.2 计算
试样中甲基托布津的含量/(mg/kg)按下式计算:
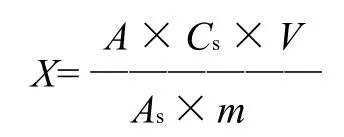
式中:As为标样溶液中甲基托布津的峰面积;A为试样溶液中甲基托布津的峰面积;Cs为所用甲基托布津标样溶液的质量浓度/(μg/mL);V为样品最终定容体积/mL;m为试样的质量/g。
1.6.3 空白实验
除不称取样品外,均按上述测定条件和步骤进行。
1.7 定性测定
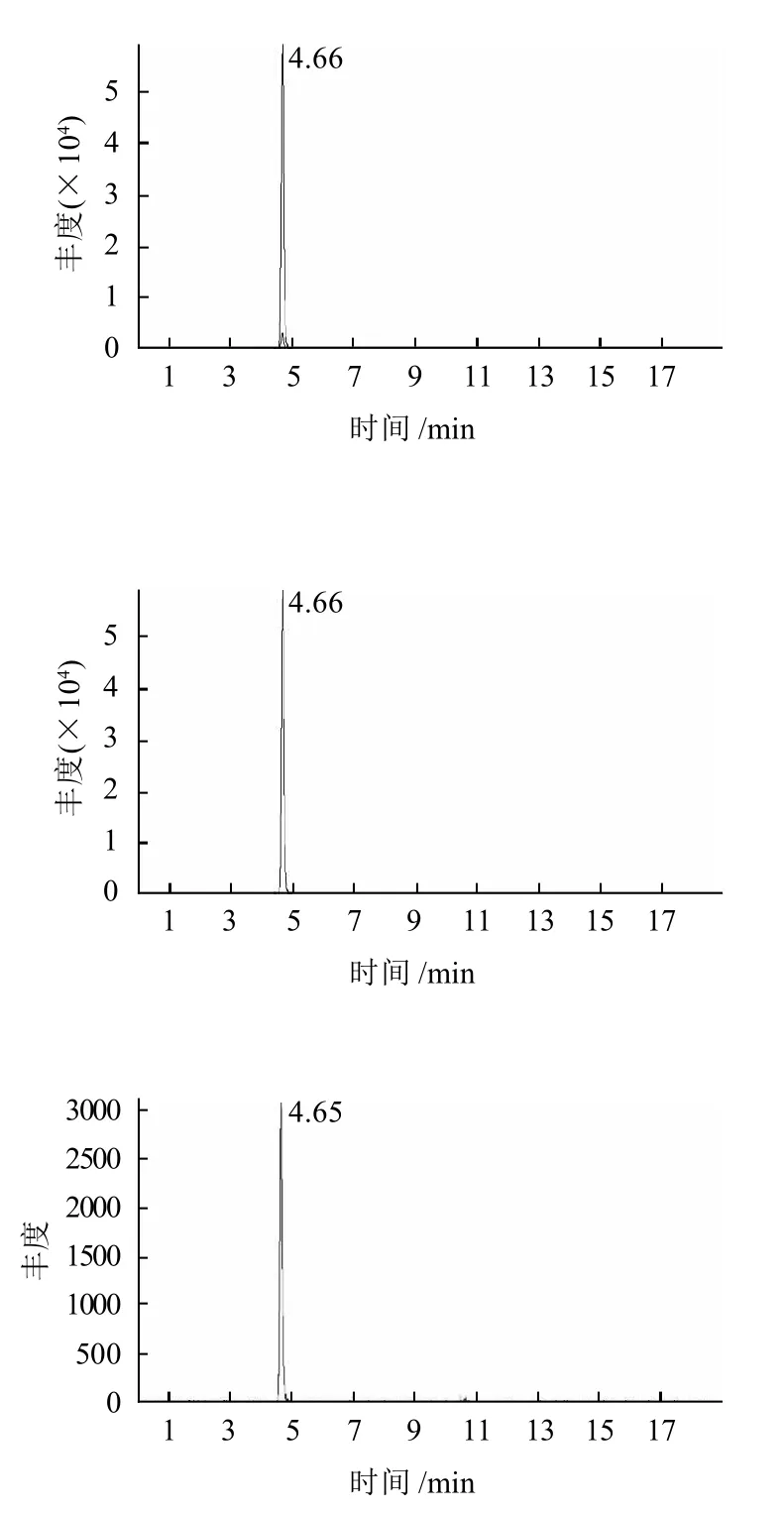
图2 甲基托布津标准溶液多反应检测(MRM)色谱图Fig.2 LC/MS/MS chromatogram of thiophanate methyl standard in MRM mode
利用串联质谱作为检测器进行定性分析,在上述条件下,甲基托布津标准出峰时间为4.66min,甲基托布津标准溶液多反应检测(MRM)色谱图见图2。
在扣除背景后的样品谱图中,各定性离子与同样条件下标准溶液谱图中对应的离子相对丰度,应不超过表2中的规定范围。
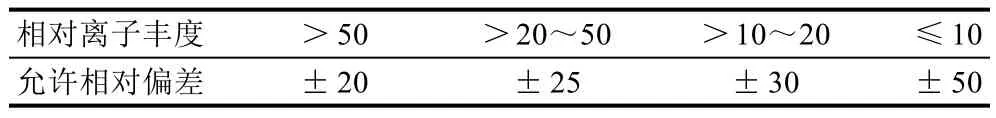
表2 定性确证时相对离子丰度的最大允许相对偏差Table 2 Maximum allowable standard derivations of relative abundance of ion in qualitative confirmation %
2 结果与分析
2.1 样品种类的确定
甲基托布津主要用于水果、蔬菜的杀菌剂,参与实验的果菜样品有苹果、柑橘、菠菜、黄瓜、白菜、大米、玉米。这7种样品在植物源性食品中较常见。
2.2 色谱条件优化
考察美国Agilent、Waters等不同公司、不同型号的色谱柱,最终选择Aglient XDB C18[150mm×2.1mm(i.d.)×3.5μm],可以满足实验要求。
考察不同配比的甲醇-水作为流动相,发现不同比例的流动相对出峰时间并没有太大影响,考虑到实际使用,最终确定甲醇:水=50:50(V/V)为最佳流动相。
2.3 质谱条件的优化
根据甲基托布津的分子结构特征,选择电喷雾(ESI)离子源,在正离子模式下对甲基托布津进行一级质谱分析,得到甲基托布津的分子离子峰,选择合适的分子离子峰进行优化,并进行二级质谱碎片分析,得到特征子离子信息,根据其质谱图中的碎片离子选择丰度相对较高和相对分子质量较大的碎片,选择合适的离子对进行电喷雾电压(IS)、离子源温度(TEM)、碰撞气(CAD)、入口电压(EP)、出口电压(CXP)、去簇电压(DP)、碰撞能量(CE)等质谱参数优化,使甲基托布津的分子离子与特征碎片离子的灵敏度达到最大时定为最佳质谱条件。优化后定性离子对为m/z 343.0>151.1、343.0>192.1,定量离子对为m/z 343.0>151.1。
2.4 线性范围、最低检出限、回收率和精密度实验
结果表明,在0.01~10.0μg/mL含量范围内各物质的峰面积(Y)与含量(X)具有良好的线性关系。回归方程和线性相关系数(r)为Y=206851X+10478.6(r=0.9998)。
对10个阴性的水样进行测定,得出响应值标准差,按最小检出限为空白值3倍标准差计算,将峰面积换算成被测物浓度,甲基托布津的最小检出限为0.01mg/kg。
进行回收实验时,甲基托布津的标准品应采用样品基质溶液进行溶解及配制。甲基托布津的标准添加量为0.10mg/kg,按上述的样品处理和测试条件进行测试,方法回收率在88.4%~97.9%之间。
取实验室制备的含有甲基托布津的饲料样品,按处理方法进行提取测定,连续测定6次,以实际测定浓度的相对标准偏差表征方法的精密度。甲基托布津峰面积的相对标准偏差RSD在1.3%~2.9%之间。
2.5 LC-MS/MS确证分析
本方法采用串联质谱多反应监测技术,利用串联质谱灵敏度高、定性定量准确的优势,使用保留时间和两对离子对进行确证,满足国际上对物质确证的得分要求,在色谱图中相应的保留时间范围内未见干扰,可以根据峰面积,采用外标法进行定量分析。定性离子对为m/z 343.0>151.1、343.0>192.1,定量离子对为m/z 343.0>151.1。
2.6 实际样品的测定
采用本方法对近期(2010年3月—2010年11月)菜市场交易的植物源性食品样品进行检测,总计检测了38批植物源性样品,包括玉米、黄瓜、青椒西兰花等品种,结果有2批样品检测出甲基托布津,甲基托布津残留量分别为11.0、9.2mg/kg。
[1] 日本甘薯中多菌灵、托布津、甲基托布津、苯菌灵(总量)的残留限量规定[EB/OL]. (2006-10-19)[2010-04-15]. http://db.foodmate.net/pesticide/read_ncxl.php?pid=78883.
[2] 湖南进出口商品检验局. SN/T 0162—1992 出口水果中甲基托布津残留量检验方法[S]. 北京: 中国标准出版社, 1992.
[3] 聂洪勇, 黄志强, 袁智能, 等. 气相色谱法测定柑桔中甲基托布津残留量[J]. 分析测试学报, 1989(2): 11-13.
[4] 卫生部食品卫生监督检验所. GB/T 5009.188—2003 蔬菜、水果中甲基托布津、多菌灵的测定[S]. 北京: 中国标准出版社, 2003.
[5] 廖国会, 段婷婷, 秦立新, 等. 高效液相色谱同时测定蔬菜中多菌灵、甲基托布津残留量[J]. 贵州农业科学, 2005, 33(4): 26-28.
[6] 林江丽, 张丽静, 张旭龙, 等. 高效液相色谱法同时测定甲基托布津和扑海因[J]. 分析化学, 2001, 29(8): 933-935.
[7] 葛志荣. 食品中农业化学品残留限量[M]. 北京: 中国标准出版社,2006: 1282-1283.
[8] 天津进出口商品检验局. SN/T 0125—1992 出口肉及肉制品中敌百虫残留量检测方法[S]. 北京: 中国标准出版社, 1992.
[9] 重庆出入境检验检疫局. SN/T 1920—2007 出口动物源性食品中敌百虫、敌敌畏、蝇毒磷残留量的检验方法[S]. 北京: 中国标准出版社, 2007.
[10] 胡小钟, 储晓刚, 余建新, 等. 气相色谱-质谱法快速筛选测定浓缩苹果汁中105种农药残留量[J]. 分析测试学报, 2003, 22(6): 26-28.
[11] 葛志荣. 食品中农业化学品残留限量[M]. 中国标准出版社, 2006: 984-1229.
[12] 湖北进出口商品检验局. SN/T 0209—1993 出口粮谷中辛硫磷残留量检测方法[S]. 北京: 中国标准出版社, 1993.
High-throughput Automated Instrumental Analysis of Thiophanate-methyl Residue in Plant-derived Foods
LI Ai-jun1,WANG Ming-tai1,WU Lian-peng1,MU Jun1,LU Li-jun1,ZHOU Xiao1,HU Ting-ting1,ZHAO Dong-han2,YAO Tian-ling3
(1. Jilin Entry-exit Inspection and Quarantine Bureau, Changchun 130062, China;2. Jinlin Agricultural University, Changchun 130118, Chian;3. Changchun Dacheng Maize Development Company, Changchun 130062, China)
An efficient detection method for thiophanate methyl residue in plant-derived foods was established by combing a high-throughput automated homogenizer, an automatic online purification and concentration system and a liquid chromatography-tandem mass spectrometry. Samples were homogenized with acetonitrile on a high-throughput automated homogenizer,purified using an automatic online purification (gel chromatographic and solid phase extraction column) system, online concentrated and detected using a liquid chromatography-tandem mass spectrometer. The quantification of thiophanate methyl was carried out using the external standard method. The detection conditions were: acetonitrile-water (gradient) as mobile phase, ESI as ionization method, qualitative ion pairs of m/z 343.0>151.1 and 343.0>192.1, quantitative ion pairs of m/z 343.0>151.1.With the addition of 0.01 to 10.0 mg/kg of thiophanate standard to samples, the recovery rate was between 88.4% and 97.9% and the relative standard deviations (RSDs) varied from 1.3% to 2.9%. The detection limit of the established method was 0.01 mg/kg.
high-throughput automated system;plant-derived foods;thiophanate-methyl residue
TS207.53
A
1002-6630(2011)10-0133-04
2010-07-14
国家质量监督检验检疫总局行业标准项目(2009B160)
李爱军(1968—),男,研究员,硕士,主要从事食品分析、农残检验研究。E-mail:liaj@jlciq.gov.cn

