高山被孢霉发酵生产多不饱和脂肪酸的初步研究
张 静,赵建新,陈海琴,陈 卫,张 灏
(江南大学食品学院,江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
高山被孢霉发酵生产多不饱和脂肪酸的初步研究
张 静,赵建新,陈海琴,陈 卫,张 灏*
(江南大学食品学院,江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
高山被孢霉具有很强的脂肪合成能力,并可积累多种多不饱和脂肪酸,为进一步提高高山被孢霉多不饱和脂肪酸产量,对碳源、氮源等对高山被孢霉菌体生长和多不饱和脂肪酸(PUFA)生产的影响进行分析。研究结果表明:甘油可以作为葡萄糖的替代物用于高山被孢霉工业化发酵生产多不饱和脂肪酸;当脱脂豆粉与硝酸钾的比例为2∶1时,此时菌体形态最利于脂肪酸生产,脂肪酸和花生四烯酸的产量分别为11.20g/L和5.89g/L,花生四烯酸的产量提高了4.0倍。
高山被孢霉,多不饱和脂肪酸,花生四烯酸
多不饱和脂肪酸(Polyunsaturated fatty acids,PUFA)指18碳以上含有两个或两个以上非共轭顺式双键的脂肪酸。主要包括亚油酸(LA)、α-亚麻酸(ALA)、γ-亚麻酸(GLA)、花生四烯酸(AA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)。PUFA是生物膜的重要组成成分,可以调节细胞构型、相转变及细胞膜的渗透性,同时是某些生物活性物质的前体,如类二十烷、前列腺素、白三烯等,具有重要生理功能[1-4]。高山被孢霉具有很强的多不饱和脂肪酸合成能力,尤其是花生四烯酸,在英国、日本等国已经实现工业化生产,而在我国尚处于起步阶段,产量有待于进一步提高。高山被孢霉发酵生产多不饱和脂肪酸,其油脂存在于菌体内,产量受菌体生物量,菌体中脂肪酸的比例和高附加值脂肪酸如AA、GLA、EPA等在脂肪酸中的比例三方面的影响。在提高生物量的同时,不同菌体形态会对发酵液的状况有很大影响,进而影响传质传氧。本研究希望通过接种方式、碳源、氮源、搅拌速率的研究改善菌体形态,促进发酵液中传质传氧,提高脂肪酸的产量,为具有我国自主知识产权的工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
高山被孢霉(Mortierella alpinaATCC 32222)购于美国标准生物品收藏中心,由本研究中心保藏;脱脂豆粉 青岛隆海食品有限公司,低温豆粕加工;大豆油 众友食品科技有限公司;酵母粉 Becton,Dickinson and Company;聚氧硅烷 赛欧信越X- 680;脂肪标准品 Nu-Chek公司。
气相色谱GC-2010 Shimadzu Co.,Japan。
1.2 培养基与培养方法
1.2.1 培养基 斜面培养基∶PDA培养基;种子培养基(g/L)∶葡萄糖30,酵母粉5,KNO32,NaH2PO41,MgSO4·7H2O 0.3,pH 6.3,115℃灭菌20min。发酵基本培养基(g/L) 葡萄糖50,脱脂豆粉31,大豆油1,KH2PO43,Na2SO41,CaCl2·2H2O 0.5,MgCl2·6H2O 0.5,pH 6.0,115℃灭菌20min。
1.2.2 培养方法 菌种活化∶将孢子接种于PDA斜面,20℃于霉菌培养箱中培养14d以上。种子培养∶向斜面培养基加入9mL种子培养基,轻刮孢子,以4%的接种量接种于种子培养基中,20℃,200r/min培养3d(液体发酵在250mL三角瓶中进行,每瓶装液量45mL)。将培养至3d的菌体用分散器打散成均匀的菌体片段,以1g/L菌体片段接种于种子培养基中,20℃,200r/min培养36h,作为发酵用菌种。发酵培养∶250mL摇瓶培养装发酵培养基50mL,回转式摇床转速200r/min,温度20℃。
1.3 实验方法
1.3.1 高山被孢霉菌体生物量的测定 全发酵液先用布氏漏斗真空抽滤分离发酵液和菌体,再用蒸馏水洗涤3遍,得到的菌体放入-80℃超低温冰箱中过夜,然后进行冷冻干燥得到干菌体,冷冻干燥程序为∶首先以0.5℃/min由室温降至-40℃,预冻40h,然后以0.15℃/min由-40℃升温至-25℃并保持9h,再以 0.15℃/min由-25℃升温至-10℃;继而以0.3℃/min由-10℃升温至25℃并保持4h,最后以0.5℃/min至室温保持4h。每升发酵液中干菌体的重量即为菌体生物量。
1.3.2 高山被孢霉菌体中脂肪酸组成及含量的测定称取(0.0600±0.0004)g高山被孢霉菌体,加入1mg/ mL的17∶1脂肪酸标准品200μL,采用B&D法[5]提取粗脂质;在提取出的粗脂质中加入1mL 0.5mol/L KOH-MeOH溶液,70℃水浴30min,然后加入2mL 25%(v/v)BF3-MeOH溶液,70℃水浴20min进行脂肪酸甲酯化,水浴后加入正己烷2mL,饱和氯化钠溶液4mL,分离得到脂肪酸甲酯溶液。脂肪酸甲酯分析采用气相色谱 GC-2010,色谱柱为 DB-Waxetr (30m×0.32mm,0.25μm)。氢火焰离子检测器检测,汽化室和检测器温度分别为250℃和260℃,分流方式进样1μL,分流比10∶1,载气为氮气。程序升温∶初始温度120℃保持3min,以5℃/min升到190℃,再以1℃/min升到210℃,保持15min。高山被孢霉中脂肪酸甲酯气相色谱分离图谱见图1。

图1 高山被孢霉中脂肪酸甲酯气相色谱图
1.3.3 其他测定 还原糖测定采用DNS法[6];含氮量测定采用微量凯式定氮法GB/T 5009.5-2003。
2 结果与讨论
2.1 高山被孢霉生长过程分析
高山被孢霉在发酵基本培养基中20℃、200r/min摇瓶培养168h,测定细胞生长曲线、脂肪酸生成曲线、残糖和残氮曲线,如图2所示。高山被孢霉在整个培养过程中主要分为四个阶段。第一阶段(0~12h),细胞生长处于延滞期,培养液中固态的脱脂豆粉逐渐水解为液态。第二阶段(12~72h),葡萄糖和脱脂豆粉大量消耗,菌体的生物量迅速增加,随细胞生长单位菌体中脂肪酸含量增加并逐渐趋于稳定达13.8%。第三阶段(72~120h),发酵液中可利用氮源逐渐耗尽,葡萄糖消耗速率减缓由对数期的11g/L· d降至5g/L·d,菌体中脂肪酸的比例开始大幅度的增加。在氮源充足时转化效率为11g脂肪酸/100g葡萄糖,当氮源缺乏时转化效率达到18g脂肪酸/ 100g葡萄糖,因此氮源缺乏时葡萄糖可以更高效地用于脂积累,但与理论值32g脂肪酸/100g葡萄糖有一定的差距[7]。第四阶段(144~168h),发酵培养基中氮源和葡萄糖均已耗尽,生物量迅速减少。
2.2 不同培养时间下高山被孢霉单位菌体脂肪酸组成分析
很多微生物趋于以脂质形式贮存它们获得的能量,因此有必要研究培养时间对高山被孢霉发酵生产的脂肪酸组成的影响。单位菌体中的脂肪酸组成情况见图3,各种脂肪酸的产量随菌体所处的生长阶段的不同而发生改变。AA在不同的生长阶段的脂积累情况为∶当氮源充足时,AA随着细胞的生长缓慢的增加;当无可利用氮源时,细胞停止生长,AA随FA的大幅度增加而大量积累,由最初的7.7%经过了7d的培养达到最大值25.9%,单位菌体中AA含量从培养的第4d开始大量增加的同时伴随着主要是亚油酸含量的减少。EPA在不同生长阶段的脂积累情况∶在整个生长阶段EPA含量较低,在第4d达到最大值仅有0.637mg/g干菌体。硬脂酸和软脂酸等饱和脂肪酸在氮源耗尽后在总脂肪酸中的比例开始大幅增加,在葡萄糖耗尽后降低。硬脂酸、软脂酸等脂肪酸在第6~7d开始缓慢下降,其可能原因是培养基中无可利用的葡萄糖,菌体通过分解自身的部分脂肪酸来获得生长所需要的能量。Ratledge等研究表明,当氮源充足时,葡萄糖进入三羧酸循环,产油微生物利用进行菌体生长,PUFA为初级代谢产物且产量与细胞生长相关,因此氮源充足时PUFA随菌体生长在总脂肪酸中比例略有增加;当培养基中无可利用氮源时,产油微生物能够将剩余的碳源都有效地转化为了脂肪酰CoA,最终形成三酰甘油酯,从而可以解释脂肪酸的大幅度增加[7]。2.3 接种量的确定
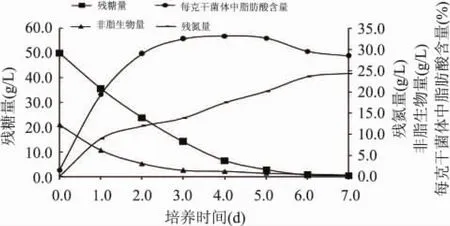
图2 高山被孢霉的生长曲线
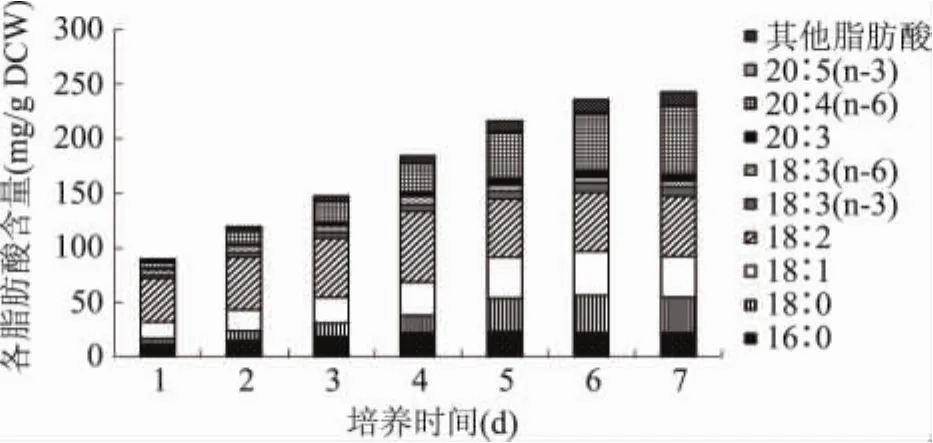
图3 不同培养时间下高山被孢霉单位菌体中脂肪酸的组成情况
高山被孢霉产孢子量只能达到104,且存在孢子萌发情况不一的问题,为了使实验结果可在合作方实验室重现,需要建立高山被孢霉接种的标准化方法。因此我研究中心以菌体湿重作为接种量的衡量标准,建立了菌体打碎后定时生长、定量接种来实现菌种的标准化培养方法。在菌体打碎后,分别以1、2、4、6g/L菌体湿重接种于种子培养基,然后再以10%的接种量接种于发酵培养基,研究不同接种方式对于高山被孢霉菌体生长和产脂的影响,结果见表1。不同菌球直径的菌体接种于发酵培养基,菌体生物量没有显著性差异,随着接入菌球直径的减小,AA产量增加。同时发酵过程中发现,接入小直径菌球培养物的生长速率大于接入大菌球的培养物,随培养的进行,培养菌体形态的差异性逐渐变小。可能的原因是,培养初期,由于只有菌球外部菌丝体具有生长的能力,因而小菌球的生长速率远远大于大菌球。培养过程中,菌丝体断裂,形成新的生长点,而发酵培养基中营养丰富,后期培养物差异性逐渐变小。Higashiyama对于高山被孢霉的研究表明1~2mm菌球直径的菌体最利于AA生产[8]。综上,采用6g/L湿菌接种于种子培养基。
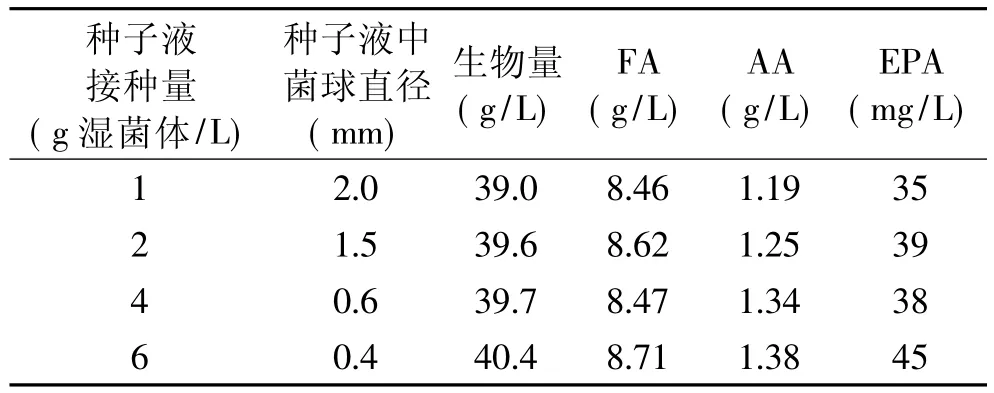
表1 不同接种量对高山被孢霉细胞生长和产脂的影响
2.4 不同碳源对高山被孢霉生长和产脂的影响
分别以5%的非粮食来源甘油和木糖作为唯一碳源,研究不溶碳源对菌体生长的影响。从表2中我们可以看出,葡萄糖为最佳碳源,同时高山被孢霉能很好地利用甘油进行脂积累,菌体生物量为31.6g/L,略低于葡萄糖的39.2g/L。在生物油脂的生产过程中会产生大量的粗甘油,粗甘油用于单细胞油脂生产可以直接进入提取步骤,而提取是单细胞油脂加工工艺中成本最高的一项[9]。因此,以甘油替代或部分替代葡萄糖作为高山被孢霉工业化生产的原料,将大大降低生产成本,这有待于进一步研究。
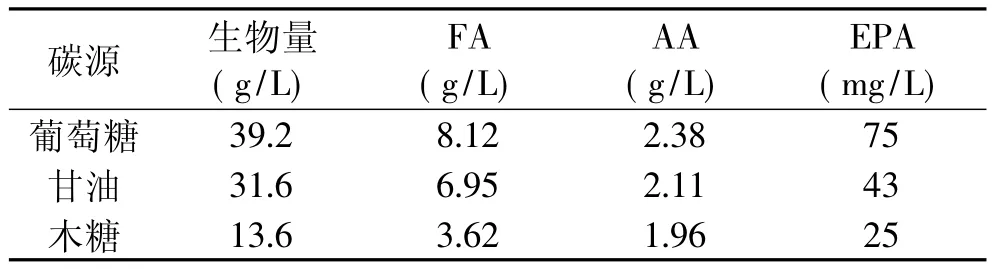
表2 不同碳源对高山被孢霉细胞生长和产脂的影响
2.5 复合氮源比例的确定
PUFA是胞内产物,在PUFA的商业化生产中提高PUFA产量需要提高菌体浓度。有机氮源脱脂豆粉有利于高山被孢霉细胞生长,但羽状的菌丝体大大增加了发酵液的粘稠度,影响了氧和养分的传递和发酵液的均一性[10]。Jang等研究表明KNO3是用于AA和PUFA生产的最佳无机氮源,钾离子有助于硝酸根的吸收[11]。因此,希望通过以无机氮源部分替代有机氮源来降低发酵液的粘稠度,同时可以降低生产成本。
由表3可知,通过改变脱脂豆粉和KNO3的比例,培养发现菌体形态、非脂生物量和脂肪酸组成有较大差异。随KNO3比例的增加,菌丝体形态分别呈现羽状、大的菌团,表面逐渐光滑的菌球。当有机氮源与无机氮源的比例为5∶1时,菌体形成一个大的菌团,生物量大幅度下降到25.6g/L,下降了32%,脂肪酸产量也随之下降。其他不同氮源配比的高山被孢霉菌均形成小菌球,随着KNO3比例的提高,发酵液的粘稠度降低,AA的含量增加。造成这种差异可能的原因是∶不同配比的氮源改变了菌体表面的电荷状况从而造成菌体形态的差异。细胞壁电斥力和细胞聚集与分散水平有关系,在根霉[12]和酿酒酵母[13]的培养中已经发现。菌体形态的改变可影响菌体对于营养和氧的摄入,当菌球半径超过一定的值时,密实菌球区域可能受到培养基的限制而抑制生长。Hamanaka等采用FITC异硫氰酸荧光素和尼罗红对高山被孢霉菌球进行染色分析菌丝中脂质体的分布,发现菌丝内部中心为一空穴,而脂存在于菌球边缘菌丝密集处[14]。中心的空腔是由于长期处于营养和氧气匾乏状态下死亡自溶而导致的。当菌体形态呈分散均匀的小球时,随KNO3比例的增加每克非脂生物量所需要的豆粕粉的量减少,由此可见KNO3以适宜的比例替代豆粕粉有助于非脂生物量的提高。当有机氮源与无机氮源比例为2∶1时,脂肪酸产量、AA和 EPA大幅度提高分别为11.97、5.06g/L和38mg/L(表3),分别提高了0.38、3.29和0.31倍。因此,当脱脂豆粉与KNO3比例为2∶1时有利于高山被孢霉脂肪酸的生产。

表3 不同氮源比例对高山被孢霉生物量和FA、AA和EPA产量的影响

表4 高山被孢霉各脂肪酸组成
2.6 搅拌速率的确定
高山被孢霉为好氧性丝状真菌,在培养过程中需要通过搅拌桨来使气体分散提供满足细胞生长和产脂的需要,同时菌体在搅拌桨剪切力的作用下菌丝体断裂,断裂的菌丝体片段形成新的生长点继续生长,因此不同的搅拌速率将形成不同的菌体形态,影响到细胞生长和脂肪酸的产量。本研究采用六直叶搅拌桨,去除挡板(菌丝体在发酵的过程中易附着在挡板上进行生长,故去除挡板)分别选取了100、200、300r/min三个搅拌速度进行研究。随着发酵的进行,发酵液中细胞浓度不断增加,在使用100r/min培养时,靠近发酵罐罐壁有大量菌体形成团状,影响了发酵液中养料和氧的传递。当搅拌速率为200或300r/min时,菌体可以很好地分散成均匀的小球,为了减少搅拌过程中对菌体的伤害,选择200r/min。
2.7 3L发酵罐批发酵放大实验
在前期摇瓶培养的基础上,采用3L发酵罐进行放大实验,装液量为1.5L,通气量为0.5vvm,搅拌速率200r/min,采用自动消泡,消泡剂为聚氧硅烷。脱脂豆粉20g/L,KNO310 g/L,其他同基本培养基,经过6d发酵,菌体生物量为34.9g/L,FA和AA分别为11.20、5.89g/L,各脂肪酸组成见表4。
3 结论
本研究首先对高山被孢霉在基本发酵培养基中的生长特性进行了研究,氮源耗尽前后葡萄糖转化为脂肪酸的效率分别为11%和18%。采用基本发酵培养基菌体形态为放射羽状,菌体生物量达到39g/L,但发酵液粘稠度大,不利于传质传氧。研究采用6g湿菌体每升发酵液接种,KNO3替代脱脂豆粉1∶2(w/w),200r/min的搅拌速率,发酵过程中的菌体形态为更利于传质传氧的毛绒小球,菌体生物量为34.9g/L,FA和AA分别为11.20、5.89g/L,其中AA产量提高了约4.0倍。
[1]Salvati S,Attorri L,Di Benedetto R,et al.Polyunsaturated fatty acids and neurological diseases[J].Mini Reviews in Medicinal Chemistry,2006,6(11):1201-1211.
[2]Vanden Heuvel J.Diet,fatty acids,and regulation of genes important for heart disease[J].Current Atherosclerosis Reports,2004,6(6):432-440.
[3]Laurent-Jaccard A.Are PUFAs n-3 really important in diet?[J].Revue m,dicale suisse,2006,2(59):839.
[4]Weber H,Selimi D,Huber G.Prevention of cardiovascular diseases and highly concentrated n-3 polyunsaturated fatty acids (PUFAs)[J].Cardiovascular benefits of omega-3 polyunsaturated fatty acids,2006:99.
[5]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian Journal of Biochemistry Physiology,1959,37(8):911-917.
[6]MillerG L.Use ofdinitrosalicylic acid reagentfor determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[7]Ratledge C,James P W.Advances in applied microbiology[M].United Kingdom Elsevier Science,2005.
[8]Hwang B H,Kim J W,Park C Y,et al.High-level production of arachidonic acid by fed-batch culture of Mortierella alpina using NH4OH as a nitrogen source and pH control[J]. Biotechnology Letters,2005,27(10):731-735.
[9]Loglio G,Pandolfini P,Miller R,et al.Optical Observation of High-Frequency Drop Oscillations by a Spectrum Compression Technique applied to the Capillary Pressure Tensiometry[J]. Langmuir,2009,25(21):12780-12786.
[10]Vardar F.Problems of mass and momentum transfer in large fermenters[J].Process Biochemistry,1983,18(5):21-23.
[11]Jang H,Lin Y,Yang S.Effect of culture media and conditions on polyunsaturated fatty acids production by[J].Bioresource Technology,2005,96(15):1633-1644.
[12]Kosakai Y,Park Y,Okabe M.Enhancement of L(+)-lactic acid production using mycelial flocs of Rhizopus oryzae[J]. Biotechnology and Bioengineering,1997,55(3):461-470.
[13]Smart K,Boulton C,Hinchliffe E,et al.Effect of physiological stress on the surface properties of brewing yeasts[J].Journal of the American Society of Brewing Chemists,1995,53(1):33-38.
[14]Hamanaka T,Higashiyama K,Fujikawa S,et al.Mycelial pellet intrastructure and visualization of mycelia and intracellular lipid in a culture of Mortierella alpina[J].Applied Microbiology and Biotechnology,2001,56(1-2): 233-238.
The preliminary study of fermentation conditions for polyunsaturated fatty acids production by Mortierella aplina
ZHANG Jing,ZHAO Jian-xin,CHEN Hai-qin,CHEN Wei,ZHANG Hao*
(School of Food Science and Technology,Jiangnan University,State Key Laboratory of Food Science and Technology,Wuxi 214122,China)
Mortierella alpina yielded high amount of lipid and many kinds of fatty acids.To improve the production of polyunsaturated fatty acids,the effect of carbon source,nitrogen source on the polyunsaturated fatty acids(PUFA) contents of Mortierella alpina were studied.The results showed that glycerine could be used as a substitute for glucose for Mortierella alpina industrial production of PUFA.When the ratio of defatted soybean powder and KNO3reached 2∶1,it improved dry cell weight productivity and fatty acids contents in cell,fatty acids and AA productivity reached 11.20g/L and 5.89g/L,AA productivity increased by 4.0 times.
Mortierella alpina;polyunsaturated fatty acids;arachidonic acid
TS201.3
A
1002-0306(2011)11-0216-04
2010-10-18 *通讯联系人
张静(1985-),女,硕士研究生,主要从事油脂微生物方面的研究。

