小干扰RNA沉默hPTTG1基因对卵巢癌细胞增殖和凋亡的影响*
刘 洁, 沈文静, 卢 瑶, 赵 恂, 宋 敏
(中国医科大学1实验技术中心,2附属第一临床学院妇科,3病理教研室, 辽宁 沈阳 110001)
小干扰RNA沉默hPTTG1基因对卵巢癌细胞增殖和凋亡的影响*
刘 洁1△, 沈文静2, 卢 瑶1, 赵 恂1, 宋 敏3
(中国医科大学1实验技术中心,2附属第一临床学院妇科,3病理教研室, 辽宁 沈阳 110001)
目的利用RNA干扰技术沉默人垂体瘤转化基因1(hPTTG1)表达,观察卵巢癌细胞增殖能力和细胞凋亡的改变并探讨分子机制。方法化学合成靶定hPTTG1的小干扰RNA(siRNA)转染体外培养的A2780细胞,RT-PCR和Western blotting检测hPTTG1及c-myc表达水平;MTT法和[3H]-TdR掺入实验检测hPTTG1对细胞增殖的影响;annexin V/PI染色流式细胞术和TUNEL法测定各组细胞凋亡情况。结果hPTTG1 siRNA转染组hPTTG1 mRNA和蛋白表达下降,抑制率分别为70.5%±3.9%和63.8%±4.5%;转染hPTTG1 siRNA 24 h细胞吸光度值开始下降,48 h抑制效果最明显,抑制率为42.9%±5.2%;转染hPTTG1 siRNA后细胞[3H]-TdR放射性计数明显低于空白组和阴性对照组;hPTTG1 siRNA干扰组细胞存活率下降,细胞凋亡率和坏死率均增加;TUNEL染色分析结果可见hPTTG1 siRNA干扰组凋亡指数明显高于空白组和阴性对照组;hPTTG1干扰后c-mycmRNA和蛋白表达均下调。结论hPTTG1 siRNA通过下调c-myc表达抑制A2780细胞增殖,诱导细胞凋亡,hPTTG1可作为卵巢癌基因治疗的候选靶点。
基因,人垂体瘤转化; 卵巢肿廇; 细胞增殖; 细胞凋亡;c-myc
卵巢癌是死亡率最高的妇科肿瘤,其发病率较高,诊治困难,传统的治疗手段疗效差且复发率极高,以免疫治疗和基因治疗为代表的生物治疗显示出一定的优越性。人垂体瘤转化基因1(human pituitary tumor-transforming gene,hPTTG1)广泛参与多种肿瘤的发生发展[1-3],已有研究证实卵巢癌组织中hPTTG1异常高表达,且与较晚的手术病理分期和淋巴结转移有关[4,5],提示其可作为卵巢癌基因治疗的新靶点[6]。本研究选用RNA干扰技术,合成靶定hPTTG1基因的特异小分子干扰RNA(small interfering RNA,siRNA),转染卵巢癌细胞株A2780,观察其对卵巢癌细胞增殖和凋亡的影响,并探讨机制。
材 料 和 方 法
1材料
1.1细胞株 人卵巢癌细胞株A2780由中国医学科学院肿瘤研究所提供。
1.2主要试剂hPTTG1 siRNA及阴性对照siRNA(sense:3’-AlexaFluor488)由南京凯基公司合成;羊抗人hPTTG1蛋白多克隆抗体、鼠抗人c-Myc单克隆抗体、增强型化学发光(ECL)试剂盒购自Santa Cruz;hPTTG1、c-myc和内参照GAPDH引物由上海生物工程技术服务有限公司合成;RPMI-1640、胎牛血清、opti-MEM购自Gibco-BRL;Trizol、RNase H、SuperScriptTMⅢ first-strand synthesis cDNA kit和Lipofectamine 2000购自Invitrogen;KOD FX DNA PCR试剂购自Toyobo;分子量标志物购自Fermentas;辣根过氧化物酶标记Ⅱ抗购自北京中杉金桥生物有限公司;β-巯基乙醇、苯甲基磺酰氟(PMSF)、四甲基偶氮唑盐(MTT)购于Sigma;[3H]-TdR购于中国原子能研究所; 膜连蛋白V-异硫氰酸荧光素(Annexin V-FITC)细胞凋亡检测试剂盒购自南京凯基公司;TUNEL染色试剂盒购自Boehringer Mannheim。
2方法
2.1细胞培养 A2780细胞用含10%胎牛血清、1×105U/L青霉素及100 mg/L链霉素的RPMI-1640培养,置于37 ℃、5% CO2饱和湿度细胞培养箱中培养,待细胞达到85%汇聚时用0.25%胰蛋白酶消化传代。在6孔细胞培养板中按照2×105cells/well的密度接种细胞,每孔加入1.5 mL不含抗生素和血清的RPMI-1640培养液常规培养24 h,待细胞达到50%左右融合时,弃去原培养液用opti-MEM轻洗2次,参照Lipofectamine 2000说明书进行细胞转染。
2.2siRNA转染hPTTG1 siRNA: 正义链 5’-GACCUGCAAUAAUCCAGAAdTdT-3’,反义链 5’-UUCUGGAUUAUUGCAGGUCdTdT-3’。将细胞分为hPTTG1干扰组(转染hPTTG1 siRNA)、阴性对照组(转染阴性对照siRNA)和空白对照组(未进行细胞转染)。首先用阴性对照siRNA优化转染体系,将100 pmol siRNA 用250 μL无抗生素、无血清opti-MEM培养液稀释,轻混,室温静置5 min;在250 μL无抗生素、无血清opti-MEM培养液中稀释5 μL Lipofectamine 2000转染试剂,轻混,室温静置5 min;混合稀释的siRNA 和转染试剂,室温静置20 min,将500 μL转染复合物加入到6孔细胞培养板中,混合均匀,置于37 ℃、5% CO2培养箱中培养,转染6 h后更换含10%胎牛血清的DMEM培养液继续培养48 h后进行实验检测。
2.3RT-PCR检测hPTTG1和c-myc表达 由GenBank检索目的基因序列,利用Primer-BLAST在线设计引物,序列如下:hPTTG1上游引物 5’-CGGCTGTTAAGACCTGCAAT-3’,下游引物 5’-GGCAGGAACAGAGCTTTTTG-3’, 产物长度346 bp;c-myc上游引物 5’-ACGGCCGACCAGCTGGAGAT-3’, 下游引物 5’-TGGGCGAGCTGCTGTCGTTG-3’, 产物长度334 bp;同时以3-磷酸甘油醛脱氢酶(GAPDH)作为内参照,上游引物 5’-CAGTCAGCCGCATCTTCTT-3’,下游引物 5’-TGGAAGATGGTGATGGGATT-3’,产物长度288 bp。参照Trizol试剂说明书提取各组细胞总RNA,紫外分光光度计测定A260和A280值,计算其浓度和纯度,每一样品重复3次。利用oligo(dT)20引物和SuperScriptTMⅢ试剂盒逆转录成 cDNA,在10 μL 反应体系中按照KOD FX DNA polymerase试剂盒说明书进行PCR扩增,反应条件为: 94 ℃ 2 min,94 ℃15 s,60 ℃ 30 s,72 ℃ 1 min,33个循环,72 ℃ 5 min。PCR产物经2%琼脂糖电泳检测,EB染色后利用自动电泳凝胶扫描分析系统测定电泳条带的积分吸光度值(integrated absorbance,IA),实验重复3 次,取hPTTG1IA/GAPDHIA平均值作为其mRNA表达水平的相对值。
2.4Western blotting检测hPTTG1和c-Myc蛋白表达 收集转染后的3组细胞,冷PBS冲洗后,蛋白裂解液(50 mmol/L Tris-HCl、50 mmol/L NaCl、0.1% SDS、0.02%NaN3、100 mg/L PMSF、1%NP-40、1 mg/L aprotinin)提取细胞总蛋白,冰浴30 min裂解混匀、4 ℃ 12 000 r/min离心10 min后,按照DC protein assay试剂说明行总蛋白测定,SDS-PAGE电泳后,半干转印到硝酸纤维素膜,5%脱脂奶粉封闭2 h后,加入第Ⅰ抗体(hPTTG 1∶200,c-Myc 1∶200,GAPDH 1∶500)室温孵育2 h,PBST洗膜后加入1∶5 000稀释的第Ⅱ抗体孵育1 h,PBST洗膜后,ECL显色曝光并通过X线胶片曝光洗片,经自动电泳凝胶分析系统扫描并测定杂交条带IA,实验重复3 次,将hPTTG1IA/ GAPDHIA平均值作为其蛋白表达水平的相对值。
2.5MTT测定细胞增殖 胰酶消化对数生长期细胞,制备浓度为1×108cells/L单细胞悬液,96孔板每孔接种100 μL,基因沉默方法同前,测定转染后24 h、48 h、72 h和96 h细胞增殖活性。在距离时间点结束4 h时小心吸去上清,加入80 μL无血清opti-MEM培养液,再加入20 μL MTT溶液(5 g/L),继续培养4 h,然后吸掉上清,每孔加入150 μL二甲基亚砜,置摇床上低速振荡10 min,使结晶物充分溶解,混匀后以酶标仪于570 nm处读取各孔吸光度值(A570),每组设定3个复孔,按下面公式计算细胞生长抑制率,细胞生长抑制率(%)=[1-(实验组A570均值/对照组A570均值)]×100%,以时间为坐标横轴,吸光度值为坐标纵轴绘图。
2.6[3H]-TdR 掺入实验分析细胞增殖 转染后48 h细胞更换无血清培养基同步化处理24 h,每孔加入3.7×104Bq [3H]-TdR继续培养16 h,吸弃上清,PBS冲洗,胰酶消化后将细胞抽滤到玻璃纤维素滤膜上,PBS冲洗,5%三氯醋酸固定,无水乙醇脱色脱水,滤膜烘干后加入闪烁液,用液闪烁计数仪测定[3H]每分钟放射性计数值(counts/min)。
2.7Annexin V-FITC检测细胞凋亡 转染后细胞PBS洗涤,2 000 r/min离心5 min收集1×105细胞,用500 μL 1×binding buffer悬浮细胞,加入1 μL Annexin V-FITC混匀后加入5 μL 碘化丙啶(propi-dium iodide,PI),然后混匀,避光室温反应5 min,流式细胞仪检测细胞凋亡,FITC绿色荧光通道用FL2检测,PI红色荧光通道用FL1检测。
2.8TUNEL染色检测细胞凋亡 将消毒灭菌的载玻片放置在6孔培养板上,细胞接种和转染步骤同前,取出细胞爬片,4%多聚甲醛固定,0.1%Triton-X100透膜,按照试剂盒说明进行操作,通过显微图像分析系统采集图像并计数凋亡细胞占总细胞数的百分比,取其平均值作为各组细胞的凋亡指数。
3统计学处理
结 果
1hPTTG1siRNA对A2780细胞hPTTG1mRNA表达的影响
RT-PCR结果显示,hPTTG1干扰组A2780细胞内hPTTG1目的基因电泳条带密度减弱,mRNA表达水平降低,其mRNA抑制率为70.5%±3.9%。hPTTG1干扰组hPTTG1 mRNA表达量为0.27±0.09,显著低于空白组(0.91±0.03)和阴性对照组(0.89±0.06)(n=3,P<0.05),而阴性对照组和空白组间无显著差异(n=3,P>0.05),见图1。
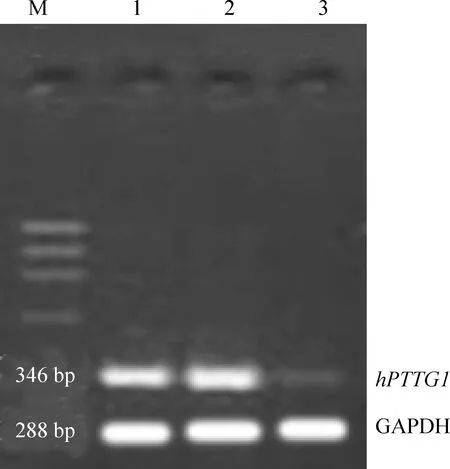
Figure 1. The expression ofhPTTG1 mRNA in A2780 ovarian cancer cell afterhPTTG1 siRNA transfection. M:ФX174 /HaeIII DNA marker; Lane 1:normal; Lane 2: negative siRNA; Lane3:hPTTG1siRNA.
图1转染hPTTG1siRNA后A2780细胞内hPTTG1mRNA表达
2hPTTG1siRNA对A2780细胞中hPTTG1蛋白表达的影响
Western blotting 结果显示,hPTTG1干扰组中hPTTG1蛋白杂交条带信号降低,蛋白表达水平下降,其蛋白表达抑制率为63.8%±4.5%;hPTTG1干扰组中hPTTG1蛋白表达量为0.30±0.04,显著低于空白组(0.82±0.04)和阴性对照组(0.78±0.02)(n=3,P<0.05),而阴性对照组与空白组间无显著差异(n=3,P>0.05),见图2。
3hPTTG1siRNA对A2780细胞增殖的影响
MTT结果显示hPTTG1干扰组细胞增殖速度较其它2组细胞慢,各时点吸光度值明显低于空白和阴性对照组,显著差异(n=3,P<0.05),而阴性对照组与空白组间吸光度值无显著差异(n=3,P>0.05)。转染hPTTG1 siRNA 24 h细胞吸光度值开始下降,24 h细胞抑制率为24.3%±3.7%;48 h抑制效果最明显,抑制率为42.9%±5.2%;48 h后抑制效应减弱,增殖速度有所提高,但仍低于空白和阴性对照组;72 h、96 h细胞抑制率分别为30.3%±2.9%和24.8%±5.4%,各时点的吸光度值曲线见图3。
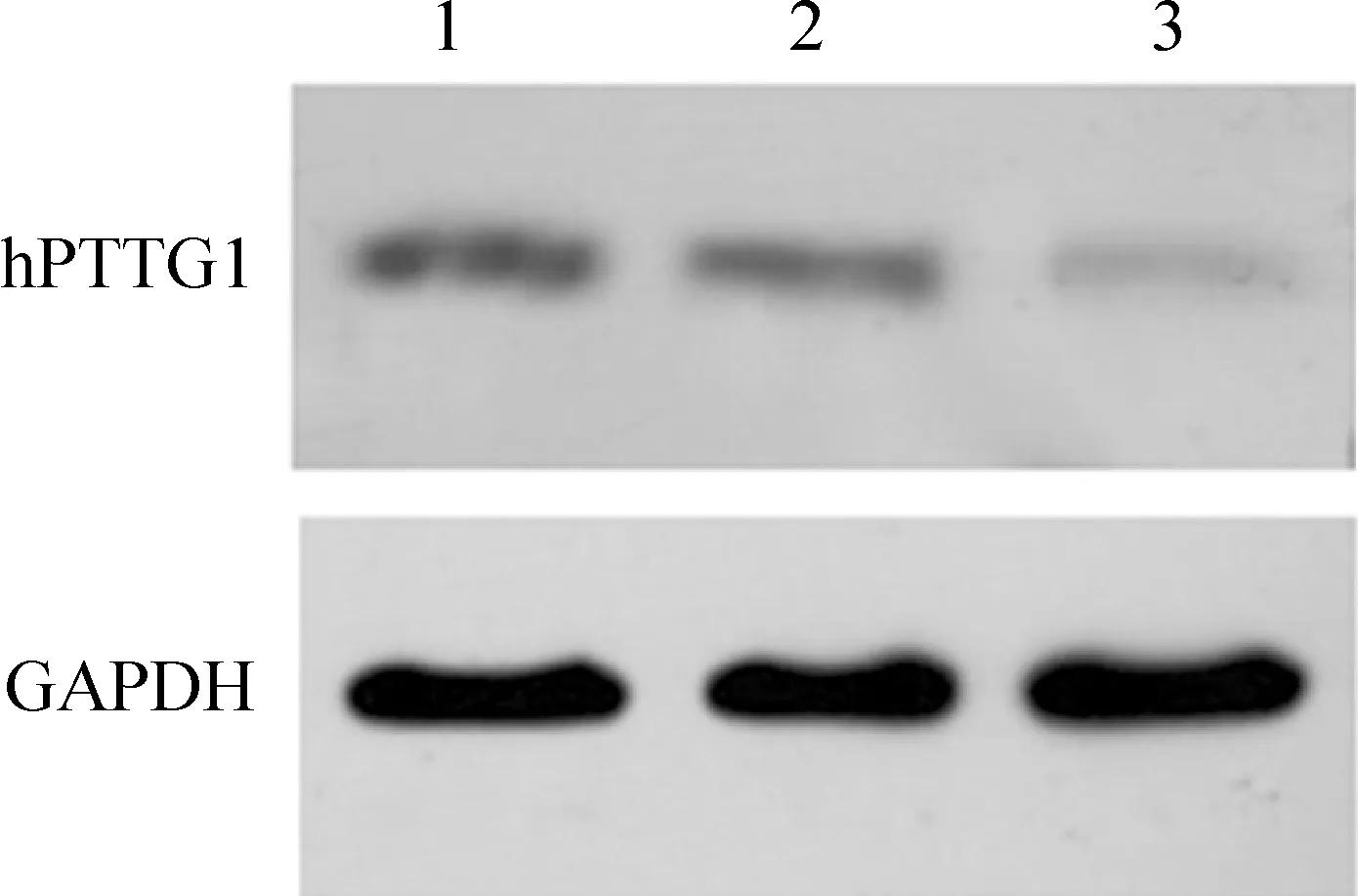
Figure 2. The expression of hPTTG1 protein in A2780 ovarian cancer cell afterhPTTG1 siRNA transfection. Lane 1:normal;Lane 2:negative siRNA;Lane 3:hPTTG1 siRNA.
图2转染hPTTG1siRNA后A2780细胞内hPTTG1蛋白表达

图3转染hPTTG1siRNA对A2780细胞增殖的作用
4hPTTG1siRNA对A2780细胞[3H]-TdR掺入量的影响
与空白组和阴性对照组相比,hPTTG1 siRNA转染组A2780细胞[3H]-TdR放射性强度明显降低,差异显著(n=3,P<0.05);空白组和阴性对照组间放射性强度比较无显著差异(n=3,P>0.05)。hPTTG1 siRNA转染组放射性强度为(758.0±28.7)counts/min,空白组和阴性对照组分别为(1 327.0±109.5)counts/min和(1 164.0±98.3)counts/min,表明hPTTG1 siRNA转染后细胞的DNA合成水平下降,细胞增殖受抑。
5hPTTG1siRNA对A2780细胞凋亡的影响
hPTTG1 siRNA干扰组细胞存活率下降,细胞凋亡率和坏死率均增加,与空白和阴性对照组相比均有显著差异(n=3,P<0.05);阴性和空白对照组间细胞凋亡率、坏死率及存活率比较无显著差异(n=3,P>0.05),见图4、表1。
表13组细胞的AnnexinV-FITC染色流式细胞仪分析结果

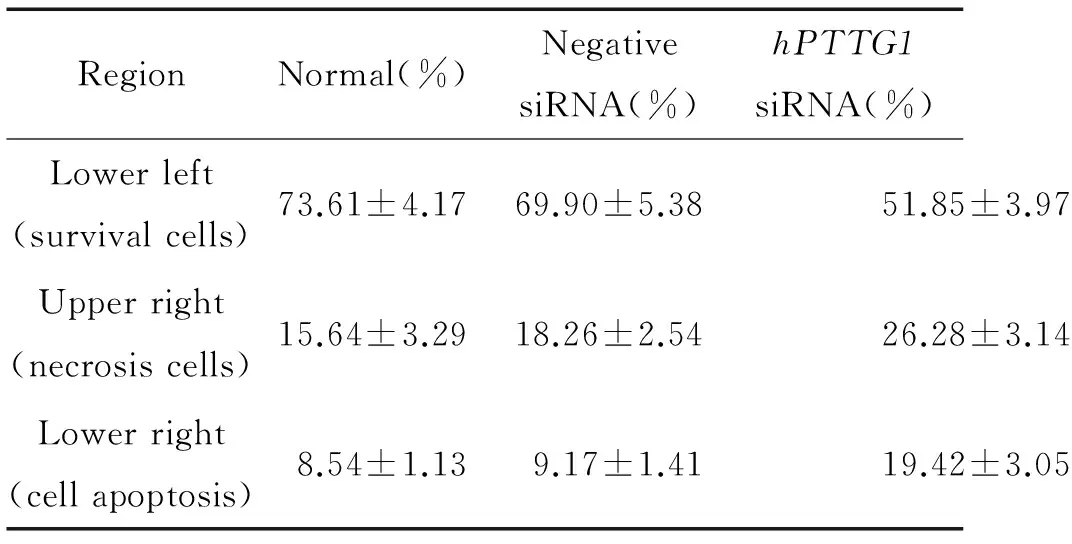
RegionNormal(%)NegativesiRNA(%)hPTTG1siRNA(%)Lowerleft(survivalcells)73.61±4.1769.90±5.3851.85±3.97Upperright(necrosiscells)15.64±3.2918.26±2.5426.28±3.14Lowerright(cellapoptosis)8.54±1.139.17±1.4119.42±3.05

Figure 4. The influence ofhPTTG1 siRNA on the apoptosis of A2780 cells.
图4转染hPTTG1siRNA对A2780细胞凋亡的影响
6细胞凋亡的TUNEL检测结果
空白组和阴性对照组细胞仅见少数胞核呈棕褐色,凋亡指数分别为(7.69±0.85)%和(8.34±1.07)%;hPTTG1 siRNA干扰组胞核阳性染色增多,见图5,凋亡指数为(21.47±1.89)%,与空白组和阴性对照组相比较差异显著(n=3,P<0.05),空白和阴性对照组间无显著差异(n=3,P>0.05), 表明hPTTG1 siRNA可诱导A2780细胞凋亡。

Figure 5. Cell apoptosis of A2780 cell detected by TUNEL staining test(×20).A:normal;B:hPTTG1 siRNA.
图5TUNEL染色检测A2780细胞凋亡
7hPTTG1siRNA对A2780细胞中c-mycmRNA和蛋白表达的影响
hPTTG1干扰后c-mycmRNA和蛋白表达均下调,hPTTG1干扰组c-mycmRNA表达量为0.43±0.07,显著低于空白组(0.78±0.05)和阴性对照组(0.74±0.03),n=3,P<0.05;hPTTG1干扰组c-Myc蛋白表达量为0.51±0.04,显著低于空白组(0.83±0.06)和阴性对照组(0.79±0.05),n=3,P<0.05),而阴性对照组和空白组间mRNA和蛋白无显著差异(n=3,P>0.05),见图6、7。
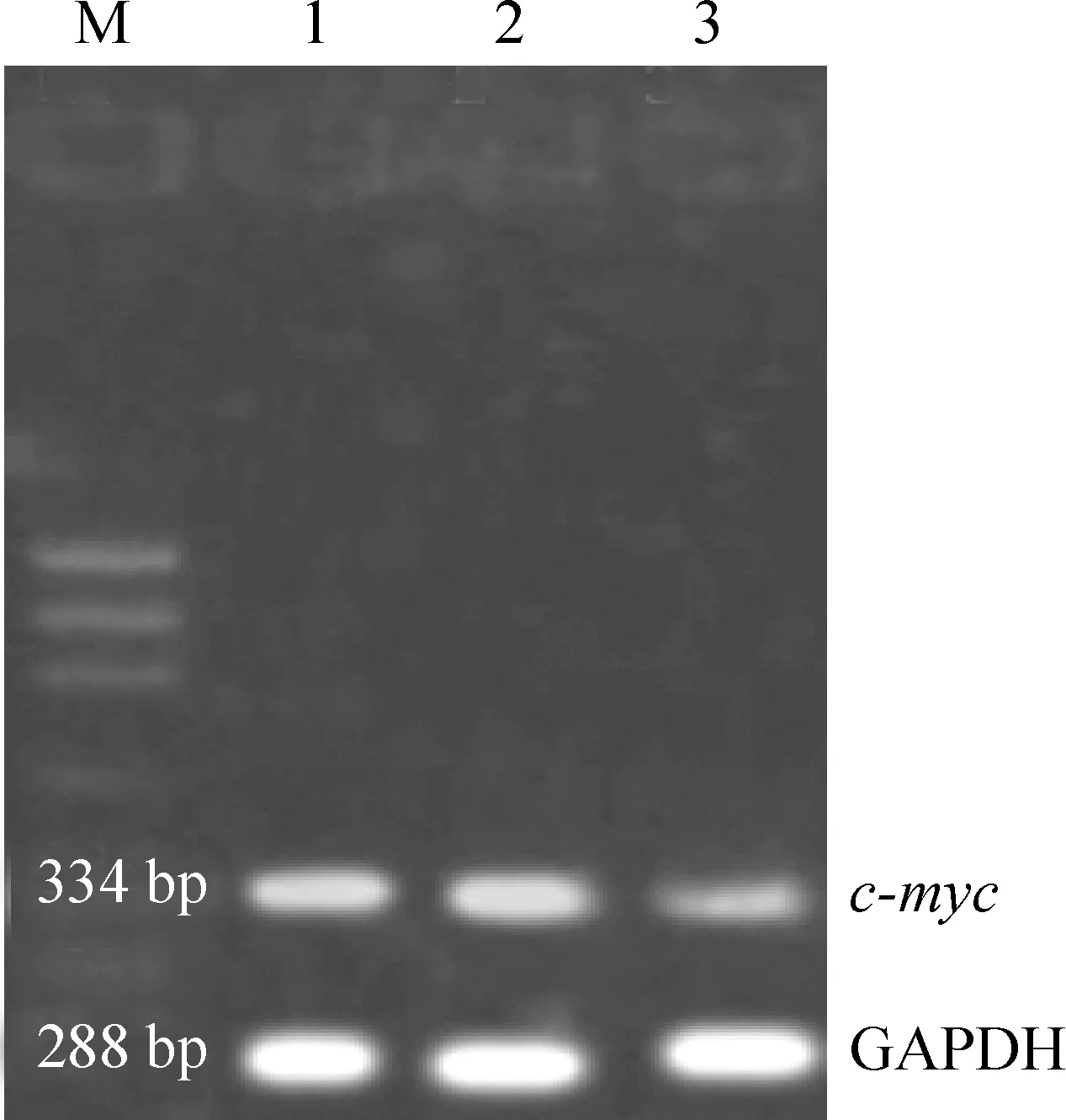
Figure 6. The expression ofc-mycmRNA in A2780 ovarian cancer cells afterhPTTG1 siRNA transfection. M:ФX174 /HaeIII DNA marker; Lane 1:normal; Lane 2: negative siRNA; Lane 3:hPTTG1 siRNA.
图6hPTTG1siRNA转染对A2780细胞内c-mycmRNA表达的影响
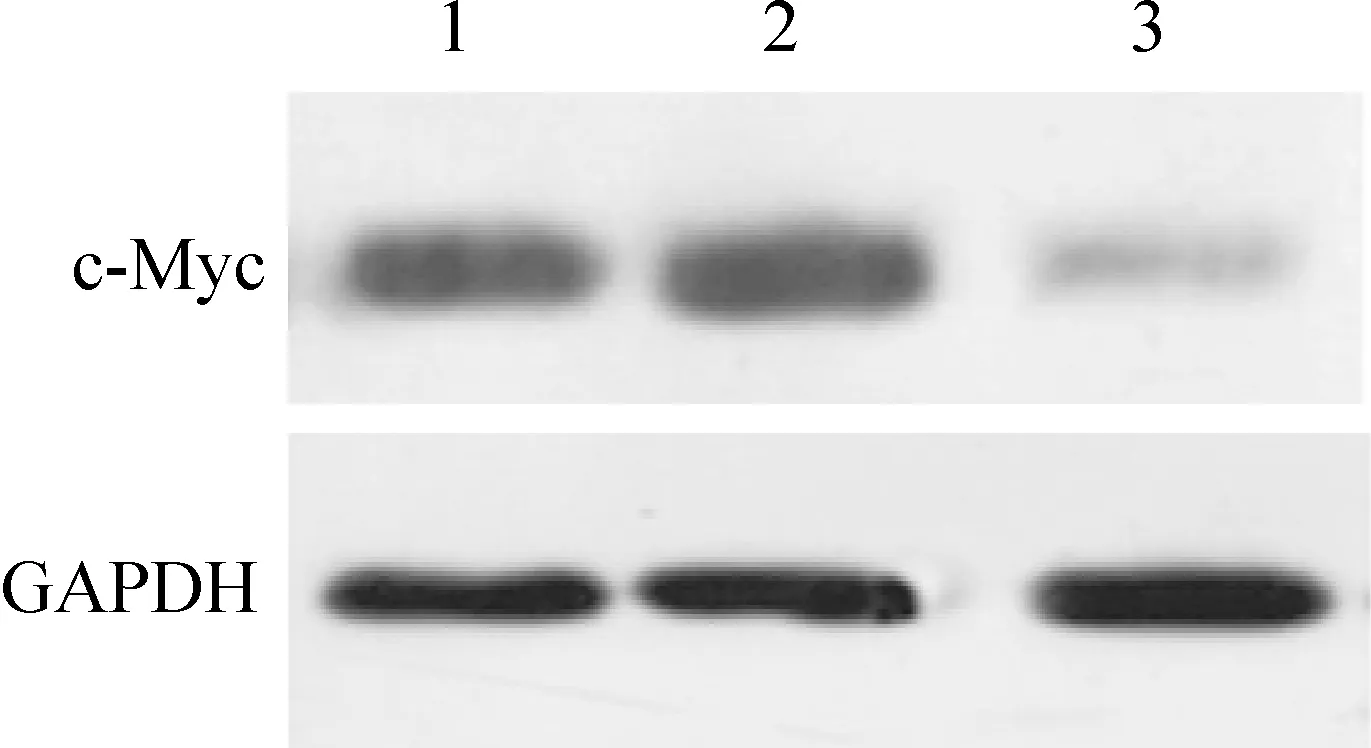
Figure 7. The expression of c-Myc protein in A2780 ovarian cancer cells afterhPTTG1 siRNA transfection.Lane 1:normal;Lane 2: negative siRNA;Lane 3:hPTTG1 siRNA.
图7hPTTG1表达下降对细胞c-Myc蛋白表达的影响
讨 论
hPTTG1定位于5 号染色体长臂5q35.1,在大多数正常成人组织中只有弱表达甚至检测不到,而胚胎肝、睾丸、胸腺中强表达[1-3]。在多种恶性肿瘤组织及细胞株中均检测到hPTTG1异常高表达,其可通过多条途径参与肿瘤演进,并与多种肿瘤的侵袭和转移有关。hPTTG1表达呈细胞周期依赖性,在有丝分裂期达高峰。hPTTG1蛋白是一种封闭素(securin)蛋白,其过表达能够抑制姐妹染色单体分离阻碍有丝分裂,诱导子代细胞非整倍体化和基因不稳定性[7]。作为一种强细胞转化癌基因,hPTTG1还具有激活增殖功能,在无其它辅助癌基因作用下即可引起细胞转化[8]。hPTTG1对细胞凋亡的调控也具有双重作用,其过度表达可引起p53依赖性和p53非依赖性细胞凋亡,还可通过上调survivin表达、抑制p53活性拮抗凋亡[9]。hPTTG1功能的复杂性可能与该基因表达的组织特异性、亚细胞定位、剂量依赖性和蛋白磷酸化状态相关[10]。尽管已有文献证实卵巢癌组织中hPTTG1高表达,但其与卵巢癌增殖和凋亡的关系还未见报道。
RNAi技术能够高效、特异地抑制目的基因表达,已成为基因功能研究和基因治疗的新手段。siRNA为RNAi产生效应的中介分子,目前主要通过化学合成、体外转录、长片段dsRNAs降解、表达载体和PCR制备法获得siRNA[11],经过探索和改进,化学合成法已克服价格昂贵的缺点,并且合成周期短,操作简便,较载体途径的siRNA更为接近临床。本实验将合成的hPTTG1基因siRNA转染A2780细胞,经RT-PCR和Western blotting验证能够在细胞内有效实现其基因沉默效应。hPTTG1基因下调导致细胞生长速度减慢,增殖受抑,48 h抑制效率最高,细胞凋亡率增加,说明hPTTG1下调可以诱导卵巢癌细胞凋亡进而阻抑细胞增殖形成。癌基因c-myc位于人染色体8q24,由3个外显子和2个内含子组成,编码磷酸化蛋白p62,具有促进细胞增殖和凋亡的双重功能,在卵巢癌发生发展中发挥重要作用[12]。hPTTG1可与其它核蛋白组成复合物,直接与c-myc转录起始区结合,激活c-myc转录活性,上调其蛋白表达刺激细胞周期进程,引起细胞转化和肿瘤形成[13]。
本研究还发现hPTTG1干扰后细胞c-mycmRNA和蛋白表达下调,从而抑制细胞增殖和转化。由于卵巢癌的发生发展是一个多阶段逐步演变的过程,涉及多个基因的改变和相互作用,可针对其中起关键作用的基因利用siRNA技术抑制或下调靶基因的表达.从而实现基因治疗的目的[14]。陈刚等[15]将反义hPTTG1真核表达载体转染卵巢癌细胞系SK-OV-3导致其克隆形成率下降。EI-Naggar等[16]研究证实hPTTG1 siRNA稳定转染的A2780细胞增殖能力下降50%,软琼脂克隆形成率下降70%,裸鼠成瘤能力受抑,提示hPTTG1可作为卵巢癌基因治疗的新靶点,关于其调控卵巢癌细胞增殖和凋亡的机制有待进一步深入探讨。
[1] Grossman AB. The molecular biology of pituitary tumors: a personal perspective[J].Pituitary,2009,12(3):265-270.
[2] Kim DS, Franklyn JA, Smith VE, et al. Securin induces genetic instability in colorectal cancer by inhibiting double-stranded DNA repair activity[J]. Carcinogenesis, 2007, 28(3):749-759.
[3] Tfelt HJ, Kanuparthi D, Chattopadhyay N. The emerging role of pituitary tumor transforming gene in tumorigenesis[J]. Clin Med Res, 2006,4(2):130-137.
[4] 王言奎,李 军,崔 娜,等.卵巢上皮性癌组织中PTTG的表达与微血管密度和bFGF的关系[J]. 肿瘤防治杂志,2005,12(12):907-912.
[5] 成夜霞,冯 捷,张辛燕,等.人垂体肿瘤转化基因1在卵巢癌组织中的表达及意义[J]. 癌症,2004,23(9):1026-1030.
[6] Panguluri SK, Yeakel C, Kakar SS. PTTG: an important target gene for ovarian cancer therapy[J]. J Ovarian Res, 2008, 1(1):6.
[7] Bradshaw C, Kakar SS. Pituitary tumor transforming gene: an important gene in normal cellular functions and tumorigenesis [J]. Histol Histopathol, 2007, 22(2):219-226.
[8] Solbach C, Roller M, Peters S, et al. Pituitary tumor-transforming gene (PTTG): a novel target for anti-tumor therapy[J].Anticancer Res, 2005,25(1A):121-125.
[9] Salehi F, Kovacs K, Scheithauer BW, et al. Pituitary tumor-transforming gene in endocrine and other neoplasms: a review and update[J]. Endocr Relat Cancer, 2008, 15(3):721-743.
[10]Hamid T, Kakar SS.PTTG and cancer[J]. Histol Histopathol,2003,18(1):245-251.
[11]孔祥平,Reneker LW.核糖核酸干扰[J].中国病理生理杂志,2004,20(5):900-903.
[12]Bapat SA, Krishnan A, Ghanate AD, et al. Gene expression: protein interaction systems network modeling identifies transformation-associated molecules and pathways in ovarian cancer[J].Cancer Res,2010,70(12):4809-4819.
[13]Pei L. Identification ofc-mycas a down-stream target for pituitary tumor-transforming gene[J].J Biol Chem,2001,276(11):8484-8491.
[14]Boxer LM, Dang CV. Translocations involvingc-mycandc-mycfunction[J].Oncogene,2001,20(40):5595-5610.
[15]陈 刚,李 静,李辅军,等. 反义PTTG真核表达载体对人卵巢癌细胞sk-ov-3恶性表型的抑制作用[J].癌症,2003,22(10):1009-1013.
[16]El-Naggar SM, Malik MT, Kakar SS. Small interfering RNA against PTTG: a novel therapy for ovarian cancer[J].Int J Oncol,2007,31(1):137-143.
EffectofhPTTG1siRNAonproliferationandapoptosisofovariancancercells
LIU Jie1, SHEN Wen-jing2, LU Yao1, ZHAO Xun1, SONG Min3
(1ExperimentalTechnologyCenter,2DepartmentofMaternity,TheFirstAffiliatedHospital;3DepartmentofPathology,ChinaMedicalUniversity,Shenyang110001,China.E-mail:lj6152003@163.com)
AIM: To observe the proliferation and apoptosis of ovarian cancer cells by silencing the expression of human pituitary tumor-transforming gene 1 (hPTTG1) using RNA interference technique.METHODSThe chemically synthesized siRNA targetinghPTTG1 was transfected into ovarian cancer cell line A2780invitro. The expression levels ofhPTTG1 andc-mycwere examined by RT-PCR and Western blotting. Cell proliferation was measured by MTT colorimetric assay and [3H]-TdR incorporation test. Cell apoptosis was detected by flow cytometry with annexin V/PI and TUNEL labeling.RESULTSThe expression ofhPTTG1 at mRNA and protein levels was inhibited after transfection ofhPTTG1 siRNA. The inhibitory efficiency was 70.5%±3.9% and 63.8%±4.5%, respectively. The absorbance began to decrease 24 h after transfection ofhPTTG1 siRNA,and the highest inhibitory rate was 42.9%±5.2% at 48 h post-transfection. Radioactive incorporation of [3H]-TdR inhPTTG1 siRNA group was lower than that in normal and negative groups. The survival rate declined while the apoptotic rate and necrotic rate increased inhPTTG1 siRNA group. Apoptotic index inhPTTG1 siRNA group was higher than that in normal and negative groups. The expression ofc-mycat mRNA and protein levels was down-regulated.CONCLUSIONCell proliferation is inhibited and cell apoptosis is induced byhPTTG1 siRNA through down-regulating the expression ofc-myc.hPTTG1 can be regarded as a candidate gene for ovarian cancer gene therapy.
Genes,human pituitaty tumor-transforming; Ovarian neoplasms; Cell proliferation; Apoptosis;c-myc
R737.31
A
10.3969/j.issn.1000-4718.2011.01.020
1000-4718(2011)01-0102-06
2010-08-16
2010-11-04
辽宁省教育厅科研项目(No.L2010681)
△通讯作者 Tel:024-23256666-5494;E-mail:lj6152003@163.com

