硫化氢对肢体缺血再灌注所致大鼠急性肺损伤的作用及机制*
黄新莉, 仲维佳, 刘清和, 田庆显, 周君琳△
(1 河北医科大学病理生理教研室, 河北 石家庄 050017; 2 首都医科大学附属北京朝阳医院骨科, 北京 100020)
硫化氢对肢体缺血再灌注所致大鼠急性肺损伤的作用及机制*
黄新莉1, 仲维佳2, 刘清和2, 田庆显2, 周君琳2△
(1河北医科大学病理生理教研室, 河北 石家庄 050017;2首都医科大学附属北京朝阳医院骨科, 北京 100020)
目的探讨内、外源性硫化氢(H2S)在肢体缺血再灌注(IR)所致大鼠急性肺损伤(ALI)中的作用并初探其机制。方法应用双大腿根部止血带复制大鼠双后肢缺血及再灌注后肺损伤模型。将120只SD大鼠随机分为对照组(control)、IR组、NaHS+IR组和抑制H2S生成的炔丙基甘氨酸(PPG)+IR组。肢体缺血再灌注后4 h处死动物, 测定肺系数;光镜下观察肺组织形态学改变;化学法检测血浆H2S、NO、CO含量,肺组织丙二醛(MDA)含量、胱硫醚-γ-裂解酶(CSE)、诱导型一氧化氮合酶(iNOS)和血红素加氧酶(HO)活性以及支气管肺泡灌洗液(BALF)中中性粒细胞(PMN)数目和蛋白含量变化,并对血浆H2S含量与上述指标进行相关性分析。结果大鼠肢体IR可引起肺组织明显的形态学改变、肺系数和肺组织MDA含量增加、BALF中PMN数目和蛋白含量增加、血浆H2S含量和肺组织CSE活性下降、肺组织iNOS活性和HO活性及血浆中NO含量和CO含量增加。预先给予NaHS可显著减轻IR所致上述指标的改变; 而预先给予PPG可加重IR所致肺损伤, 使BALF中PMN数目和蛋白含量、血浆NO含量和肺组织iNOS活性进一步增加, 但对血浆CO含量和肺组织HO活性无明显影响。H2S含量与CSE活性、血浆CO含量、肺组织HO活性呈正相关(均P<0.01);与其它指标呈负相关(均P<0.01)。结论H2S/CSE体系的下调参与介导了大鼠肢体IR所致大鼠ALI的发生, 内、外源性H2S具有抗肢体IR所致ALI的作用, 该作用可能与其抗氧化效应、减轻PMN所致肺部过度炎症反应以及下调NO/iNOS体系、上调CO/HO体系有一定关系。
硫化氢; 急性肺损伤; 一氧化氮; 一氧化碳; 胱硫醚γ裂解酶
肢体缺血是临床常见的病理征象,尽管恢复其血液循环是挽救肢体所必须的,但是缺血再灌注(ischemia-reperfusion, IR)不仅可能加重局部缺血组织的损伤,严重时尚可引起全身炎症反应综合征,甚至远隔的多脏器功能障碍综合征,其中肺是易受累的首位靶器官,表现为急性肺损伤(acute lung injury, ALI)甚至急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[1],病死率极高,但其发病机制迄今尚未完全阐明。本室研究发现内源性气体信号分子一氧化氮(nitric oxide, NO)和一氧化碳(carbon monoxide, CO)在此种ALI中发挥重要作用,且二者之间具有交互作用[2-4]。H2S是继NO和CO之后新近发现的第3种气体信号分子[5],参与神经和血管功能调节等多种生理和病理过程[6-8]。但H2S在肢体IR所致大鼠ALI中的作用及其机制尚不清楚。本实验拟检测ALI时H2S及其生成关键酶胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)的变化;并应用H2S供体NaHS和CSE抑制剂炔丙基甘氨酸(propargylglycine, PPG)观察H2S对ALI时肺组织损伤指标、支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)中性粒细胞(polymorphonuclear granulocytes,PMN)计数和蛋白含量以及NO/诱导型NO合酶(inducible nitric oxide synthase, iNOS)、CO/血红素加氧酶(hemeoxygenase, HO)体系变化的影响,以探讨H2S在肢体IR所致ALI中的作用及可能机制。
材 料 和 方 法
1材料
1.1主要试剂 NaHS、炔丙基甘氨酸(propargyl-glycine,PPG)、L-半胱氨酸、5’-磷酸吡哆醛、N,N-二甲基-对苯二胺硫酸盐、血红蛋白、血红素、NADP、6-磷酸葡萄糖和6-磷酸葡萄糖脱氢酶均购自Sigma; NO与CO含量、iNOS与HO活性、丙二醛(malondialdehyde, MDA)含量、考马斯亮蓝检测试剂盒购自南京建成生物公司。
1.2动物 清洁级健康雄性SD大鼠120只,体重200-250 g(购于河北医科大学实验动物中心),自由摄食、饮水,室温18-24 ℃,相对湿度40%-70%,每天12 h光照维持,昼夜循环。
2方法
2.1动物模型 按照Cohen等[9]提供的方法复制肢体IR致ALI动物模型:体重为250-300 g的健康SD雄性大鼠(河北医科大学动物试验中心),苯巴比妥钠(40 mg/kg BW,腹腔注射)麻醉。以橡皮止血带绑扎双后肢根部造成肢体缺血,4 h后松开止血带使肢体血流再灌注。应用激光多普勒(PriFlux 5001型,Perimed)探测血流以保证肢体的缺血和再灌注。
2.2实验分组 实验大鼠适应性喂养1周后, 按窝别随机分为4组(n=16):对照组(control),IR、NaHS+IR和PPG+IR组。对照组动物给予同样的麻醉和操作只是不造成肢体缺血。IR组动物使双后肢缺血4 h后再灌注。对照组和 IR组动物分别于再灌注前10 min和相应的对照时点腹腔注射无菌生理盐水(0.5 mL)。NaHS+IR和PPG+ IR组动物分别于再灌注前10 min腹腔注射NaHS(28 μmol·kg-1, 溶于0.5 mL生理盐水)和PPG(45 mg·kg-1, 溶于0.5 mL生理盐水)。每组各取8只, 于缺血肢体再灌注后4 h行生化和形态学检查,另取8只行支气管肺泡灌洗。
2.3标本制备 实验结束时,放血处死动物,留取血浆以检测H2S、NO和CO含量。取全肺称重以测定肺系数,留取左侧肺叶下部以10%中性甲醛溶液固定,常规石蜡包埋、切片,经HE染色以观察肺组织形态学变化;取左侧肺叶中上部,制备肺组织匀浆,用于检测MDA含量和CSE、iNOS、HO活性。
2.4肺组织中MDA 含量检测 采用硫代巴比妥酸法,按照试剂盒说明书进行操作。
2.5血浆中H2S 含量测定 采用去蛋白的分光光度法[7]。根据H2S标准曲线计算H2S的含量。
2.6血浆中CO含量测定 参照Chalmers等[10]的双波长分光光度法,以血浆中HbCO的百分比含量(%)代表CO含量。
2.7血浆中NO含量测定 采用硝酸还原酶法,按照试剂盒说明书进行操作。
2.8肺系数测定 自气管分叉以上5、6软骨环间剪断气管,用滤纸吸干肺表面血污后称质量。肺系数=全肺湿质量(g)/体质量(kg)。
2.9肺组织CSE活性测定 参照文献[7]方法。组织中CSE活性以每毫克组织在每分钟生成H2S的nmol表示。
2.10肺组织iNOS活性测定 采用分光光度法,严格按试剂盒说明进行操作。
2.11肺组织HO活性检测 采用HO降解血红素生成胆绿素和CO的原理,通过测定样品反应物中胆红素生成的量来代表HO活性。取肺组织,加4倍体积磷酸盐缓冲液(0.1mol·L-1,pH 7.4)制成匀浆,4 ℃、15 000×g离心15 min,取上清-70 ℃保存。反应体系含肺组织匀浆上清液20 μL、血红素20 μmol·L-1、NADP 0.8 mmol·L-1、肝组织匀浆上清液20 μL(作为胆绿素还原酶的来源)、6-磷酸葡萄糖4 mmol·L-1和6-磷酸葡萄糖脱氢酶1U,反应体积1 mL。37 ℃暗处反应1 h,于冰上终止反应。不含NADP的样品作空白对照。用分光光度计于464 nm和530 nm处测定吸光度。胆红素消光系数40 mmol·L-1·cm-1,计算1 mg HO蛋白1 h催化血红素降解生成胆红素的pmol数,以此表示HO活性。肺组织匀浆上清液蛋白测定采用考马斯亮蓝法。
2.12肺组织形态学观察 光镜下观察肺组织形态结构变化。每组选取6张玻片,每张玻片连续观察10个视野(×100),计算损伤肺泡(肺泡内含有红细胞或/和中性粒细胞2个以上)数占计数肺泡总数百分比,即肺泡损伤数比值,作为肺损伤的组织学定量评价指标(index of quantitative assessment,IQA)。
2.13支气管肺泡灌洗液蛋白定量和PMN计数 全肺以4 ℃无菌生理盐水10 mL进行支气管肺泡灌洗,分2次进行;第1个5 mL生理盐水经气管插管缓慢注入动物肺内,保留0.5-1 min,同时轻轻按摩胸壁。反复灌洗5次后回收;第2个5 mL仅灌洗1次。将两次回收的BALF经双层纱布过滤,离心(1 000 r/min,10 min),留取上清用改良酚试剂测定蛋白含量。沉定部分重新悬浮于1 mL生理盐水中。取部分悬液采用甲紫染色,计数白细胞总数;其余部分涂片,姬姆萨-瑞氏染色,光镜下计数500个细胞,计算细胞分类比例。BALF中PMN数量(×109/L)=BALF中血细胞总数(×109/L)×500个细胞中PMN的比例数。
3统计学处理
结 果
1肺组织形态学改变
光镜下对照组肺组织结构清晰,肺泡壁薄,肺泡内未见水肿液,肺泡腔内可见少量淋巴细胞及单核巨噬细胞。IR组肺组织出现水肿、出血及PMN在肺内聚集的病理学变化,IQA与对照组相比明显增高(均P<0.01)。NaHS+IR组肺组织病变较相应时间点的IR组明显减轻,大部分肺组织接近正常,局部肺组织少量炎细胞浸润,肺泡隔略有增宽,IQA亦较相应时间点IR组明显下降(均P<0.01)。PPG+IR组肺组织损伤较IR组加重, IQA亦升高(P<0.05),见图1、表1。
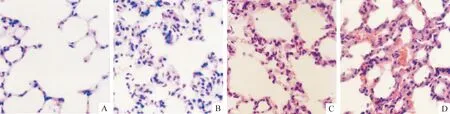
Figure 1. Effect of H2S on the lung tissue structure after limb IR in rats (HE,×400).A:control group; B:IR group; C:NaHS+IR group; D:PPG+IR group.
图1H2S对大鼠肢体IR致肺损伤时肺组织学变化的影响
表1各组大鼠肺系数、肺组织中MDA含量及IQA的变化


GroupIW/BWMDA(nmol·L-1)IQAControl4.13±0.1236.68±1.8418.79±1.16IR5.34±0.20*60.98±2.22*40.14±1.20*NaHS+IR4.85±0.17*#50.98±2.23*#27.15±1.39*#PPG+IR5.80±0.15*71.29±3.37*43.58±1.52*
*P<0.05vscontrol group;#P<0.05vsIR group.
2肺系数和肺组织中MDA含量的变化
各组大鼠二者的变化趋势一致, IR组明显高于对照组(P<0.01)和NaHS+IR组(P<0.05), 低于PPG+IR组(P<0.05),见表1。
3BALF中PMN数目和蛋白含量的变化
各组大鼠二者的变化趋势一致,IR组明显高于对照组(P<0.01)和NaHS+IR组(P<0.05),低于PPG+IR组(P<0.05),见表2。
表2各组大鼠支气管肺泡灌洗液中PMN数量及蛋白含量的变化


GroupPMNProtein(mg·L-1)Control2.71±0.37131.51±2.00IR7.07±0.69*191.89±3.52*NaHS+IR5.44±0.47*#162.65±4.83*#PPG+IR8.79±0.90*213.46±6.67*
*P<0.05vscontrol group;#P<0.05vsIR group.
4血浆H2S含量和肺组织CSE活性的变化
各组大鼠二者的变化趋势一致,IR组低于对照组(P<0.05)和NaHS+IR组(P<0.05),高于PPG+IR组(P<0.01),见表3。
表3各组大鼠血浆中H2S浓度和肺组织中CSE活性的变化


GroupH2S(μmol·L-1)CSE(μmol·g-1·min-1)Control171.26±3.1082.34±1.98IR125.59±3.90*73.87±2.09*NaHS+IR215.63±9.97*#86.50±30.79*#PPG+IR110.29±9.71*61.51±1.82*
*P<0.05vscontrol group;#P<0.05vsIR group.
5血浆NO含量及肺组织iNOS活性的变化
IR组血浆NO含量和肺组织中iNOS活性明显高于对照组(P<0.01)和NaHS+IR组(P<0.01),低于PPG+IR组(P<0.05),见表4。
表4各组大鼠血浆中NO浓度及肺组织中iNOS活性的变化


GroupNO(μmol·L-1)iNOS(103U·g-1protein)Control75.89±2.24178.89±3.97IR131.73±2.23*277.94±6.81*NaHS+IR102.15±3.96*#226.87±5.09*#PPG+IR150.06±1.37*#295.57±5.38*#
*P<0.05vscontrol group;#P<0.05vsIR group.
6血浆CO含量及肺组织HO活性的变化
IR组血浆CO含量和肺组织HO活性明显高于对照组(P<0.05);NaHS+IR组二者进一步增高,显著高于IR组(P<0.01);PPG+IR组与IR组相比二者无明显差别(P>0.05),见表5。
表5各组大鼠血浆中CO含量及肺组织中HO活性的变化


GroupCO(%HbCO)HO(nmol·g-1·h-1)Control0.49±0.0285.55±1.27IR1.01±0.08*108.33±1.19*NaHS+IR1.36±0.09*#118.14±1.52*#PPG+IR0.57±0.04*76.23±5.19*
*P<0.05vscontrol group;#P<0.05vsIR group.
7血浆H2S含量的变化与其它各项指标的相关性分析
相关性分析表明,IR组、NaHS+IR组和PPG+IR组大鼠血浆H2S含量的变化与肺组织CSE活性、血浆CO含量、肺组织HO活性呈正相关(r=0.945-0.987,均P<0.01);与其它指标呈负相关(r=-0.994~-0.943,均P<0.01)。
讨 论
内源性H2S主要是由含硫氨基酸(L-半胱氨酸)经多种酶促反应产生,其限速酶主要包括:胱硫醚-β-合成酶(cystathionine-β-synthase, CBS) 和CSE。CBS和CSE的表达具有组织特异性,心、肺组织中内源性H2S主要由CSE催化产生。H2S在体内以2种形式存在-未溶解的气体H2S (约占1/3 ) 和HS-钠盐NaHS (约占2/3 )。NaHS在体内可分解为Na+及HS-,后者与体内H+结合生成H2S,H2S和NaHS在体内形成动态平衡[5]。目前认为,H2S是继NO和CO之后人们发现的一种新的内源性小气体信号分子。已有研究表明[11-15],H2S在许多肺疾病的发病机制中起着重要的调控作用,诸如慢性阻塞性肺疾病、肺炎症性损伤及肺纤维化等。本研究在大鼠肢体IR所致ALI模型上发现大鼠肢体IR致肺损伤时,血浆H2S含量和肺组织CSE活性下降;为进一步阐明H2S/CSE变化的意义,本研究分别观察了补充H2S以及进一步抑制H2S对此种肺损伤的作用。结果显示,应用H2S供体-NaHS使H2S含量升高可明显减轻肢体IR所致肺损伤;而应用CSE活性抑制剂-PPG抑制CSE活性从而使H2S产生减少则明显加重此种肺损伤,结果提示肢体IR后肺内H2S/CSE体系的下调参与介导了肢体IR后ALI的发生,内源性和外源性H2S具有抑制肢体IR所致肺组织损伤的保护作用。
尽管对于肢体IR所致ALI的发生机制尚未完全阐明,但目前认为IR引起的PMN肺内大量扣押及氧化应激损伤是其发生的重要环节[1]。本研究通过对肢体IR致ALI时肺组织中氧化产物-MDA含量、BALF中PMN数目和蛋白含量变化的检测进一步佐证了此种病理生理变化,同时发现抑制内源性H2S可使肺内MDA含量、BALF中PMN数目和蛋白含量进一步增高,而补充H2S可明显降低ALI时肺内MDA的生成以及BALF中PMN数目和蛋白含量,提示H2S抗肢体IR所致ALI的保护作用与其抑制PMN肺内扣押以及抗氧化作用有关。
NO是最早发现的气体信号分子,可参与生理状态下和多种肺疾病的发生。NOS是合成NO的关键酶。研究表明[2],肢体IR致ALI时肺内 iNOS表达上调并产生大量NO,后者产生细胞毒性作用从而参与介导了肢体IR后ALI的发生。CO是继NO后发现的第2个双原子气体信使分子,内源性CO主要由HO催化血红素降解产生。研究表明[2-4],肢体IR可使肺内诱导型HO(HO-1)表达增多并使CO产生增多,CO/HO-1具有抗炎症、抗氧化等重要组织保护作用,而且在CO和NO两个信使系统之间存在相互协调、相互制约的关系,目前对气体信号系统之间交互作用的研究成为新的热点。本研究通过检测肺组织中iNOS和HO活性、血浆NO和CO含量的变化及其与H2S含量变化的相关性,发现肢体IR后肺内H2S减少的同时,NO/iNOS和CO/HO-1含量及活性增高;给予PPG抑制内源性H2S的产生,可进一步上调NO/iNOS体系,该组CO/HO体系与IR组相比无显著差异,可能因样品数较小所致; 给予H2S供体NaHS可下调NO/iNOS、上调CO/HO-1;而且H2S含量与血浆NO含量、iNOS活性呈负相关,与CO含量、HO活性呈正相关。由此推测, 大鼠肢体IR致ALI时,3种气体信号分子间可能存在相互调节的关系,而且H2S的保护作用可能与其抑制肢体IR时肺内iNOS活性及NO的大量产生、增强HO-1活性以及CO含量有关,具体机制有待进一步研究。
总之, 本实验结果表明内源性H2S的减少参与了肢体IR所致大鼠ALI的发生, 而一定量的外源性H2S可通过抗炎、抗氧化作用以及下调NO/iNOS体系、上调CO/HO-1体系发挥一定的抗损伤作用。
[1] 周君琳,凌亦凌. 肢体缺血再灌注继发肺损伤的发生机制[J]. 国外医学·生理、病理科学与临床分册,2000,20(4):332-335.
[2] 周君琳,凌亦凌,李陈利,等. 一氧化氮和过氧亚硝基阴离子在肢体缺血再灌注致肺损伤中的作用[J]. 中国病理生理杂志,2001,17(2):158-160.
[3] Zhou JL, Ling YL, Jin GH, et al. Endogenous carbon monoxide attenuates the lung injury following ischemia-reperfusion of hind limbs in rats[J]. Acta Physiologica Sinica, 2002, 54(3): 229-233.
[4] Zhou JL, Zhu XG,Lin Y, et al. Change and role of heme oxygenase-1 in injured lungs following limb ischemia/reperfusion in rats[J]. Chin J Traumatol, 2004, 7(3): 131-137.
[5] Wang R. Two’s company,three’s a crowd: can H2S be the third endogenous gaseous transmitter?[J]. FASEB J, 2002, 16(13): 1792-1798.
[6] Chunyu Z, Junbao D, Dingfang B,et al. The regulatory effect of hydrogen sulfide on hypoxic pulmonary hypertension in rats[J]. Biochem Biophys Res Commun, 2003, 302(4):810-816.
[7] Geng B, Cui Y, Zhao J, et al. Hydrogen sulfide downregulates the aortic L-arginine/nitric oxide pathway in rats[J]. Am J Physiol Regul Integr Comp Physiol, 2007, 293(4): R1608-R1618.
[8] Kimura Y, Goto Y, Kimura H. Hydrogen sulfide increases glutathione production and suppresses oxidative stress in mitochondria[J]. Antioxid Redox Signal, 2010, 12(1): 1-13.
[9] Cohen SW, Siddqq FA, Darkchiev B, et al. Attenuation of lung injury caused by hind-limb ischemia-reperfusion injury by butyrolactone anti-inflammatory agent FL1003[J]. J Trauma,1997, 43(2): 247-251.
[10]Chalmers AH. Simple, sensitive measurement of carbon monoxide in plasma[J]. Clin Chem, 1991, 37(8): 1442-1445.
[11]Chen YH, Yao WZ, Geng B, et al. Endogenous hydrogen sulfide in patients with COPD[J]. Chest, 2005, 128(5): 3205-3211.
[12]Chen YH, Yao WZ, Ding YL, et al. Effect of theophylline on endogenous hydrogen sulfide production in patients with COPD[J]. Pulm Pharmacol Ther, 2008, 21(1): 40-46.
[13]Zhang H, Zhi L, Moore PK, et al. Role of hydrogen sulfide in cecal ligation and puncture-induced sepsis in the mouse[J].Am J Physiol Lung Cell Mol Physiol, 2006, 290(6): L1193-L1201.
[14]Sowmya S, Swathi Y, Yeo AL, et al. Hydrogen sulfide: regulatory role on blood pressure in hyperhomocysteinemia[J]. Vascul Pharmacol, 2010, 53(3-4): 138-143.
[15]Tamizhselvi R, Moore PK, Bhatia M. Inhibition of hydrogen sulfide synthesis attenuates chemokine production and protects mice against acute pancreatitis and associated lung injury[J]. Pancreas, 2008, 36(4): e24-e31.
Roleofhydrogensulfideinacutelunginjuryinducedbyischemia-reperfusionofhindlimbsinrats
HUANG Xin-li1, ZHONG Wei-jia2, LIU Qing-he2, TIAN Qing-xian2, ZHOU Jun-lin2
(1DepartmentofPathophysiology,HebeiMedicalUniversity,Shijiazhuang050017,China;2DepartmentofOrthopedics,BeijingChaoyangHospital,CapitalMedicalScienceUniversity,Beijing100020,China.E-mail:junlinzhou@yahoo.cn)
AIM: To explore the role of endogenous and exogenous hydrogen sulfide (H2S) in acute lung injury (ALI) induced by ischmia-reperfusion (IR) of hind limbs in rats.METHODSA Sprague-Dawley rat model of acute lung injury was induced by ischemia of the hind limbs for 4 h and reperfusion for another 4 h. The rats (n=120) were randomly divided into 4 groups: control, IR, NaHS (H2S donor)+IR, and propargylglycine [PPG, inhibitor of cystathionine γ-lyase (CSE)]+IR. The animals were sacrificed after reperfusion. Lung weight/body weight ratio (LW/BW) was measured and calculated. Morphological changes of the lung tissues were observed. The concentrations of H2S, nitric oxide (NO) and carbon monoxide (CO) in plasma were tested. The content of malondialdehyde (MDA), the activity of CSE, inducible nitric oxide synthase (iNOS) and hemeoxygenase (HO) in the lungs were determined. The polymorpho-nuclear neutrophils(PMN) and protein content in bronchoalveolar lavage fluid(BALF) were also measured. The correlation of H2S content with the above indices was analyzed.RESULTSCompared with control group, severe injuries of the lung tissues, raised LW/BW, MDA concentration, PMN and protein contents in BALF were observed in IR group. Limb IR also made a drop in the concentration of plasma H2S and the activity of lung CSE, while the activity of iNOS and HO in the lung tissues and the levels of plasma NO and CO increased. Administration of NaHS before IR attenuated the changes induced by IR, while pre-administration of PPG exacerbated the IR injuries and increased the plasma NO level and lung iNOS activity. The H2S content was positively correlated with CSE activity, CO content and HO-1 activity (P<0.01), and negatively correlated with the other indices (P<0.01).CONCLUSIONDown-regulation of H2S/CSE is involved in the pathogenesis of acute lung injury induced by IR. Endogenous and exogenous H2S protects against lung injuries. The anti-injury effects of H2S are related with its anti-oxidative activity to attenuate the inflammatory over-reactions in the lung induced by PMN. Down-regulation of NO/iNOS system and up-regulation of CO/HO-1 system by H2S are also involved in the process of anti-injury to ALI.
Hydrogen sulfide; Acute lung injury; Nitric oxide; Carbon monoxide; Cystathionine-γ-lyase
R363
A
10.3969/j.issn.1000-4718.2011.01.002
1000-4718(2011)01-0009-05
2010-08-19
2010-10-27
国家自然科学基金资助项目(No.30271337; No. 30800440;No.81070050);北京市自然科学基金资助项目(No.7092035)
△ 通讯作者 Tel:010-85231240; E-mail: junlinzhou@yahoo.cn

