可德兰寡糖的制备及其组分分析
傅赟彬,刘启顺,李曙光,张建平,白雪芳,赵小明,杜昱光,
(1.中国科学院大连化学物理研究所天然产物与糖工程1805组,辽宁省碳水化合物研究重点实验室, 辽宁 大连 116023;2.中国科学院研究生院,北京 100049)
可德兰寡糖的制备及其组分分析
傅赟彬1,2,刘启顺1,李曙光1,张建平1,2,白雪芳1,赵小明1,杜昱光1,*
(1.中国科学院大连化学物理研究所天然产物与糖工程1805组,辽宁省碳水化合物研究重点实验室, 辽宁 大连 116023;2.中国科学院研究生院,北京 100049)
目的:可德兰多糖是目前发现的唯一不含分支的线性β-1,3-葡聚糖,由于难溶于水而限制其生物活性的研究,为此对可德兰寡糖的制备及其组分进行研究。方法:采用化学法酸解可德兰多糖。结果:通过红外光谱与基质辅助激光解析/电离飞行时间质谱(MALDI-TOF MS)的检测,结果表明:可德兰多糖降解后结构未发生变化,降解产物的聚合度为2~19,其中聚合度为5的成分含量最高;高效阴离子交换色谱脉冲安培检测法分析结果表明:反应温度105℃、反应时间150~180min是降解可德兰寡糖的合理反应条件,降解效果最佳。结论:本研究建立的方法可简单、高效的降解可德兰多糖,制备其寡糖。
可德兰多糖;可德兰寡糖;红外光谱;基质辅助激光解析/电离飞行时间质谱;高效阴离子交换色谱脉冲安培检测法
可德兰多糖是Alcaligenes faecalis var myxogenes 10c3发酵产生的胞外多糖[1],其结构为β-(1→3)糖苷键连接而成的葡聚糖,如图1所示。
该多糖是迄今为止自然界中唯一发现的一种不含分支的β-1,3-葡聚糖。可德兰多糖为白色粉末,不溶于水和醇类,可溶于碱性溶液和二甲基亚砜[2]。可德兰多糖具有独特的凝胶特性,其水溶液根据加热温度的高低,形成热可逆凝胶和热不可逆凝胶[3],在制备需要增稠的食品时可作为膨胀剂或者天然植物胶的替代品,已被广泛用在食品工业。然而,可德兰多糖在水溶液中所具有的刚性三螺旋结构导致的不溶于水的特性限制了它的广泛应用[4]。

图1 可德兰多糖的结构式Fig.1 The structure of curdlan
多糖通过酶降解或化学法降解为寡糖,增加了水溶性,扩大了应用范围,并提高了生物活性。可德兰多糖降解为可德兰寡糖(curdlan oligomers,CRDO)导致三级结构的破坏和分子质量的降低,其水溶性大大增强。随着人们对寡糖的日益关注,CRDO及其衍生物的生物活性逐渐被揭示。Hida等[5]发现CRDO能够刺激小鼠白细胞产生细胞因子,从而激活免疫应答,增强机体抵抗力。有研究人员发现,喂养可德兰多糖后,小鼠盲肠内的短链脂肪酸和双歧杆菌的数量都有明显增加,认为小鼠大肠内可德兰多糖被降解得到的CRDO可能与已知的益生源——果寡糖和木寡糖一样有调节肠道菌群的功效,具有开发为益生源产品的潜力[6]。有文献报道,从海带中提取的β-1,3-葡寡糖结构的海带五糖是诱导植物抗病性的最小基本结构单元,该成分与聚合度(degree of polymerizaiton,DP) 5的CRDO具有相同的结构[7-8]。香菇多糖(lentinan)也是β-1,3-葡聚糖家族成员之一,已经作为辅助药物用于临床治疗癌症[9]。我国目前批准的两个香菇多糖药物都是通过β-(1→3)糖苷键连接、含有β-(1→6)侧链的葡寡糖,其中香菇六糖对实体瘤和腹水瘤的抑瘤率高达到50%[10]。大多数β-1,3-葡寡糖与CRDO的区别在于是否存在侧链,CRDO的制备有助于从结构上了解相关葡寡糖的特性,为揭示寡糖结构和生物活性之间的关系提供一定的物质基础。
目前已有相关文献报道可德兰寡糖的制备,但都存在各种不足。Wang等[11]在非均相体系中对可德兰多糖进行醋酸水解时,制备得到的绝大部分为二糖,产率只有27%;Grandpierre等[12]使用硫酸和三氟乙酸分别水解可德兰多糖90h后,发现降解产率只有25%,且两者对于设备的腐蚀性严重;另外,使用木霉发酵液降解,存在反应时间长,效率低的问题,且只能得到DP 2~6的聚合度较低的寡糖。因此,建立反应快速、效率高,同时可根据要求制备不同DP的降解方法势在必行。
本实验以可德兰多糖为原料,在二甲基亚砜的均相体系中采用盐酸降解多糖制备CRDO。通过红外光谱比较降解前后产物结构是否发生改变,MALDI-TOF MS检测组分的相对分子质量、相对分子质量分布,更进一步确定降解产物的结构及确定最佳反应条件。
1 材料与方法
1.1 材料与试剂
可德兰多糖(食品级) 日本武田-麒麟食品公司;NaOH、醋酸钠(分析纯) 美国Acros Organics公司;其他试剂均为国产分析纯试剂。
1.2 仪器与设备
HPLC系统采用的脉冲安培检测器系统(包括两个582型泵、PEEK梯度混合器和脉冲阻尼器、542型自动进样器、5600A型16通道脉冲安培检测器及Coul Array for Windows数据处理软件) 美国ESA公司;Vector 22 FTIR光谱仪 德国Bruker公司;Autoflex质谱仪分析 德国Bruker Daltonics 公司。
1.3 方法
1.3.1 酸法降解可德兰多糖制备CRDO的方法
称取5g可德兰多糖于60mL二甲基亚砜溶液中充分搅拌至完全溶解,分别在不同温度下缓慢滴加入1mol/L盐酸3mL,分别在反应时间30、60、90、120、150、180、240min时取样用于后续分析;调节pH值至中性,搅拌中用丙酮沉淀,得到乳白色粉末,抽滤后用丙酮洗3~5遍,于50℃条件下真空干燥得可德兰多糖的降解产物。
1.3.2 红外光谱表征CRDO的性质
样品用溴化钾压片,使用红外光谱分析仪比较可德兰多糖与寡糖图谱,分析结构是否发生改变。
1.3.3 基质辅助激光解析电离飞行时间质谱(MALDITOF MS)测定寡糖含量
根据文献[13]报道的方法适当修改。
质谱条件:氮气激光波长为337nm,加速电压范围在+20~-20kV,基质为2,5-二羟基苯甲酸水溶液(DHBA,10mg/mL)和10mmol/L NaCl溶液,样品靶是384孔点的抛光不锈钢靶。质谱实验都在正离子反射模式下进行,延迟萃取时间为100ns,每张质谱图为50次激光信号累加所得,样品分子质量由标准品外标法校正。
1.3.4 高效阴离子交换色谱脉冲安培检测法(HPAECPAD)

表1 溶剂梯度与洗脱流速Table1 Solvent gradient and flow rate
色谱柱:美国Dionex公司CarboPacTMPA-100柱(250mm×4mm);梯度洗脱方式为:流动相A:100mmol/L NaOH;流动相B:100mmol/L NaOH和500mmol/LCH3COONa,洗脱梯度见表1。柱温和脉冲安培检测器的温度维持在30℃;进样量10μL;脉冲电势及电极持续时间如下:E1=+200mV(t1=300ms);E2=+700mV(t2=100ms);E3= - 900mV(t3=100ms),Coul Array for Windows数据处理软件分析结果。
1.3.5 CRDO相对含量的计算方法
本实验所述的CRDO聚合度为2~10,其相对含量可根据HPAEC-PAD检测的色谱峰的积分面积进行计算,具体计算方法见公式1。

式中:Si为各个组分色谱峰的积分面积。

2 结果与分析
2.1 红外光谱分析

图2 可德兰多糖和CRDO的红外光谱图Fig.2 FT-IR spectrum of curdlan and C1RDO
如图 2所示,可德兰多糖及降解产物在890cm-1处都存在特征峰,这表明两者的糖苷键均为β构型;1370、2920cm-1处的特征峰说明两者是具有β-(1→3)糖苷键的葡聚糖[14-16]。与可德兰多糖相比,本方法制备得到的CRDO并没有产生新的吸收峰。这表明酸法降解得到的CRDO的基本结构未发生改变。
2.2 MALDI-TOF MS 分析结果
用MALDI-TOF MS测定可德兰多糖的降解产物可以便捷、直接、快速地同时提供样品的相对分子质量、相对分子质量分布、重复单元结构和端基结构等多种信息[17-18],已被广泛用于糖类物质的结构分析。m/z值为寡糖分子质量与Na+离子的加成峰。由图3可知,降解产物中含有DP 2~19的成分,其中可德兰五糖含量最多,四糖、六糖含量次之。从此数据可以看出,酸降解CRDO的方法是切实可行的,得到的产物纯度高,降解副产物较少。

图3 可德兰多糖降解产物的MALDI-TOF图谱Fig.3 MALDI-TOF MS spectrum of the degradation product of curdlan
2.3 HPAEC-PAD分析结果
图4考察了反应温度为95~115℃时,不同降解时间CRDO的相对含量变化情况。

图4 HPAEC-PAD法检测不同反应时间CRDO组分相对含量的变化图Fig.4 Changes of the relative proportion of CRDO by HPAEC-PAD at different time during the degradation of curdlan
图4 A可以看出95℃时多糖的降解效果较差,反应4h后得到的白色粉末中仍有部分不溶于水的颗粒,色谱检测发现CRDO含量为64.66%。
图4B为105℃条件下可德兰多糖的降解情况。可以看出反应初期多糖降解不充分,所得的CRDO的相对含量仅为40.39%,随着反应时间的延长,CRDO相对含量越来越多,180min时达到最大值,含量为79.95%。此时,CRDO的收率为62.08%。当反应240min时,相对含量开始呈现下降的趋势。
图4C为115℃条件下,CRDO的相对含量变化情况。相对于95℃和105℃而言,温度升高有利于多糖的降解。90min时,相对含量达到77.19%,在90~150min内含量变化相对较小。180min时,含量开始明显下降,当反应进行到240min时,DP2~10的含量仅为35.11%。可能是由于反应时间过长可德兰多糖降解成单糖或高温导致某些副产物的产生。
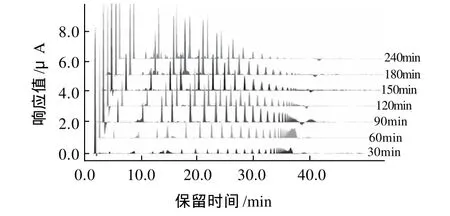
图5 反应温度为105℃时HPAEC-PAD法检测不同反应时间降解产物的组分变化图Fig.5 Multi-file analysis of the degradation of curdlan at 105℃ by HPAEC-PAD at different time
图5 为反应温度为105℃时不同时间各个组分的比例情况。降解反应30min时,得到的寡糖含量较少,且以高DP的寡糖为主。随着反应时间的推移,多糖不断被降解,低DP的寡糖含量逐渐增高,反应150~180min时CRDO含量最高,为最佳反应时间。
综合图4、5可以看出,反应时间和温度对于CRDO的DP比例和含量有很大的影响。在95℃条件下反应4h后,仍然有部分可德兰多糖未完全降解。115℃时降解速率最快。然而,高温反应对于设备要求更高,易导致副产物的产生。所以反应温度为105℃,反应时间为150~180min是比较合理的反应条件。
3 结 论
本研究建立一种在二甲基亚砜的均相体系中,以稀盐酸高效降解可德兰多糖制备CRDO的方法。通过红外光谱和MALDI-TOF MS检测发现降解得到的寡糖结构未发生变化,因此本方法在不影响产物结构的基础上可用于制备寡糖的研究;从结果中可知,可德兰多糖的降解产物DP2~19,其中DP5的成分含量最高,其次是四糖和六糖。HPAEC-PAD法检测降解产物组成表明反应温度105℃,反应150~180min的降解效果最佳。本方法较之前报导的酸解制备CRDO来说[12],具有高效、快速的降解特点。同时,本方法能根据实验条件的改变得到DP相对较高的寡糖,克服了酶法制备的CRDO聚合度较低的缺点。
本方法制备的CRDO结构清晰,为进一步制备寡糖标准品、作为寡糖中间体合成其他药物以及与其他种类葡寡糖进行对比,从机理方面深层次地探讨CRDO及其衍生物的构效关系提供参考。国内尚无此项研究的相关报道,本研究建立的用均相体系制备CRDO的方法具有可靠、高效、快速的特点,对于今后大规模制备可德兰寡糖具有理论和现实意义,并为我国CRDO的活性研究和开发利用提供了一定的参考。
[1] HARADA T, MASADA M, FUJIMORI K, et al. Production of a firm resilient gel-forming polysaccharide by a mutant of Alcaligenes faecalis var myxogenes 10c3[J]. Agricultural and Biological Chemistry, 1966,30(2): 196-198.
[2] ZHANG Hongbin, NISHINARI K. Characterization of the conformation and comparison of shear and extensional properties of curdlan in DMSO[J]. Food Hydrocolloids, 2009, 23(6): 1570-1578.
[3] 张琦, 张洪斌, 丛峰松, 等. β-(1→3)-D-葡聚糖可德胶化学改性的研究进展[J]. 高分子通报, 2009(5): 20-29.
[4] 丛峰松, 张洪斌, 张维杰. 可德胶及其在食品和医药领域上的应用[J]. 食品科学, 2004, 25(11): 432-435.
[5] HIDA T H, ISHIBASHI K, MIURA N N, et al. Cytokine induction by a linear 1,3-glucan, curdlan-oligo, in mouse leukocytes in vitro[J].Inflammation Research, 2009, 58(1): 9-14.
[6] SHIMIZU J, TSUCHIHASHI N, KUDOH K, et al. Dietary curdlan increases proliferation of bifidobacteria in the cecum of rats[J]. Bioscience Biotechnology and Biochemistry, 2001, 65(2): 466-469.
[7] KLARZYNSKI O, PLESSE B, JOUBERT J M, et al. Linear β-1,3-glucans are elicitors of defense responses in tobacco[J]. Plant Physiology,2000, 124(3): 1027-1037.
[8] AZIZ A, GAUTHIER A, BEZLER A, et al. Elicitor and resistanceinducing activities of β-1,4-cellodextrins in grapevine, comparison with β-1,3-glucans and β-1,4-oligogalacturonides[J]. Journal of Experimental Botany, 2007, 58(6): 1463-1472.
[9] WHITE R W D, HACKMAN R M, SOARES S E, et al. Effects of a mushroom mycelium extract on the treatment of prostate cancer[J].Urology, 2002, 60(4): 640-644.
[10] 张志平, 衣悦涛, 宁君. 香菇多糖核心片段六糖的合成研究[J]. 有机化学, 2005(10): 1240-1243.
[11] WANG Laixi, SAKAIRI N, KUZUHARA H. Peracetylated laminaribiose:preparation by specific degradation of curdlan and its chemical conversion into N-acetylhyalobiuronic acid[J]. Carbohydrate Research, 1991,219: 133-148.
[12] GRANDPIERRE C, JANSSEN H G, LAROCHE C, et al. Enzymatic and chemical degradation of curdlan targeting the production of β-1,3-oligoglucans[J]. Carbohydrate Polymers, 2008, 71(2): 277-286.
[13] HU Lianghai, ZHOU Houjiang, LI Yinghua, et al. Profiling of endogenous serum phosphorylated peptides by titanium (IV) immobilized mesoporous silica particles enrichment and MALDI-TOFMS detection[J]. Analytical Chemistry, 2008, 81(1): 94-104.
[14] 李卫旗, 李志昂, 何国庆. 酶法提取可德兰多糖的研究[J]. 食品科学,2002, 23(7): 68-70.
[15] JIN Yang, ZHANG Hongbin, YIN Yimei, et al. Comparison of curdlan and its carboxymethylated derivative by means of rheology, DSC, and AFM[J]. Carbohydrate Research, 2006, 341(1): 90-99.
[16] LEE C M, JEONG H J, KIM E M, et al. Synthesis and characterization of iron oxide nanoparticles decorated with carboxymethyl curdlan[J].Macromolecular Research, 2009, 17(2): 133-136.
[17] 邓慧敏, 张珍英, 查庆民, 等. MALDI-TOF MS 测定高聚合度葡聚糖及不同基体在测定中的作用比较[J]. 高等学校化学学报, 2003(6):996-999.
[18] CHAN T W D, CHAN P K, TANG K Y. Determination of molecular weight profile for a bioactive β-(1→3) polysaccharides curdlan[J].Analytica Chimica Acta, 2006, 556(1): 226-236.
Preparation and Component Analysis of Curdlan Oligomers
FU Yun-bin1,2,LIU Qi-shun1,LI Shu-guang1,ZHANG Jian-ping1,2,BAI Xue-fang1,ZHAO Xiao-ming1,DU Yu-guang1,*
(1. Liaoning Provincial Key Laboratory of Carbohydrate, Natural Products and Glyco-Biotechnology Group 1805, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China;2. Graduate University of Chinese Academy of Sciences,Beijing 100049, China)
Beta-1,3-glucan possesses extensive application and application values due to diverse biological activity. Curdlan,an extracellular bacterial polysaccharide, is a linear beta-1,3-glucan, and its water insolubility significantly limits its application.The aim of this study was to prepare the soluble curdlan oligomers (CRDO) for biological activities assay. In the homogeneous solution, CRDO structure change by acid hydrolysis and the influence of different factors on the degradation of curdlan measured by HPAEC-PAD was investigated. Compared with curdlan, the structure of CRDO was not changed measured by FTIR spectrometer and MALDI-TOF MS, and the degree of polymerization (DP) of CRDO obtained was 2-19 with the most abundance of DP 5. The reaction condition including the time and temperature of acid hydrolysis was optimized to 105 ℃ for 150-180 min. Therefore, the method described in this study is highly efficient for the rapid degradation of curdlan into CRDO.
curdlan;curdlan oligomers;fourier transform infrared spectroscopy (FT-IR spectroscopy);matrix assisted laser desorption/ionization- time of flight mass spectrometry (MALDI-TOF MS);high-performance anion-exchange chromatography with pulsed amperometric detection (HPAEC-PAD)
TS201.2
A
1002-6630(2011)03-0006-04
2010-05-27
国家“863”计划项目(2006AA10A213;2007AA091601;2006AA100313);中国科学院知识创新工程重要方向项目(KSCX2-YW-G-041);农业部公益性(农业)科研专项(200903052);科技部重大新药创制项目(2009ZX09501-011)
傅赟彬(1983—),男,博士研究生,研究方向为寡糖功能活性。E-mail:fuyunbin@dicp.ac.cn
*通信作者:杜昱光(1963—),男,研究员,研究方向为糖生物学和糖工程。E-mail:articles1805@gmail.com

