常压室温等离子体快速诱变产油酵母的条件及其突变株的特性
金丽华,方明月,张翀,蒋培霞,葛楠,李和平,邢新会,包成玉
1 清华大学化学工程系,北京 100084
2 清华大学工程物理系,北京 100084
常压室温等离子体快速诱变产油酵母的条件及其突变株的特性
金丽华1,方明月1,张翀1,蒋培霞1,葛楠2,李和平2,邢新会1,包成玉2
1 清华大学化学工程系,北京 100084
2 清华大学工程物理系,北京 100084
采用新型常压室温等离子体射流诱变产油酵母,结合快速突变产油酵母操作条件及基于96孔板的高通量筛选手段,获得了一系列增殖速度和产油量发生变化的突变株。在等离子体对菌株致死率为99%的条件下获得的以突变株增殖速度为指标的正突变率达到27.2%。用含酵母粉 (10 g/L)、蛋白胨 (10 g/L) 及葡萄糖 (20 g/L) 的酵母膏胨葡萄糖培养基进行发酵实验表明,筛选得到的高产突变体产油量从对照株的1.87% (W/W) 增加到4.07% (W/W)。
常压室温等离子体,产油酵母,高通量筛选,诱变,油脂
Abstract:To obtain oleaginous yeast mutants with improved lipid production and growth rates, an atmospheric and room temperature plasma (ARTP) jet was used with a 96-well plate for high throughput screening. Mutants with changes in growth rates and lipid contents were obtained. At a lethality rate of 99%, the positive mutation rate of the yeast cells was 27.2% evaluated by the growth rates of the mutants and the comparison with the wild strain. The fermentation in a medium composed of yeastextract (10 g/L), peptone (10 g/L) and D-glucose (20 g/L) resulted in the lipid yield of the mutant (C4) with 4.07% (W/W) compared with that of the wild strain (1.87%).
Keywords:atmospheric and room temperature plasma (ARTP), oleaginous yeast, high throughput screening (HTS),mutation, lipid
当今世界化石燃料的过度消耗造成其储备量日益减少,可再生能源的开发与研究日益重要[1]。利用微生物转化生物质生产生物柴油是解决能源短缺的途径之一。利用微生物生产油脂有以下优点:微生物生产油脂周期短、不受季节和气候的影响、营养简单、易于进行工业化大规模培养等。但是也存在微生物的生产能力低、可用碳源种类有限等问题。获取高增殖速度、高油脂含量的菌株成为微生物生物柴油实现工业化的瓶颈。为了筛选高效的油脂生产菌株,国内外研究小组不断从自然界中筛选优良菌株[2]、优化培养基来提高产量[3-4],或者尝试利用微波、紫外等物理诱变方法获取高产菌株[5-6]。
本课题组自主研发了新型常压室温等离子体(ARTP) 微生物基因组快速突变技术。ARTP具有射流温度低、产生的等离子体均匀、无需真空装置、操作简易、成本低、与生物大分子和细胞作用明显等优点[7-8],已成为快速突变微生物基因组的有效方法。前期的研究结果表明,ARTP技术可以快速有效地突变细菌、微藻、真菌、酵母等微生物[9-10],能够成为构建多样性丰富的突变库的方法,为利用系统生物学和合成生物学手段构建高性能菌株提供了平台方法。
对产油酵母来说油脂含量是一个重要的指标,但其检测方法复杂。传统方法利用苏丹红染色法结合显微镜观察来确定油脂量;或者直接利用有机溶液提取油脂,测量油脂干重[2,5-6,11]。但这些方法较为复杂,操作上耗时耗力,很难实现高通量筛选。利用芯片可以实现油脂含量高通量筛选[12],但是芯片费用昂贵,也难以成为广泛使用的筛选方法。Kimura等研发了基于尼罗红荧光染色的油脂测定方法[13],该方法操作简单,重复性好,可用于构建油脂高通量筛选方法。
本论文利用新型 ARTP育种方法诱变产油酵母圆红冬孢酵母 Rhodosporidum toruloides,利用多孔板培养并结合胞内油滴的荧光染色法建立快速简便筛选突变体的方法,从而建立 ARTP快速诱变产油酵母的条件,并研究其突变株的特性。
1 材料与方法
1.1 材料
1.1.1 药品及仪器
酵母粉、蛋白胨、葡萄糖、琼脂粉、尼罗红、氯仿、甲醇等试剂均为分析纯,购自北京鼎国昌盛生物技术有限公司 (中国)、Sigma Aldrich等公司。
1.1.2 菌株
圆红冬孢酵母 Rhodosporidum toruloides ACCC 20341购自中国农业生物菌种保藏管理中心(ACCC)。
1.2 培养方法及保存方法
YEPD液体培养基组成 (g/L):酵母粉10、蛋白胨10、葡萄糖20。固体培养基在YEPD液体培养基的基础上加2% (W/V) 琼脂粉。菌株以用平板和三角瓶培养 (液体培养条件:150 r/min,30 ℃)。传代培养在固体平板上进行,培养好的平板放入4 ℃冰箱保管,每隔2周重新接种培养。
1.3 ARTP诱变方法
利用研究组自主开发的常压室温等离子体育种机 (ARTP) 进行酵母的诱变。该育种装置操作简单,在一定的电源功率、工作气流量、等离子体发射源与样品之间距离的条件下,诱变主要的可变操作参数是处理时间。本研究利用氦气作为工作气体,在表1所示的ARTP操作条件下,产生的等离子体温度在25 ℃~35 ℃。为了寻找最佳的诱变条件,首先需要得到致死率曲线。因此处理时间从10 s开始,依次增加到240 s,然后将处理的样品稀释涂平板,利用CFU方法来计算致死率。

表1 ARTP诱变条件Table 1 Operating conditions using ARTP
1.4 高通量筛选方法
为了快速筛选增殖速度快且产油量多的突变体,本研究建立了利用多孔板的高通量筛选方法。48孔板适合培养1 mL菌液,而且在培养过程中可以连续直接检测细胞吸光度,或者是结合96孔板检测其吸光度和相对油脂量。这一过程操作简便,96孔板一次可以检测96个样品,实现快速筛选。整体实验流程如图1所示。
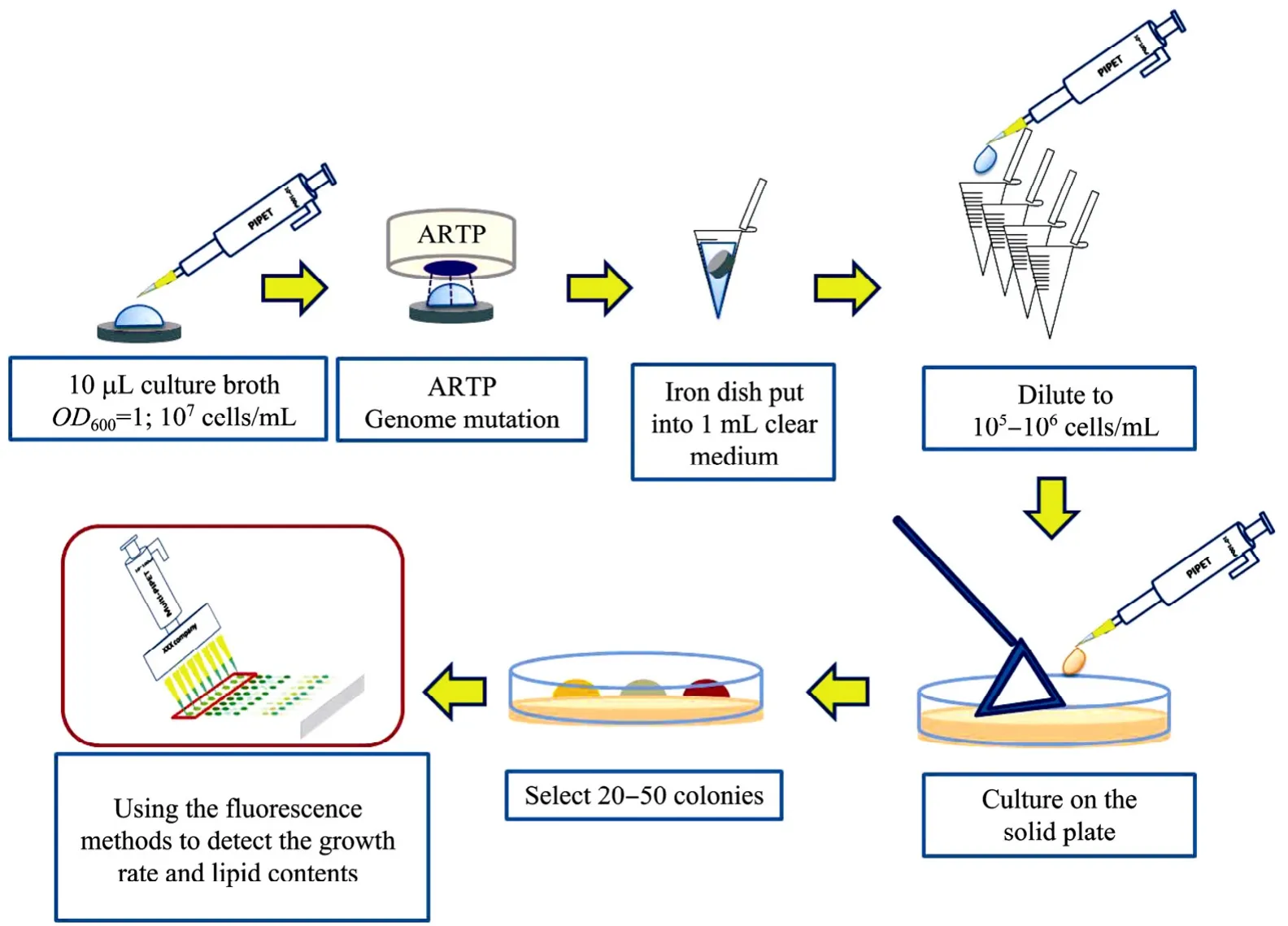
图1 ARTP诱变产油酵母及高通量筛选研究流程图Fig. 1 Schematic diagram of the process of oleoginous yeast mutation by ARTP and the high throughput screening.
1.4.1 增殖速度
为了筛选出增殖速度快的菌株,诱变得出的平板上的单菌落利用1 µL的接种环接到48孔板的各个孔中培养 (1 mL培养基/孔),在30 ℃、150 r/min的培养箱里培养,并每隔6 h把100 µL样品移到96孔板利用酶标仪 (DNA expert,Tecan,奥地利) 检测600 nm处的光学密度来表征细胞浓度。根据细胞浓度-时间曲线,计算出对数生长期的酵母增殖速度。
1.4.2 细胞内油脂量
每6 h从48孔板的培养液中取出100 µL菌液,先测600 nm的吸光度,然后再加5 µL尼罗红溶液(0.1 mg尼罗红/1 mL丙酮),混匀后在37 ℃,避光条件下放置5 min后用酶标仪检测胞内油脂量。检测时的发射光波长是 485 nm,吸收光波长是580 nm。为了计算油脂荧光强度,需要将测出的样品荧光强度减去没有加荧光剂的样品的背景荧光强度。
1.5 其他分析方法
1.5.1 生物量测定
发酵液离心去上清,收集沉淀,加入蒸馏水离心洗涤 3次,105 ℃烘干,称重。为了减少误差,每个样品做3个平行对照。
1.5.2 油脂提取
酵母的胞内油脂的提取按照Wu等方法[14]进行。
1.5.3 遗传稳定性分析
为了分析突变株的遗传稳定性,在固体平板上进行了6代传代培养,分析其增殖速度和产油能力。
1.5.4 突变率计算
诱变株的突变率的计算以增殖速度为准。增殖速度提高或降低20%以上的诱变株定义为突变株,增殖速度提高的突变株定义为正突变株。于是,突变率 (%) =突变株数/总诱变菌株数,正突变率 (%)=增殖速度提高20%以上的诱变株/总诱变菌株数。
2 结果与分析
2.1 ARTP诱变致死率曲线的测定
前期研究发现,等离子体对细菌细胞壁、细胞膜及蛋白质都有显著的作用效果,处理时间长会导致细胞壁部分或者完全破裂,释放出细胞内蛋白[15]。这是由于等离子体产生的活性粒子能够破坏细胞结构也能够穿过细胞壁到达细胞内,打断基因、蛋白键等,从而导致大部分微生物死亡[16]。但少数经过ARTP照射过的微生物会通过本身的自动修复系统修复存活,并在这一过程中产生基因突变。因此,选择合适的 ARTP操作条件能够实现微生物的快速诱变。
如图2所示,等离子体对圆红冬孢酵母杀伤力比较强,ARTP处理10 s会杀死80%的菌体;处理60 s以后致死率达到90%以上;处理240 s致死率达到 100%。突变本身具有随机性,其致死率和正突变之间的关系并不是十分清楚,主要取决于诱变方法和菌株本身的特性。本实验为了便于选择单菌落,选取致死率为99%的条件进行处理。
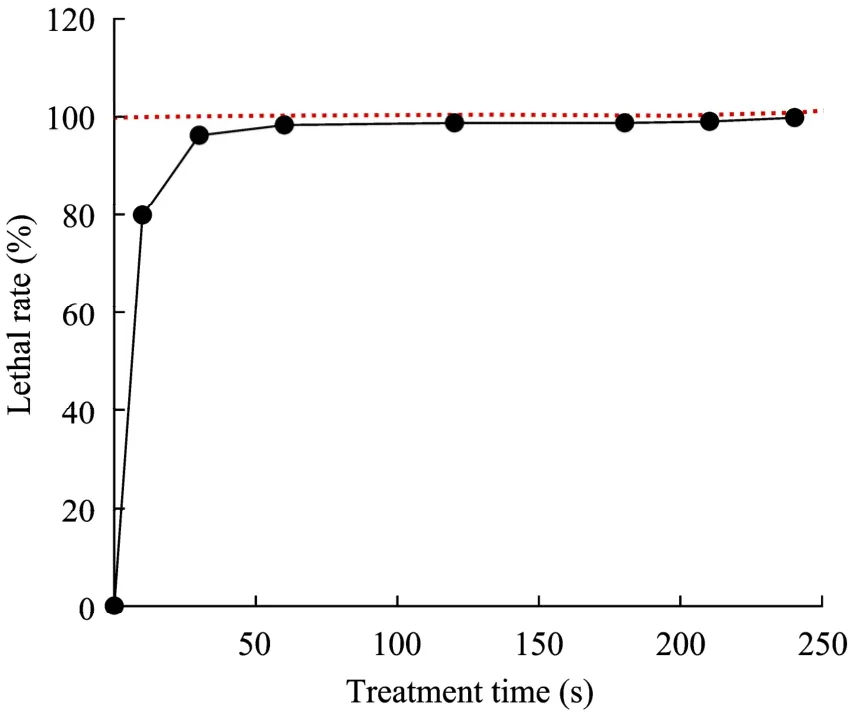
图2 产油酵母的致死率曲线Fig. 2 Variaton of the lethal rate of the oleoginous yeast with the ARTP treatment time.
2.2 酵母突变体的快速筛选
高通量筛选是获取目标诱变株的重要步骤之一。传统的筛选方法利用苏丹染色法染色,结合显微镜观察判断胞内油脂含量。这种方法可以用于少量菌株的筛选,但是很难实现高通量快速筛选。本论文建立的方法可以快速简便地实现几百个诱变株的筛选,且筛选结果重复性高。将经ARTP处理3 min的酵母稀释到106个/mL,并涂在平板培养基上,每个平板能长出20~30个菌落。将菌落转移到48孔板中培养,以实现高通量筛选。每6 h各取100 µL转移到96孔板检测吸光度,得出比增殖速度µ (h−1),然后继续加5 µL尼罗红荧光染剂,避光放置5 min后检测荧光强度。
图 3给出了原始菌株和诱变菌株的相对增殖速度和油脂含量 (培养48 h,原始菌为1)。有12株诱变菌的增殖速度提高到原始菌的 1.2倍以上 (最高达到2.3倍);以相对增殖速度为指标计算出的产油酵母的突变率为 47.2%,其中正突变率为 27.2%。挑选增殖速度和油脂产量都提高20%以上的突变株(C4,D4,F4,A7,A8和E8) 进行后续实验。
2.3 遗传稳定性分析
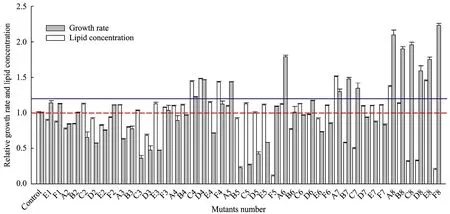
图3 原始菌和44个突变株 (培养48 h) 的相对增殖速度和相对油脂量 (虚线为原始菌的相对增殖速度和油脂量,实线是增殖速度和油脂量达到对照菌株1.2倍的位置)Fig. 3 The relative growth rates and lipid concentrations of the 44 mutants and the original strain (incubation for 48 h). The dotted line is for original strain, and solid line indicated the position where both relative growth rate and lipid concentration were 1.2 folds of those of the original strain.
为了检测突变体的遗传稳定性,传代过程中对各代的突变株进行增殖速度与油脂量分析。从 1代到 6代相对增殖速度与油脂量都保持稳定。对第 4代和第6代进行了24 h的三角瓶培养,并检测了此时的油脂干重以及油脂含量,分析结果表明,等离子体诱变的酵母突变体都保持着良好的遗传稳定性(表 2)。

表 2 传代四次和六次后的突变体的油脂产量与油脂含量 (培养24 h)Table 2 The Lipid concentration and contents of the mutants at the forth and sixth subculture (incubation for 24 h)
2.4 高产突变株的发酵特性
经过高通量筛选获得的6株突变株 (C4,D4,F4,A7,A8和 E8) 的增殖速度及相对油脂量均提高到了原始菌的 1.2倍以上。为了检测筛选到的菌株的准确油脂含量、了解这些高产突变株的培养特性,本文进行了三角瓶发酵培养,并检测了细胞的增殖速度及油脂含量。如图 4、5所示,发酵 78 h后,原始菌的细胞干重达到了8.4 g/L,而增殖速度最快的突变株 (C4,E8) 的生物量达到了12.3 g/L,此外,突变株C4的油脂量达到原始菌的2.2倍左右。文献中对圆红冬孢酵母产油特性的研究表明[3],酵母产油发酵有2个阶段,第一个阶段是细胞增殖期,第二阶段是产油期,而且在产油培养基中,当葡萄糖浓度从10 g/L增加到90 g/L,产油量会从1.13 g/L达到8.63 g/L,而以40 g/L葡萄糖为碳源,圆红冬孢酵母的油脂产量约为 2.5 g/L。在本研究采用的YEPD培养基中,当培养到40 h的时候,90%以上的葡萄糖已被消耗掉,这时候生物量增殖慢,细胞进入积累油脂期,因而油脂开始积累。突变株 C4在没有优化培养基的条件下,20 g/L葡萄糖培养基中的产油量达到了4.07 g/L,远高于原始菌株,表明突变菌种的产油效率得到了提高。三角瓶发酵分析结果与高通量筛选结果趋势一致,说明本文建立的高通量筛选方法可行,能够用于高产油脂酵母的筛选。由于本论文是以 ARTP诱变酵母方法为主要研究目的,采用YEPD培养基获得了油脂含量显著提高的突变株,但对酵母发酵产油条件优化包括培养基组成的优化需要进一步的研究。
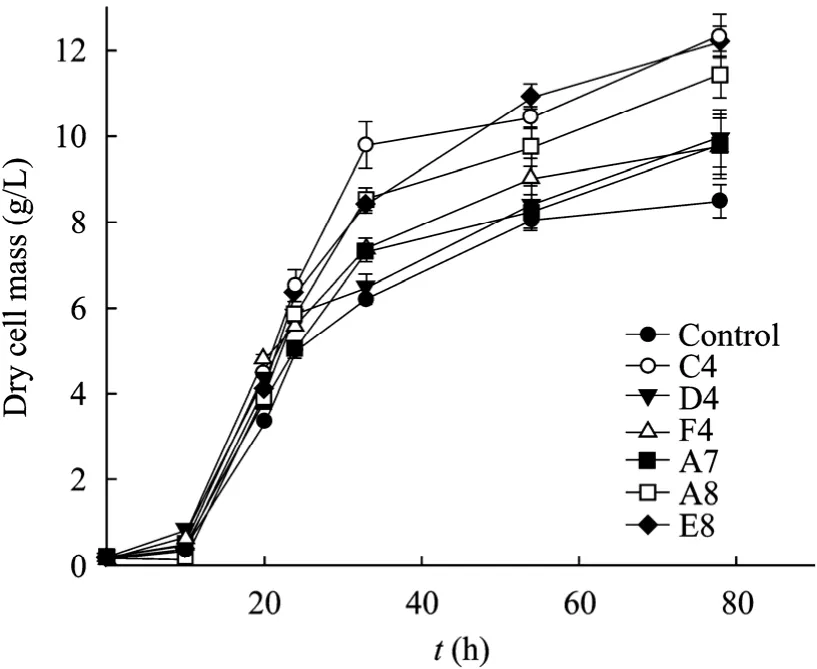
图4 对照菌和6个突变株的细胞生长曲线Fig. 4 Cell growth curves of the six mutants and the original strain.
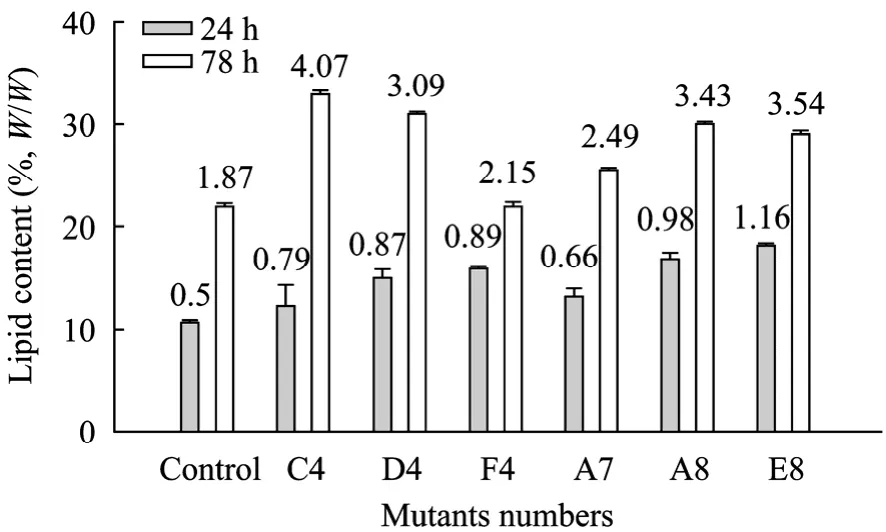
图5 高产突变株和对照菌株的油脂含量比较 (图里的数字表示相应条件下油脂浓度 (g/L))Fig. 5 Comparisons of the lipid contents of the high-yield of lipid mutants and the original strain. The numbers in this figure represent the lipid concentrations (g/L) of the corresponding strains.
3 结论
本研究表明,ARTP诱变育种方法能够快速有效地诱变产油酵母Rhodosporidium toruloides,而且突变效果良好。通过对44个诱变株的筛选,以增殖速度为指标的突变率为 47.2%,其中正突变率达到27.2%。以增殖速度和油脂产量为指标,建立了基于尼罗红染色的高通量筛选方法,通过这种方法筛选到一株高产油脂的突变株 (C4),该突变株在YEPD培养基中培养78 h,产油量为原始菌的2.2倍,生物量也提高到了原始菌株的1.5倍。
REFERENCES
[1] Meng X, Yang JM, Xu X, et al. Biodiesel production from oleaginous microorganisms. Renewable Energy, 2009,34(1): 1−5.
[2] Chanchaichaovivat A, Ruenwongsa P, Panijpan B.Screening and identification of yeast strains from fruits and vegetables: potential for biological control of postharvest chilli anthracnose (Colletotrichum capsici).Biological Control, 2007, 42(3): 326−335.
[3] Li YH, Zhao ZB, Bai FW. High-density cultivation of oleaginous yeast Rhodosporidium toruloides Y4 in fed-batch culture. Enzyme Microbial Technol, 2007,41(3): 312−317.
[4] Li YH, Liu B, Zhao ZB, et al. Optimization of culture conditions for lipid production by Rhodosporidium toruloides. Chin J Biotech, 2006, 22(4): 650−656.
[5] Pan LX, Yang DF, Huang SY, et al. Screening of oleaginous yeast by utilizing xylose by microwave irradiation mutation. China Brewing, 2009, 204(3): 62−64.
[6] Zhang J, Shen DH, Zheng XD. Researches on mutation breeding and fermantation conditions of oleaginous yeast.J Zhejiang Univ, 2009, 35(5): 497−502.
[7] Li HP, Li G, Sun WT, et al. Radio-frequency,atmospheirc-pressure glow discharges: producing methods, characteristics and applications in bio-medical fields. Complex Systems, 2008, 982: 584−591.
[8] Li G, Li HP, Wang LY, et al. Genetic effects of radio-frequency, atmospheric-pressure glow discharges with helium. Appl Physics Lett, 2008, 92(22): 221504.
[9] Wang LY, Huang ZL, Li G, et al. Novel mutation breeding method for Streptomyces avermitilis using an atmospheric pressure glow discharge plasma. J Appl Microbiol, 2010,108(3): 851−858.
[10] Wang LY. Studies on the mechanisms and applications of the atomospheric room temprature plasmas acting on the microbes. Beijing: Tsinghua University, 2010.王立言. 常压室温等离子体对微生物的作用机理及其应用基础研究[D]. 北京: 清华大学, 2010.
[11] Asefa DT, Møretrø T, Gjerde RO, et al. Yeast diversity and dynamics in the production processes of Norwegian dry-cured meat products. Int J Food Microbiol, 2009,133(1/2): 135−140.
[12] Lin SS, Fischl AS, Bi XH, et al. Separation of phospholipids in microfluidic chip device: application to high-throughput screening assays for lipid-modifying enzymes. Anal Biochem, 2003, 314(1): 97−107.
[13] Kimura K, Yamaoka M, Kamisaka Y. Rapid estimation of lipids in oleaginous fungi and yeasts using Nile red fluorescence. J Microbiol Methods, 2004, 56(3): 331−338.[14] Wu SG, Hu CM, Jin GJ, et al. Phosphate-limitation mediated lipid production by Rhodosporidium toruloides.Biores Technol, 2010, 101(15): 6124−6129.
[15] Pompl R, Jamitzky F, Shimizu T, et al. The effect of low-temperature plasma on bacteria as observed by repeated AFM imaging. New J Physics, 2009, 11(11):115023.
[16] Morfill GE, Kong MG, Zimmermann JL. Focus on plasma medicine. New J Physics, 2009, 11(11): 115011.
Operating conditions for the rapid mutation of the oleaginous yeast by atmospheric and room temperature plasmas and the characteristics of the mutants
Lihua Jin1, Mingyue Fang1, Chong Zhang1, Peixia Jiang1, Nan Ge2, Heping Li2, Xinhui Xing1,and Chengyu Bao2
1 Department of Chemical Engineering, Tsinghua University, Beijing 100084, China
2 Department of Engineering Physics, Tsinghua University, Beijing 100084, China
Received: December 1, 2010; Accepted: February 18, 2011
Supported by: National Basic Research Program of China (973 Program) (No. 2009CB724702), Korea Institute of Science and Technology (KIST),Japan Science and Technology Agency Core Research for Evolutional Science and Technology (CREST), Japan and China Postdoctoral Science Foundation (No. 20080430367).
Corresponding author: Xinhui Xing. Tel/Fax: +86-10-62787472; E-mail: xhxing@tsinghua.edu.cn Heping Li. Tel/Fax: +86-10-62782816; E-mail: liheping@tsinghua.edu.cn
国家重点基础研究发展计划 (973计划) (No. 2009CB724702),韩国 KIST项目,日本 JST CREST项目,中国博士后科学基金项目 (No.20080430367) 资助。

