响应面法优化黑曲霉HDF05产β-葡萄糖苷酶过程参数
凌宏志,葛菁萍,平文祥,许修宏
1 东北农业大学资源与环境学院,哈尔滨 150080
2 黑龙江大学生命科学学院 微生物黑龙江省高校重点实验室,哈尔滨 150080
响应面法优化黑曲霉HDF05产β-葡萄糖苷酶过程参数
凌宏志1,2,葛菁萍2,平文祥2,许修宏1
1 东北农业大学资源与环境学院,哈尔滨 150080
2 黑龙江大学生命科学学院 微生物黑龙江省高校重点实验室,哈尔滨 150080
为获得黑曲霉 Aspergillus niger HDF05菌株较高的 β-葡萄糖苷酶酶活,对其发酵条件进行了优化。采用Plackett-Burman实验设计考察关键发酵操作参数对产酶的影响。继而采用最陡爬坡路径逼近最大响应区域,并结合中心组合实验和响应面对4个显著性因素进行分析。Plackett-Burman实验结果表明,发酵温度、装液量、麦麸和 (NH4)2SO4浓度对 β-葡萄糖苷酶合成影响显著。通过响应面分析得到一元二阶方程,对方程求解得到优化的发酵过程参数:发酵温度为28 ℃,装液量为71.4 mL/250 mL,麸皮浓度为36 g/L,(NH4)2SO4浓度为5.5 g/L。采用该优化的过程参数,菌株的最大产β-葡萄糖苷酶活力可达60.06 U/mL,较优化前提高了23.9%。将黑曲霉HDF05产生的β-葡萄糖苷酶用于酸解玉米芯纤维残渣的酶解实验中,可明显降低纤维二糖的积累,48 h内可使玉米芯纤维素残渣酶解得率达到80.4%。
黑曲霉,β-葡萄糖苷酶,响应面,过程参数优化
Abstract:In order to obtain high β-glucosidase productivity, we optimized the fermentation parameters for β-glucosidase production by Aspergillus niger HDF05. First, we screened the important parameters by Plackeet-burman design. Second, we usedthe path of steepest ascent to approach to the biggest response region of parameters affecting β-glucosidase production. Then, we obtained the optimal parameters by central composite design and response surface analysis. We developed a quadratic polynomial equation for predicting β-glucosidase production level. The results showed that the important parameters were temperature, packing volume, concentrations of wheat bran and (NH4)2SO4. The optimal fermentation parameters were as follows: temperature 28 °C,packing volume 71.4 mL/250 mL, wheat bran 36 g/L and (NH4)2SO45.5 g/L. Under the optimal conditions, we obtained the maximum enzyme activity of 60.06 U/mL, with an increase of 23.9% compared to the original fermentation parameters. During enzymatic hydrolysis of acid-pretreated corncob, addition of β-glucosidase from Aspergillus niger HDF05 greatly reduced the inhibition caused by cellobiose, and the hydrolysis yield was improved from 66.7% to 80.4%.
Keywords:Aspergillus niger, β-glucosidase, response surface methodology, parameters optimization
我国纤维质资源非常丰富,其中工业纤维质废渣每年有数千万吨。如能利用生物技术手段将其中一部分转化为酒精,无疑是解决现行酒精生产工艺中“与人争粮”的重要途径之一。而利用纤维质为原料生产酒精,纤维素酶的作用在其中起到至关重要的作用。β-葡萄糖苷酶 (EC3.2.1.21),又称 β-D-葡萄糖苷葡萄糖水解酶,是纤维素酶系的一个组成成分,能够参与纤维素的水解[1]。β-葡萄糖苷酶因其具有较高反应温度,较好的酸碱耐受性,从而比较适合工业生产使用。β-葡萄糖苷酶广泛存在于植物、昆虫和微生物中,而通过微生物发酵法是获得该酶的主要途径。目前发酵法生产 β-葡萄糖苷酶主要采用木霉和曲霉,多数研究也以它们为出发菌株[2-4]。但木霉菌发酵产物中存在多种真菌毒素,有毒性嫌疑;另一方面 β-葡萄糖苷酶活力很低,因而其应用范围受到限制。黑曲霉能够优质高产多种纤维素酶,尤以 β-葡萄糖苷酶的活力较高,且性状稳定并具有较强的抗代谢阻遏能力,因此具有明显的工业应用价值[5]。国内外对黑曲霉固态和液态发酵生产 β-葡萄糖苷酶工艺都进行了相关的研究并取得一定成果,由于固态发酵自身的一些缺陷,现阶段研究大都集中在液态发酵。但目前黑曲霉发酵生产 β-葡萄糖苷酶酶活力还相对较低,通过基因工程技术构建高产菌株固然是一个解决方案,但对其发酵工艺进行优化也是提高酶产量的一个有限途径。本文对一株黑曲霉发酵过程参数进行优化,以期达到提高 β-葡萄糖苷酶产量的目的。
优化发酵过程参数对产酶的影响通常采用单因素实验设计,但其未考虑各成分之间的交互作用,因而无法提供未考察区域的信息,以及进行预测和控制。响应面法 (Response surface methodology,RSM) 是一种综合实验设计和数学建模的优化方法,可同时对多因子水平及其交互作用进行优化与评价,并能快速有效地确定多因子系统的最优条件[6]。近年来 RSM 应用于生物反应过程的优化已有很多报道[7-10]。本研究以一株产 β-葡萄糖苷酶的黑曲霉HDF05为材料,首先采用Plackett-Burman实验设计对影响其产 β-葡萄糖苷酶的各个因素进行考察和评价,然后对筛选得到的重要因素采用中心组合实验设计 (Central composite design) 进行优化,通过实验数据拟合响应面模型并进行数学处理,得到最优的发酵参数,以期为 β-葡萄糖苷酶的工业化生产和应用奠定基础。
1 材料与方法
1.1 实验材料与仪器
1.1.1 菌株
黑曲霉Aspergillus niger HDF05,由本实验室保藏。
1.1.2 培养基
斜面培养基:使用PDA培养基[11];发酵培养基:20 g 麦麸,3 g蛋白胨,2 g K2HPO4,0.5 g MgSO4·7H2O,4 g (NH4)2SO4,0.5 g CaCl2,溶于1 000 mL蒸馏水中,自然pH。
1.1.3 主要试剂
对-硝基苯基-β-D-葡萄糖苷(p-NPG)由 Sigma 公司生产,其他化学试剂均为国产分析纯。
1.1.4 主要实验仪器
HQL300A 恒温冷冻摇床 (中国科学院武汉科学仪器厂);TGL-16B 高速台式离心机 (上海安亭科学仪器厂);722S 紫外可见分光光度计 (上海精密科学仪器有限公司);PL1501-S电子天平 (梅特勒-托利多仪器上海有限公司)。
1.2 实验方法
1.2.1 种子悬液的制备方法
用无菌水将斜面培养基上的孢子洗脱至250 mL 带玻璃珠的三角瓶中,在摇床中200 r/min振荡 30 min,而后将孢子浓度调整至 1×107个/mL制得种子液。以10%的接种量接入到发酵培养基中。
1.2.2 β-葡萄糖苷酶粗酶液制备方法
从摇瓶中取发酵液,10 000 r/min条件下离心10 min,上清液即为β-葡萄糖苷酶粗酶液。
1.2.3 β-葡萄糖苷酶活力测定方法
取适当稀释的酶液 0.1 mL于试管中,加入20 mmol/L 的对-硝基苯基-β-D-葡萄糖苷 (p-NPG)0.1 mL和pH 6.5磷酸缓冲溶液0.8 mL,50 ℃反应30 min。向反应体系中加入3 mL 1 mol/L的Na2CO3溶液终止反应,在400 nm波长下测吸光度。加热失活的酶液作为空白对照。酶活力的定义:在上述测定条件下每分钟释放出 1 µmol对-硝基苯酚所需要的酶量为一个酶活力单位 (U)[12]。
1.2.4 Plackett-Burman实验设计
根据对黑曲霉HDF05发酵生产β-葡萄糖苷酶过程中各参数的单因素考察结果 (数据未列出),在优化初期利用Plackett-Burman设计法,以温度 (X1)、装液量 (X2)、麦麸 (X3)、蛋白胨 (X4)、(NH4)2SO4(X5)、MgSO4·7H2O (X6) 为试验因子,对这 6 种发酵过程参数进行两水平试验设计,实验次数为12次。拟合出线性方程:

式中:X1、X2、X3、X4、X5、X6分别为各发酵过程参数,Y为酶活力 (U/mL),a0、a1、a2、a3、a4、a5、a6为方程系数。
1.2.5 最陡爬坡实验设计
响应面拟合方程只在考察的紧接邻域里才充分近似真实情形,在其他区域拟合方程与被近似的函数方程毫无相似之处,几乎无意义。最陡爬坡试验以拟合的一阶模型的回归系数的符号和大小来设计(正效应的因素均取较高值,负效应的因素均取较低值) 显著因素的最陡上升路径,通过使主要因素同时朝响应值增大的方向变化找出峰值,从而逼近最大响应区域[13]。本试验可得到最接近最佳值的显著因素取值,并将其作为中心组合试验设计的中心点取值。
1.2.6 中心组合实验设计
4因素5水平的中心组合实验共需30次实验,拟合出一个二次多项式方程。该方程可描述响应变量与自变量的经验模型。对于3因子模型,方程可表述为:
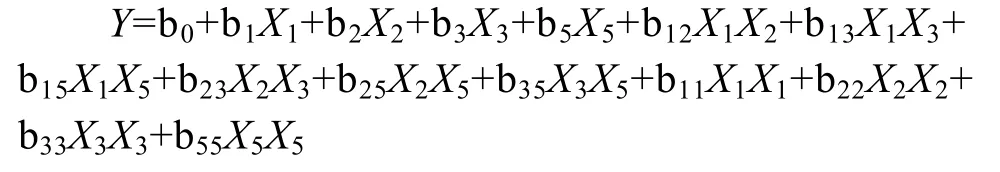
式中:X1、X2、X3、X5为由部分因子实验确定对响应值有显著影响的 4种发酵过程参数,Y为预测响应值,即酶活力 (U/mL),b0、b1、b2、b3、b5、b12、b13、b15、b23、b25、b35、b11、b22、b33、b55为方程系数。用统计软件Design-Expert (Version7.1.3)对实验进行回归分析,用F (Fischer) 检验评价数学模型方程的显著性,方程的拟合性由确定系数 R2确定。
1.2.7 模型验证
对该多元函数进行简单的性状分析便可确定出其最大酶活点以及取得最大酶活的相应的发酵过程参数的取值,采用最终所得的优化培养基组成对模型进行验证试验,如模型可靠便可确定黑曲霉HDF05发酵的最佳发酵工艺。
1.2.8 纤维原料预处理
玉米芯预处理方法按文献[14]所述,预处理后纤维残渣成分为:纤维素 54%,半纤维素 5.3%,木质素29.2%,其他11.5%。
1.2.9 添加β-葡萄糖苷酶粗酶液酶解玉米芯纤维残渣
酶解在50 mL磨口锥形瓶中进行,底物质量浓度为130 g/L,加入一定量按1.2.2方法制备的粗酶制剂 (纤维素酶用量为20 U/g底物,β-葡萄糖苷酶用量为3 U/g底物),在 pH值 4.8、45 ℃条件下水解。酶解得率(Y)按下式计算:
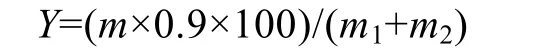
式中:m-还原糖总量,m1-底物中纤维素质量,m2-底物中半纤维质量。
1.2.10 酶解液中糖分分析方法
玉米芯纤维残渣酶解后,酶解液中各种糖分的分析按文献[15]所述方法进行。
2 结果与分析
2.1 重要因素的筛选
采用Plackett-Burman实验设计,对发酵过程中6 个过程参数进行考察,每个因子取高 (+1) 和低(−1) 2个水平 (表1)。各因素所代表的参数水平和方差分析结果见表2。
表2结果表明,研究的6个因素中,发酵温度、装液量、麸皮和硫酸铵的浓度对 β-葡萄糖苷酶产量存在显著影响,并进行下一步最陡爬坡试验。而其他2个因素,蛋白胨和MgSO4·7H2O对β-葡萄糖苷酶的产量没有显著影响。因此在后续试验中的取值确定为Plackett-burman试验设计的高点取值。而各因素对产酶的影响可用以下方程表示:

表1 Plackett-Burman实验设计与响应值Table 1 Plackett-Burman design and responding value
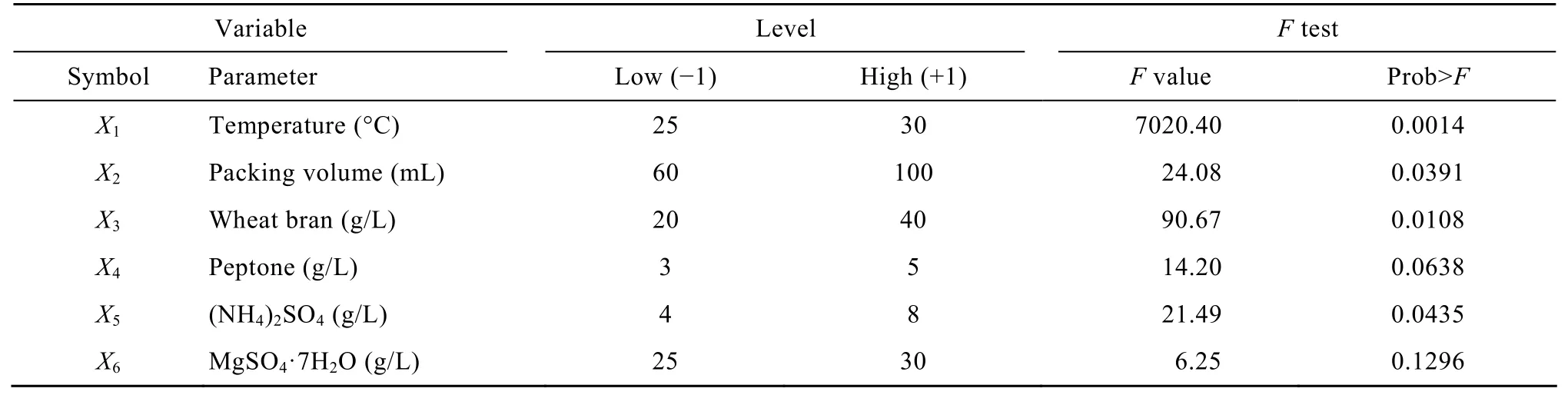
表2 各种因素的影响Table 2 Effects of different factors
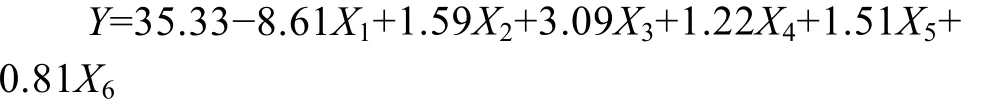
方程的决定系数 R2=0.9980,表明该回归方程拟合良好。由显著因子效应可看出,要提高产酶量,应适当提高装液量、麦麸和 (NH4)2SO4浓度,降低温度。
2.2 最陡爬坡实验研究最大响应值的响应区域
响应面拟合方程只有在考察的临近区域里才能充分近似真实情况,故应先逼近最大产酶区域后再建立有效的拟合方程。根据Plackett-Burman法筛选出的显著因子效应大小设计它们的步长,进行最陡爬坡试验设计,寻找最大产酶区。试验设计及结果如表3所示。最大产酶区在第3次试验附近,故以试验3的条件为响应面实验因素水平的中心点。响应面实验因素水平见表4。

表3 最陡爬坡试验设计及结果Table 3 Experimental design and results of steepest ascent
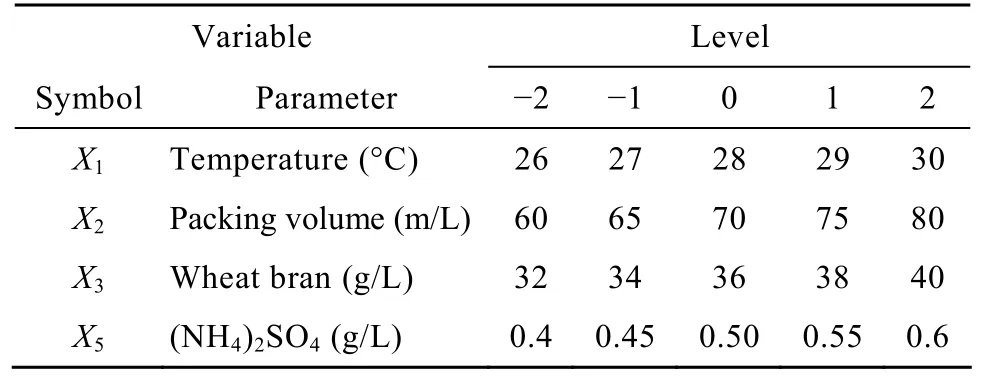
表4 响应面分析试验因素水平表Table 4 Factors and level value of response surface analysis
2.3 中心组合实验优化培养基浓度
采用Central composite design响应面试验设计确定显著因子的最优水平,试验设计见表 5。由Design-Expert (Version7.1.3) 软件拟合得到多元回归模型:

模型回归分析见表6。决定系数R2=0.8948,说明回归方程的拟合较好。模型的P<0.0001,该值远远小于0.05,表明回归方程的F检验显著,所拟合的二次回归方程适合。由响应面回归分析和回归方程拟合绘制响应面图形 (图1)。

表5 中心组合响应面设计及试验结果Table 5 Response surface central composite design and corresponding response
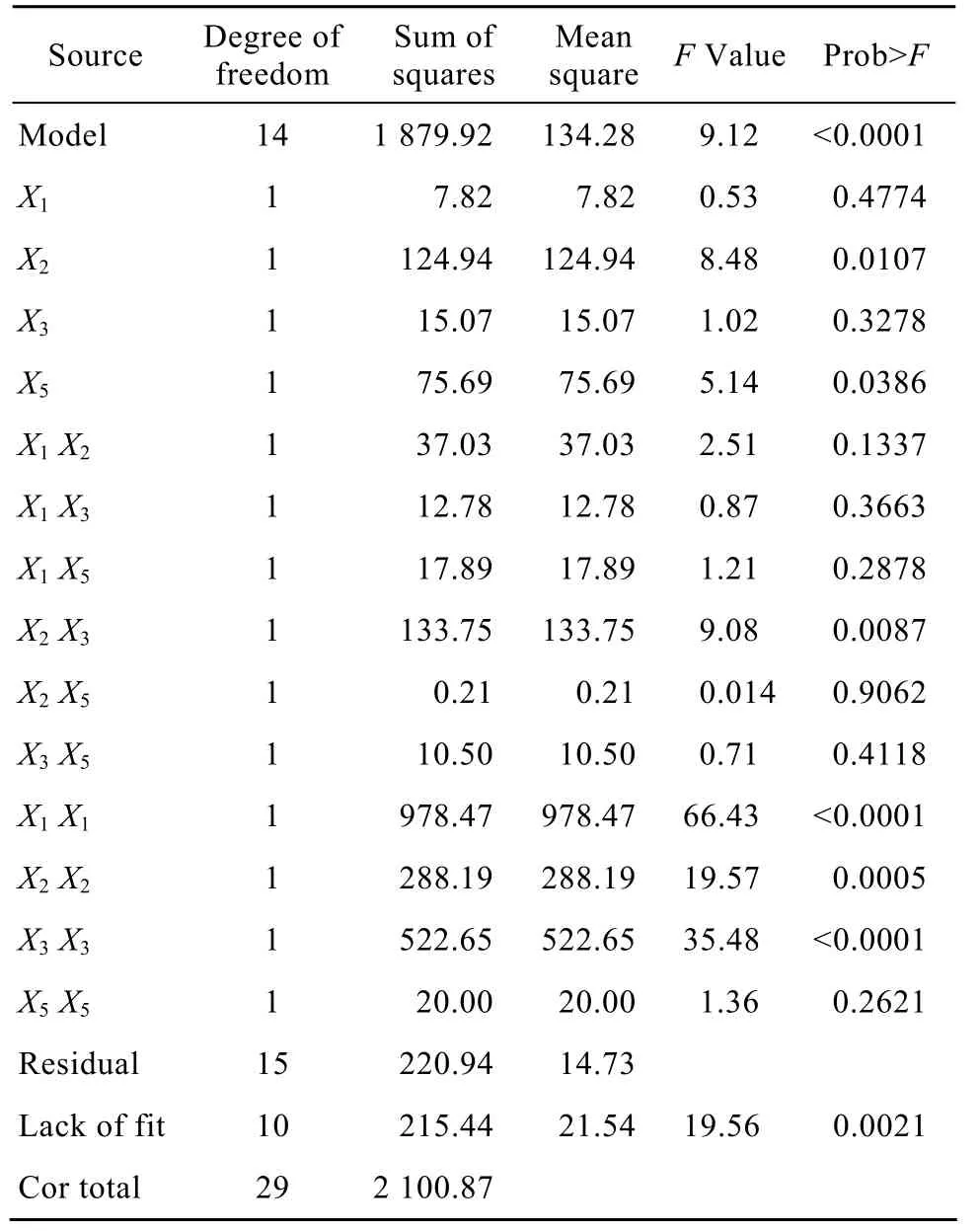
表6 回归分析结果Table 6 Results of regression analysis

图1 装液量和麦麸浓度对酶活力影响的响应面图Fig. 1 Surface layer of the mutual-affection of packing volume and wheat bran concentration on enzyme activity.
由图 1的三维响应面图可看出,X1、X2、X3、X5存在极值点。对方程求导,得到模型的极值点,4个因子最优试验点 (X1、X2、X3、X5) 的代码值 (0.09、0.28、0.08、1.00),即发酵温度为 28.09 ℃,装液量为 71.37 mL/250 mL,麸皮浓度为 36.17 g/L,(NH4)2SO4浓度为 5.5 g/L,此时模型预测的极大值为59.33 U/mL。为实际操作方便,确定培养基的最优配方为:发酵温度为 28 ℃,装液量为 71.4 mL/250 mL,麸皮浓度为 36 g/L,(NH4)2SO4浓度为5.5 g/L。
2.4 验证实验
在其余培养基成分和培养条件不变的情况下,在初始发酵条件和优化发酵条件下分别进行3组摇瓶发酵实验,初始发酵条件所得酶活分别为46.13、45.26、45.71 U/mL,平均酶活力为45.7 U/mL,优化发酵条件所得酶活分别为 60.54、59.54、60.11 U/mL,平均酶活力为60.06 U/mL,条件优化后酶活提高了 23.9%,与模型预测值非常接近,说明该数学模型能准确预见实际发酵情况。
利用数理统计方法优化黑曲霉发酵产 β-葡萄糖苷酶已有一些报道[16-17]。许晓鹏等[16]以正交试验法对黑曲霉发酵培养基进行优化,使其 β-葡萄糖苷酶活力达 59.86 U/mL。田毅红等[17]采用单因素试验法对产 β-葡萄糖苷酶的培养基进行优化,获得最高 β-葡萄糖苷酶活力为 54.15 U/mL。本研究对黑曲霉HDF05发酵过程参数优化后产酶能力处于较优水平。
2.5 玉米芯纤维残渣的酶解
玉米芯纤维残渣 (含纤维素54%,半纤维素5.3%,木质素 29.2%) 用纤维素酶和 β-葡萄糖苷酶酶解 (纤维素酶用量为20 U/g底物,β-葡萄糖苷酶用量为3 U/g底物)。酶解48 h之后,酶解液中各组分含量见表 7。单独使用纤维素酶进行酶解时,还原糖浓度达到52.1 g/L,酶解得率为66.7%,而纤维素酶与β-葡萄糖苷酶一起使用时,还原糖浓度可达63.4 g/L,酶解得率可达 80.4%。这说明在单独使用纤维素酶进行玉米芯纤维残渣的酶解时,纤维素酶的酶活在纤维二糖积累到一定程度时受到抑制,而加入 β-葡萄糖苷酶可起到降解纤维二糖从而解决纤维素酶酶活被抑制的问题,进一步提高酶解的得率。
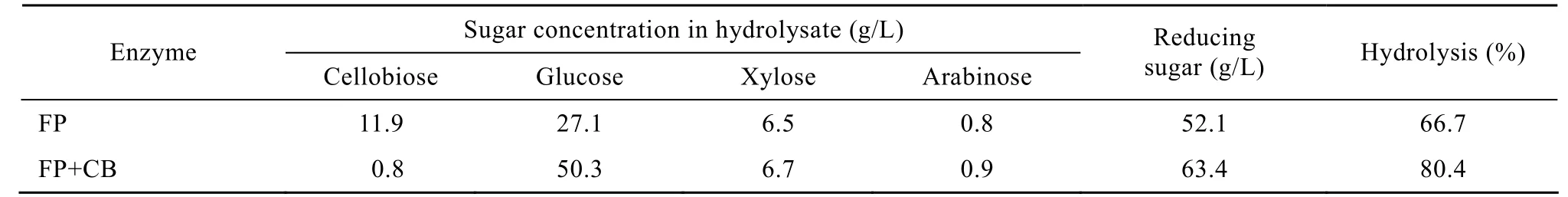
表7 不同酶处理对酶解玉米芯纤维残渣的影响Table 7 Results of hydrolysis by cellulase and β-glucosidase from A. niger HDF05
3 结论
采用响应面优化法可快速筛选影响黑曲霉HDF05菌株产β-葡萄糖苷酶发酵过程参数的显著因素,并通过建立多项数学模型,采用统计分析对模型进行显著性检验来优化发酵过程参数。优化得到的最优发酵过程参数为:发酵温度为28 ℃,装液量为71.4 mL/250 mL,麸皮浓度为36 g/L,(NH4)2SO4浓度为 5.5 g/L。在优化的条件下,黑曲霉 HDF05菌株的β-葡萄糖苷酶活力达60.06 U/mL,较优化前提高了23.9%。将黑曲霉HDF05产生的β-葡萄糖苷用于酸解玉米芯纤维残渣的酶解实验中,48 h可使酶解玉米芯纤维素残渣得率升至80.4%。
REFERENCES
[1] Zhao LG, Zhou TC, Meng P. Screening of β-glucosidase producing strain and analysis of cellulase composition. Ind Microbiol, 2007, 37(5): 47−50.
赵林果, 周潭澈, 孟鹏. β-葡萄糖苷酶产生菌的筛选及其所产纤维素酶酶系组成分析. 工业微生物, 2007,37(5): 47−50.
[2] Yan HP, Chen SH, Wu XQ. Review of the study on β-glucosidase from Aspergillus niger. J Cellul Sci Tech,2007, 15(1): 59−63.
闫会平, 陈士华, 吴兴泉. 黑曲霉 β-葡萄糖苷酶的研究进展. 纤维素科学与技术, 2007, 15(1): 59−63.
[3] Zhang HB, Chen XD, Hu XQ, et al. Study on fermentation conditions of Trichoderma reesei for producing cellulase.Food Sci, 2008, 29(11): 375−378.
张洪斌, 陈贤东, 胡雪芹, 等. 一株里氏木霉产纤维素酶发酵条件的研究. 食品科学, 2008, 29(11): 375−378.
[4] Martins LF, Kolling D, Camassola M, et al. Comparison of Penicillium echinulatum and Trichoderma reesei cellulases in relation to their activity against various cellulosic substrates. Bioresour Technol, 2008, 99(5):1417−1424.
[5] Nielsen J. Modelling the growth of filamentous fungi. Adv Biochem Eng Biotechnol, 1992, 46: 187−223.
[6] Montgomery DC. Design and Analysis of Experiments.5th ed. New York: John Wiley and Sons, 2001: 451−463.
[7] Li W, Du W, Liu, DH. Optimization of whole cell-catalyzed methanolysis of soybean oil for biodiesel production using response surface methodology. J Mol Catal B: Enzym, 2007, 45(3/4): 122−127.
[8] Wang P, Sun LM, He JY. Medium optimization for enhanced production of carbonyl reductase by Candida tropicalis 104 by response surface methodology. Chin J Biotech, 2009, 25(6): 863−868.
王普, 孙立明, 何军邀. 响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基. 生物工程学报,2009, 25(6): 863−868.
[9] Shen NK, Wang QY, Lu Y, et al. Enhancing ethanol production using thermophilic yeast by response surface methodology. Chin J Biotech, 2010, 26(1): 42−47.
申乃坤, 王青艳, 陆雁, 等. 响应面法优化耐高温酵母生产高浓度乙醇. 生物工程学报, 2010, 26(1): 42−47.
[10] Sampaio FC, De Faveri D, Mantovani HC, et al. Use of response surface methodology for optimization of xylitol production by the new yeast strain Debaryomyces hansenii UFV-170. J Food Eng, 2006, 76(3): 376−386.
[11] Shen P, Fan XR, Li GW. Microbiology Experiment. 3rd ed. Beijing: Higher Education Press, 1999.
沈萍, 范秀容, 李广武. 微生物学实验. 3版. 北京: 高等教育出版社, 1999.
[12] Cai YJ, Buswell JA, Chang ST. β-glucosidase components of the cellulolytic system of the edible straw mushroom,Volvariella volvacea. Enzyme Microb Technol, 1998,22(2): 122−129.
[13] Luo JM, Jin ZH, Cen PL. Optimization of protoplast regeneration medium composition for Streptomycesgilvosporeus by response surface methodology. J Chem Eng Chin Univ, 2006, 20(1): 68−73.
骆健美, 金志华, 岑沛霖. 褐黄孢链霉菌纳他霉素发酵条件优化. 高校化学工程学报, 2006, 20(1): 68−73.
[14] Shen XL, Xia LM. Production and immobilization of cellobiase from Aspergillus niger ZU207. Process Biochem, 2004, 39: 1363−1367.
[15] Chen M, Xia LM, Xue PJ. Enzymatic hydrolysis of corncob and ethanol production from cellulosic hydrolysate. Int Biodeterior Biodegrad, 2007, 59: 85−89.
[16] Xu XP, Yuan SF, Liu LM. Optimization of culture medium for producing high β-glucosidase by Aspergillus niger mutant. J Food Sci Biotechnol, 2008, 27(5): 124−127.
许晓鹏, 袁士芳, 刘立明. 突变黑曲霉高产 β-葡萄糖苷酶的培养基优化. 食品与生物技术学报, 2008, 27(5):124−127.
[17] Tian YH, Zhang X, Li DY, et al. Study on the optimization of the fermentation medium of β-glucosidase produced by Aspergillus niger. Liquor-Making Sci Technol, 2010(3):20−23.
田毅红, 张鑫, 李德莹, 等. 黑曲霉产 β-葡萄糖苷酶培养基的优化研究. 酿酒科技, 2010(3): 20−23.
Fermentation optimization by response surface methodology for enhanced production of β-glucosidase of Aspergillus niger HDF05
Hongzhi Ling1,2, Jingping Ge2, Wenxiang Ping2, and Xiuhong Xu1
1 College of Resource and Environment, Northeast Agricultural University, Harbin 150030, China
2 Key Laboratory of Microbiology, College of Life Sciences, Heilongjiang University, Harbin 150080, China
Received: August 2, 2010; Accepted: November 11, 2010
Supported by: National High Technology Research and Development Program of China (863 Program) (No. 2007AA100702-6), Key Technology Research and Development Program of Heilongjiang Science and Technology Bureau (No. GA07B401-6), Special Fund for Scientific and Technological Innovative Talents in Harbin (No. RC2010XK002028), Educational Commission of Heilongjiang Province of China (No. 11551z011), National Natural Science Foundation of China (No. 31070446), High-level Talents (Innoration Team) Projects of Heilongjiang University (No. hdtd2010-17).
Corresponding author: Xiuhong Xu. Tel: +86-451-55191137; E-mail: howard2857@hotmail.com Wenxiang Ping. Tel: +86-451-86608046; E-mail: wenxiangp@yahoo.com.cn
国家高技术研究发展计划 (863计划) (No. 2007AA100702-6),黑龙江省科技攻关重大项目 (No. GA07B401-6),哈尔滨市科技创新人才研究专项资金 (No. RC2010XK002028),黑龙江省教育厅重点项目 (No. 11551z011),国家自然科学基金 (No. 31070446),黑龙江大学高层次人才 (创新团队) 支持计划 (No. hdtd2010-17) 资助。

