紫甘薯花色苷对人肝癌细胞HepG2的作用
曹东旭,董海叶,李 妍,吕晓玲
(1. 天津科技大学食品工程与生物技术学院,天津 300457;2. 天津市食品加工工程中心,天津 300457)
紫甘薯花色苷对人肝癌细胞HepG2的作用
曹东旭1,2,董海叶1,李 妍1,吕晓玲1
(1. 天津科技大学食品工程与生物技术学院,天津 300457;2. 天津市食品加工工程中心,天津 300457)
以人肝癌细胞HepG2为模型研究紫甘薯花色苷的抗肿瘤活性.通过MTT实验检测紫甘薯花色苷对HepG2细胞的生长抑制作用,HE染色观察细胞形态,流式细胞仪测定细胞周期变化.MTT结果表明,不同浓度的紫甘薯花色苷处理HepG2细胞24、48、72,h后,低浓度的紫甘薯花色苷促进肿瘤细胞的生长,高浓度的紫甘薯花色苷抑制肿瘤细胞的生长,800,µg/m L花色苷处理72,h抑制率高达80%.HE染色结果表明,正常HepG2细胞的细胞核和细胞质清晰可见,而加入花色苷后,出现细胞核固缩、染色质浓集于核膜表面、形成新月形致密小斑块、细胞膜形态变得不规则等凋亡的特征.流式细胞仪分析结果表明,花色苷能够促进肿瘤细胞的凋亡,且细胞的凋亡率随花色苷浓度的增加而增大.
紫甘薯花色苷;HepG2细胞;抗肿瘤
Abstract:The anti-tumor activity of purple sweet potato anthocyanin to human liver cancer HepG2 cells was studied. Cell viability,morphology characteristic and cell cycle distribution were analyzed by MTT experiment,HE dyeing and flow cytometry,respectively. The MTT results indicated that after being treated w ith purple sweet potato anthocyanin for 24,48,72,h,the grow th of HepG2 cell was slightly promoted by low concentration of purple sweet potato anthocyanin and obviously inhibited by high concentration of purple sweet potato anthocyanin. The cell grow th inhibitory rate could reach up to 80% when HepG2 cells were treated w ith 800,µg/m L of anthocyanin for 72,h. The HE dyeing results indicated that the normal HepG2 cell nucleus and cytoplasm are clearly discernible,while after being treated w ith anthocyanin,HepG2 cells showed typical morphological changes associated w ith the characters of apoptosis,such as karyopyknosis,the chromatin enrich in the karyotheca surface,form ing the meniscus compact small mottling,the cell membrane shape becomes anomalous. Flow cytometry analysis results indicated that the anthocyanin could induce cell apoptosis,and the apoptotic percentage increased along w ith the anthocyanin concentration.
Keywords:purple sweet potato anthocyanin;HepG2 cells;anti-tumor
花色苷是一类广泛地存在于植物中的水溶性天然色素,是一大类多酚化合物的总称,也是植物的主要呈色物质[1].何会等[2]研究了荔枝皮色素提取液中花色苷的抗氧化能力,分别测定花色苷的总抗氧化能力(TAC),清除羟自由基、DPPH自由基、超氧阴离子自由基的能力,结果表明花色苷具有极佳的抗氧化能力.吴信子等[3]测定了花色苷的氧自由基吸收能力,发现在14种花色苷中,花青素具有最高活性,其活性比传统抗氧化剂维生素E强得多.近年来花色苷抗肿瘤的作用越来越受到人们的关注,有研究表明花色苷对人肿瘤细胞有杀伤作用,对多种癌细胞如乳腺癌细胞、前列腺癌细胞等都具有不同程度的抑制作用[1].然而,花色苷抑制人肝癌细胞HepG2 增殖、诱导凋亡作用的机制尚不清楚,本文以HepG2细胞为模型,初步探讨紫甘薯花色苷对肝癌细胞的抗肿瘤效应,为肝病的预防、治疗及保肝功能食品的开发提供一定的实验依据.
1 材料与方法
1.1 材料
紫甘薯花色苷为本学院实验室提取[4–5],样品Ⅰ色价为40.7,样品Ⅱ色价为85.
细胞株为人肝癌细胞HepG2,南开大学生命科学学院.
主要试剂:胎牛血清,杭州四季青生物工程有限公司;青霉素、链霉素,哈药集团制药总厂;MTT(噻唑蓝),Sigma公司;二甲基亚砜(DMSO),天津市化学试剂一厂.
1.2 细胞培养
将HepG2细胞接种于含10%灭活胎牛血清的DMEM 培养基(Gibico公司)中,置37,℃、饱和湿度CO2,5%的2123TC型水套式CO2培养箱(美国Shellab公司)中恒温培养,2~3,d传代1次,取对数生长期的HepG2细胞进行实验.
1.3 HepG2细胞生长抑制率的测定
采用MTT法进行测定.取对数生长期的HepG2细胞调整浓度为105,m L–1,接种于96孔培养板中,每孔100,μL.培养24,h后倒掉培养基,用PBS洗2次,实验组加入终质量浓度分别为25、50、100、200、400、800,μg/m L的紫甘薯花色苷200,μL,对照组加入等体积的培养基,每组设6个平行孔.培养24、48、72,h后倒掉紫甘薯花色苷溶液,用PBS洗2次,每孔加入质量浓度为0.5,mg/m L的MTT,200,μL.继续培养4,h后倒掉上清液,用PBS洗2次,每孔加入DMSO,150,μL,振荡使紫色结晶物充分溶解.在酶标仪上测定波长570,nm处各孔的吸光度,进行不同色价紫甘薯花色苷的实验及其吸光度的测定.
抑制率=(1-A加药孔/A对照孔)×100%
1.4 细胞形态学观察[6–10]
用HE染色方法观察细胞形态.取对数生长期的HepG2细胞,调整其浓度为105,m L–1,接种于底部铺有盖玻片的6孔培养板中,每孔2,m L.培养12,h待细胞贴壁后吸走培养基,用PBS洗2次,加入紫甘薯花色苷样品Ⅰ使终质量浓度分别为100、200、400、800,μg/m L,同时设置对照组.培养24,h后取出盖玻片,固定前先用PBS清洗细胞2次(1 000 r/m in离心5 m in,弃去上清液),去除妨碍染色的血清.用10%甲醛固定细胞40,m in.蒸馏水洗1次后,滴入苏木精染液作用3,m in.加入0.5%盐酸–70%乙醇溶液作用1,m in,脱去胞质的着色,此时核呈紫红色.加入碱性溶液碱化,使细胞核变成蓝色.用自来水(呈弱碱性)浸泡5,m in.蒸馏水洗作用1,m in,去除残留的碱性溶液,否则影响伊红着色.加入伊红染液作用1,m in.用梯度乙醇溶液脱水:70%、90%、95%的乙醇各脱水45,s,100%乙醇脱水2次,每次2,m in.用二甲苯透明细胞2次,每次5,m in.树胶封固,即将盖玻片用树胶粘于载玻片上,以利保存和观察.
1.5 细胞周期测定[10–11]
分别取终质量浓度为100、200、400、800,μg/m L紫甘薯花色苷样品Ⅰ处理的HepG2细胞各105,m L–1,用PBS洗2次后将细胞重悬于1,m L,PBS中,缓慢滴入预冷的2.3,m L,100%乙醇中,于4,℃冰箱固定18,h.离心去除乙醇,将细胞用PBS洗2次,重悬于1,m L,PBS中.加入20,μL,PI染液、5,μL的RNaseA室温避光作用1 h.加2.5,m L PBS稀释300目滤膜过滤.流式细胞仪(美国Becton Dickinson公司)测定细胞周期,用荧光共聚焦显微镜(日本尼康公司)观察细胞的凋亡情况.
2 结果与讨论
2.1 MTT法的检测结果
终质量浓度为25、50,μg/m L紫甘薯花色苷作用HepG2细胞后,花色苷促进了细胞的生长,25、50,μg/m L样品Ⅰ作用HepG2细胞24、48,、72,h的促进率分别为15%、10%、6%和9%、5%、3%.25、50,μg/m L样品Ⅱ作用HepG2细胞24、48、72,h的促进率分别为12%、8%、3%和6%、4%、1%.
由图1(a)可知:在100、200、400、800,μg/m L紫甘薯花色苷样品Ⅰ作用HepG2细胞24,h后,抑制了细胞生长,抑制率分别为8%、19%、27%和36%;在加药培养48 h后,抑制率达到23%、31%、48%和61%;800,μg/m L紫甘薯花色苷与HepG2细胞共培养72,h,抑制率达到75%.其中24、48、72,h的IC50值分别为2 253±11.9,459±13.75和199±13.5.
MTT法测定细胞的生长抑制率显示,在100~800,μg/m L紫甘薯花色苷样品Ⅰ对HepG2细胞有明显的抑制作用.紫甘薯花色苷样品Ⅰ在25~800,μg/m L具有以下特点:紫甘薯花色苷低浓度促进细胞的生长,高浓度抑制细胞生长,其抑制作用随药物浓度的增大而增大,随着作用时间的延长而增大.
由图1(b)可知:在终质量浓度为100、200、400、800,μg/m L紫甘薯花色苷样品Ⅱ作用HepG2细胞24,h后,抑制率分别为12%、23%、30%和38%;在加药培养48,h后,抑制率达到25%、40%、52%和63%,800,μg/m L 紫甘薯花色苷与HepG2细胞共培养72,h,抑制率达到80%.其中24、48、72,h的IC50值分别为2,039±8.25、399±12.50和151±12.75.
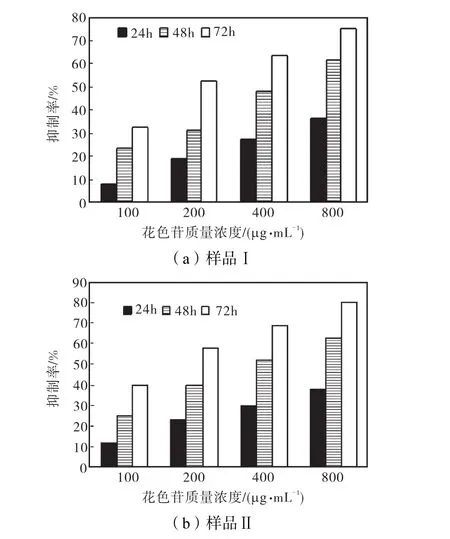
图1 花色苷对HepG2细胞的影响Fig.1 Effect of anthocyanin on HepG2 cells
实验中所用的紫甘薯花色苷样品Ⅱ的色价要高于紫甘薯花色苷样品Ⅰ的色价,结果显示紫甘薯花色苷样品Ⅱ的抑制率明显高于样品Ⅰ的抑制率,可见在本实验中所使用的紫甘薯花色苷浓度范围内,色价不同其抑制率也明显不同,色价越高,抑制率越强.
紫甘薯花色苷是类黄酮化合物,可能通过阻止肿瘤细胞增殖生长、降低金属蛋白酶的活力、激活JNK途径、阻止活性氧和致癌物以及DNA加合物的作用,导致肿瘤细胞凋亡.紫甘薯花色苷浓度越高,抑制效果越明显.而MTT法测定低浓度的紫甘薯花色苷组表现出促进细胞生长的结果,这可能是由紫甘薯花色苷本身颜色与MTT实验中生成的紫色结晶颜色相近造成的吸光度偏高.
2.2 HE染色观察细胞形态变化
HE染色观察到的细胞形态见图2.
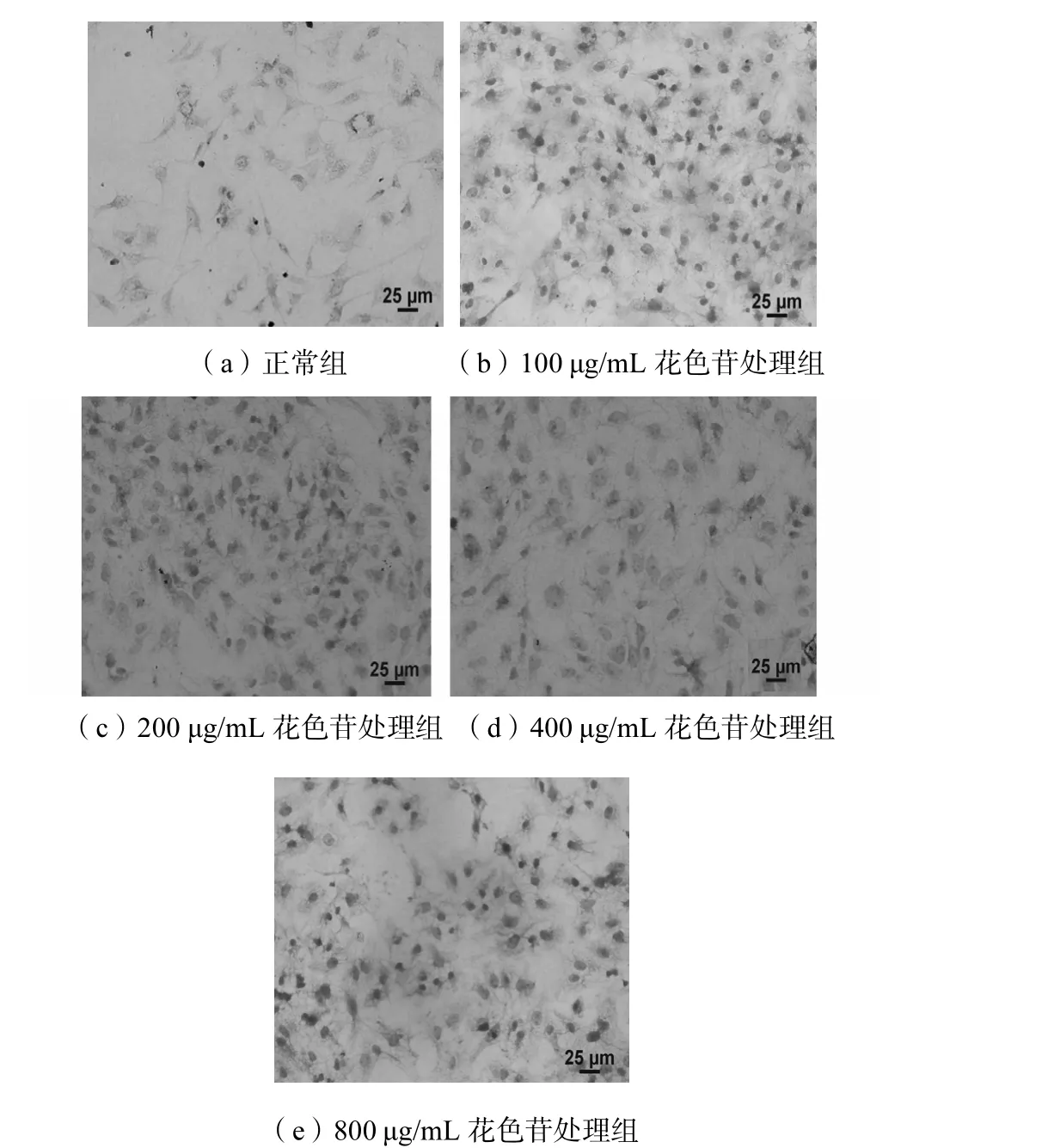
图2 HepG2 细胞形态Fig.2 HepG2 cells morphology
正常细胞形态呈贴壁状态比较良好的菱形,细胞核呈蓝色清晰可见,细胞质呈微红色.加入药物处理后细胞呈现贴壁不太牢固的椭圆形,且形态大小不一.深蓝色的颗粒可能是钙盐颗粒,灰蓝色的为细胞核黏液,鲜红色的颗粒为胞浆内嗜酸性颗粒,而粉红的为蛋白质液体.加药处理后的细胞由于其细胞膜的损坏,由轻度嗜碱呈现嗜伊红浓染,伊红着色由浅变深.200,μg/m L紫甘薯花色苷处理细胞,部分细胞核已消失,染色质浓集于核膜表面,形成新月形致密小斑块,细胞膜形态变得不规则.800,μg/m L紫甘薯花色苷处理的细胞,大部分细胞已经不能维持原来的形态,很多碎裂出现凋亡晚期的特征.
2.3 细胞周期的变化
终质量浓度为100、200、400、800,μg/m L紫甘薯花色苷样品Ⅰ作用于HepG2细胞24,h,实验结果如图3所示.
在实验所取紫甘薯花色苷浓度范围内,随着紫甘薯花色苷浓度的增加,其抑制效果明显增强,呈浓度依赖关系,在紫甘薯花色苷质量浓度分别为100、200、400、800,μg/m L时,细胞凋亡率分别为4.59%、20.87%、27.05%和33.92%.

图3 花色苷样品Ⅰ对HepG 2细胞周期的影响Fig.3 Effect of anthocyanin samp le Ⅰ on HepG2 cell cycle
3 结 论
(1),通过MTT实验结果证明,紫甘薯花色苷能够显著抑制人肝癌HepG2细胞的生长,抑制率与浓度、时间成剂量依赖性.
(2),HE染色观察HepG2细胞的形态学变化,花色苷质量浓度为100、200,µg/m L时,细胞逐渐变圆,细胞核固缩,当花色苷质量浓度为400、800,µg/m L时,细胞膜基本破裂,几乎不能维持细胞形态.
(3),流式细胞仪测定细胞周期,分析得出紫甘薯花色苷对HepG2细胞凋亡率的影响,即细胞凋亡比例随着花色苷浓度增大而增大.
[1] 高爱霞,罗巨东,吴庆婷,等. 花青素对肺癌细胞NCIH460的体内外抗肿瘤效应[J]. 实验动物与比较医学,2008,28(2):85-89.
[2] 何会,宋哲,谢碧秀,等. 荔枝皮花色苷体外抗氧化能力研究[J]. 食品科学,2009,30(11):22-25.
[3] 吴信子,朴京一,张小勇,等. 蓝靛果花青素的分离与鉴定[J]. 延边大学学报:自然科学版,2001,27(3):191–194.
[4] 范辉. 紫甘薯色素纯化及其对糖尿病鼠的抗氧化作用[D]. 天津:天津科技大学,2009.
[5] 韩永斌. 紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D]. 南京:南京农业大学,2007.
[6] 耿明,王琳,曹永成,等. 胃癌细胞药物敏感性MTT法检测结果分析[J]. 实用医药杂志,2009,26(12):26-28.
[7] 刘跃明,李石伟. 雷公藤内脂醇诱导Hep-2细胞凋亡及对细胞增殖周期的影响[J]. 中国老年学杂志,2010,30(2):220-221.
[8] 杜宏,张娜,高霞,等. 莲房原花青素对人肝癌细胞HepG2 生长及凋亡的作用[J]. 实用医学杂志,2008,24(6):891-893.
[9] 吴翰桂. 细胞凋亡的研究进展[J]. 安徽大学学报:自然科学版,2001,25(4):102-106.
[10] Boivin D,Lamy S,Lord-Dufour S,et al. Antiproliferative and antioxidant activities of common vegetables:A comparative study[J]. Food Chem istry, 2009,112(2):374–380.
[11] 谢朝阳,祝其锋,吴斌华,等. 原花青素影响Aβ25-35诱导PC12细胞周期变化与细胞凋亡的可能机制[J]. 广东医学院学报,2009,27(2):119-123.
Effect of Purp le Sweet Potato Anthocyanin on Human Liver Cancer HepG2 Cells
CAO Dong-xu1,2,DONG Hai-ye1,LI Yan1,LÜ Xiao-ling1
(1. College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. Tianjin Food Engineering Center,Tianjin 300457,China)
TS202.3
A
1672-6510(2011)02-0009-04
2010–10–08;
2010–12–28
曹东旭(1973—),女,辽宁开原人,副教授,博士,carol@tust.edu.cn.

