Survivin和Caspas3在侧向发育型大肠肿瘤中的表达
吴晓冬,张 斌,李长锋,杨 蕾,李丹丹,丁 梦
(吉林大学中日联谊医院1.中心研究室;2.内镜中心,吉林长春130033)
大肠癌在我国是高发肿瘤之一,而且大肠肿瘤有一个从“腺瘤-癌顺序学说”,所以有很多学者致力于研究癌基因、抑癌基因及凋亡相关基因等在大肠癌变过程中的改变,并且得出结论:它们在大肠肿瘤的发生、发展中演绎着重要角色。随着放大内镜及其内镜黏膜切除术(EMR)等技术的临床应用,大肠侧向发育型肿瘤(laterally spreading tumor,LST)逐渐受到人们的注意,其主要特性为病变主要沿黏膜面侧向表浅生长,而不是向肠壁深层垂直生长[1]。
由于对LST认识不足,现国内外对其发病机制尚缺乏系统的研究,LST由于其具有沿黏膜水平生长的特点,认为可能与肿瘤细胞的异常增殖及凋亡有关。细胞凋亡受凋亡促进因子和凋亡抑制因子的共同调节。Caspase是细胞凋亡的核心机制,其级联反应的激活决定了凋亡形态的变化。而Survivin是近些年发现的一种肿瘤特异性凋亡抑制因子,故本研究拟探讨良性LST与垂直生长的大肠腺瘤间凋亡相关基因Caspase3和Survivin的表达异同。
1 材料和方法
1.1 研究对象 LST、大肠腺瘤、大肠腺癌及正常组织标本均取自吉林大学中日联谊医院内镜中心和基本外科2002-2006年治疗和诊断的患者,术前均未接受过化疗及放疗,由病理医师进行复查确诊。其中23例良性LST患者:男性13例,女性 10例,年龄27-75岁,平均年龄53.6岁;34例大肠腺瘤患者:男性19例,女性15例,年龄22-74岁,平均年龄49.7岁;21例大肠腺癌患者:男性12例,女性9例,年龄34-78岁,平均年龄58.7岁;11例正常黏膜组织标本取自距肿瘤边缘10cm以上的正常黏膜组织。
1.2 免疫组化染色 SP免疫组化试剂盒及Caspase3、Survivin兔抗人多克隆抗体均购自福州迈新生物工程公司,DAB显色试剂盒购自博士德生物工程公司,按照试剂盒说明进行免疫组化检测。用PBS代替一抗作为阴性对照,用已知阳性标本作为阳性对照。
1.3 结果判断 图象分析仪进行图象分析,每张图片选择5个视野,测定阳性蛋白的吸光度值并判断阳性率。Survivin和Caspase3蛋白均定位于细胞浆内,免疫组织化学染色阳性反应为黄-棕黄色颗粒。双盲法看片,参照Kawasaki等[2]采用的半定量积分方法判断结果。
1.4 统计学分析 所有数据均采用SPSS11.0统计软件进行分析,P<0.05表示差异有显著意义。
2 结果
2.1 Survivin表达 良性LST组(阳性率21.7%,吸光度122.3±13.55)和大肠腺瘤组(阳性率20.6%,吸光度126.8±12.26)表达明显低于大肠腺癌组(阳性率61.9%,吸光度 107.7±10.24)(P<0.05),而良性LST组与腺瘤组间未见显著差异(P>0.05)(见表1)。

表1 正常大肠黏膜和大肠肿瘤组织中Survivin基因蛋白产物的表达
2.2 Caspase3表达 良性LST组(阳性率60.9%,吸光度值106.8±15.77)和腺瘤组(阳性率64.7%,吸光度值108.5±15.63)明显高于腺癌组(阳性率42.9%,吸光度值129.5±8.67)(P<0.05),Caspase3在正常黏膜中广泛表达于胞浆中,而良性LST组与腺瘤组相比没有统计学差别(P>0.05)(见表2)。
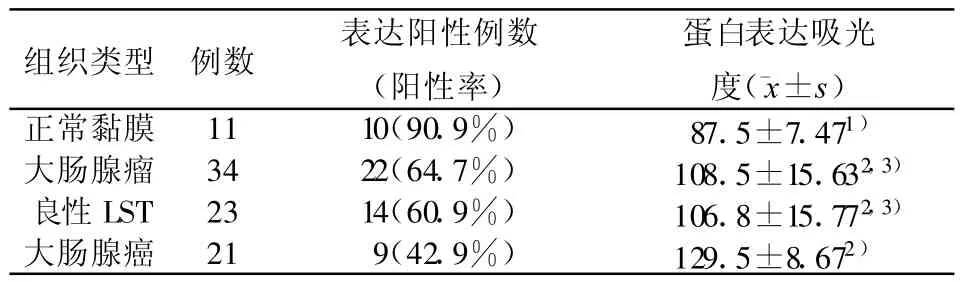
表2 正常大肠黏膜和大肠肿瘤组织中Caspase3基因蛋白产物的表达
3 讨论
Survivin是IAP(inhibitor of apoptosis proteins)家族的新成员,Survivin仅有一个杆状病毒IAP重复区结构(Baculorirus IAP Repeat,BIR),没有羧基末端环指结构,代之的是羧基末端卷曲结构。Survivin基因定位于17q25[3],是功能类似Bcl-2的抑制凋亡基因。有研究表明Survivin调节线粒体释放细胞色素c抑制凋亡,也可直接与 caspase3和 caspase7结合,使caspase的活性降低而抑制凋亡,也有报道Survivin还可以调节G2/M细胞周期,主要以细胞周期依赖的形式过度表达于G2/M期[4]。另外,Survivin有保护细胞、维持微管结构完整性的作用。总之,Survivin是在正常组织中不表达,在胚胎时期高表达,在恶性肿瘤发生时又重新表达的一类因子,可以使肿瘤细胞免于凋亡,加速其多倍体的形成,促进肿瘤生成。
本实验证明了在LST中有Survivin的高表达。且从正常大肠黏膜到腺瘤、LST以及最终癌变的发展过程中Survivin表达逐渐增加,而良性LST与腺瘤在表达上没有显著差异(P>0.05)。与Lin等[5]的研究结果一致,由此也说明其重新表达的时机为肿瘤发生的早期,所以我们考虑Survivin过度表达是大肠癌发生的早期事件之一,即在腺瘤早期Survivin已被激活,表达出大量Survivin蛋白,抑制细胞凋亡,延长肿瘤细胞生存期,无论是水平生长还是垂直生长的大肠肿瘤都有其表达。这使得Survivin成为大肠肿瘤的早期诊断指标之一。
由于Survivin的抗凋亡功能主要是通过在Bcl-2的下游干扰 caspase-9或直接抑制caspase3和caspase7的活性来实现[4],Caspase家族是一种半胱氨酸蛋白酶家族,其家族成员有十余种,它们激活某些酶或破坏细胞骨架等方式导致一系列凋亡相关反应及细胞形态改变。Caspase是以酶原形式存在的,只有被激活才能发挥作用,活化的Caspase再通过裂解相应的一系列底物而引起细胞凋亡。目前认为与Caspase有关的细胞凋亡途径至少有三种:细胞色素c途径、死亡受体途径及内质网途径,其共同途径都是最终激活Caspase3。所以Caspase3是Caspase凋亡途径中的核心成员。Caspase总是与其抑制剂共存,以防止Caspase酶原意外激活而对正常细胞造成损伤。Survivin即被认为是Caspase的抑制剂之一。故我们同时检测了Caspase3的在大肠肿瘤中的表达。Caspase3在正常黏膜高表达,随着大肠肿瘤的发生,腺瘤组及良性LST组Caspase3表达降低,大肠癌组的Caspase3表达明显降低。说明Caspase3的表达受到抑制,从而也抑制了凋亡途径,使肿瘤生长。证明了LST组织细胞凋亡的改变也是由于多种基因协同作用的结果。
以上结果在良性LST与大肠腺瘤间未见Caspase3、Survivin等基因的差异改变,考虑LST与大肠腺瘤同样是癌前病变,LST同样存在多基因改变,同时由于LST在内镜下容易被忽视,故提示内镜工作者在工作中,要提高警惕,以防漏诊。另外,由于内镜技术的发展,特别是内镜黏膜下剥离术(ESD)及内镜黏膜下切除术(EMR)的应用[6],也使其尽早诊断,急早治疗成为可能。
[1]Kudo S,About laterally spreading tumor[J].Early colorectal Cancer,1998,2(5):477.
[2]Kawasaki H,Altieri DC,L u CD,et al.Inhibition of apoptosis by survivin predicts shorter survival rates in colorectal cancer[J].Cancer Res,1998,58(22):5071.
[3]Ambrosini G,Adida C,Altieri DC.A novel anti apoptosis gene,survivin,expressed in cancer and lymphoma[J].Nat Med,1997,3(8):917.
[4]Tamm I,Wabg Y,Saysville E et al.IAP-family protein survivin inhibits caspase activite and apoptosis induced by Fas(CD95),Bax,caspases,and anticancer drugs[J].Cancer Res,1998,58:5315.
[5]Lin Li,Zheng CQ,Jin Y,et al.Expression of survivin protein in human colorectal carcinogenesis[J].World J Gastuoenterol 2003,9:974.
[6]Iizuka H,Okamura S,Onozato Y,et al.Endoscopic submucosal dissection for colorectal tumors[J].Gastroenterol Clin Bilo,2009,33(10-11):1004.

