新型葡萄糖类似物99TcmN-DGDTC的药代动力学和显像研究
金仲慧,吕忠文,张卫方,张燕燕,盛晓燕,任佳蕾,张俊波
(1.北京大学第三医院,北京100191;2.吉林大学中日联谊医院;3.北京师范大学化学系)
核药学的发展带动着临床核医学的前进。尽管2-脱氧-2-[18F]氟-D-葡萄糖 (18F-FDG)已经应用了二十余年,但昂贵的设备费用和药费仍限制了它的普及[1]。锝-99m(99Tcm)标记的葡萄糖类似物具有能量较低和价格便宜的特点[2],并且已经有了成功的报道[3-4]。[99Tcm≡N]2+核近几年来被证明能形成稳定的标记络合物,在我们前期的研究中也充分证实了其标记的葡萄糖类似物二硫代氨基甲酸脱氧葡萄糖具有化学性质稳定和制备容易的特点[5],本实验对其药代动力学性质和对动物模型的显像能力进行了进一步的研究。
1 材料和方法
1.1 细胞系
小鼠肝癌细胞系H22和兔肝癌细胞系VX2由北京肿瘤医院传代。H22细胞系复苏后于含10%胎牛血清(PAA,奥地利)的RPMI 1640培养基(Gibco,美国)于5%CO2浓度37℃下培养72 h,随后接种于小鼠腹腔。待腹水生成后,取腹水收集细胞以107的数量接种于模型小鼠皮下。VX2瘤块解冻后以PBS洗3遍,切成1 mm大小碎块,接种于新西兰大白兔下肢肌肉筋膜下。
1.2 动物
动物实验经北京大学动物伦理委员会批准。雌性Balb/C小鼠15只,体重20-22 g,雌性新西兰大白兔6只,体重2.5-3.0 kg均购于北京大学实验动物中心。10只荷瘤模型小鼠分2组进行药物显像实验。4只兔荷瘤模型行显像实验,2只健康兔行药代动力学实验。实验后动物立即处死,尸体于-20℃冷藏衰变后统一处理。
1.3 99mTcN-DGDTC的合成
根据北京师范大学药盒提供的步骤进行合成,在含0.05 mg氯化亚锡、5.0 mg SDH和5.0 mg DTPA的1 ml生理盐水混合液中加入[99TcmO4]-液(北京森科)377 MBq(10mCi)。混合液置于室温15 min然后加入含5.0 mg DGDTC的1.0 ml水溶液,于室温孵育30 min。TLC检测在聚酰胺板上进行,展开剂为生理盐水和乙腈。
1.4 药代动力学研究方法
99TcmN-DGDTC于耳缘静脉注射入兔体内,开始2 h内每5 min收集血样100 μ l,2-2.5 h每15 min采集一次血样,第2.5-6 h每30 min收集一次血样。总采集时间为6 h,每次收集的血样保存于4℃,最后统一测定放射计数(counts,cts)。
99TcmN-DGDTC的血液样品计数测定在锝分析仪上进行(派特公司,北京)。以药物总计数代表总剂量,不同时间点血样放射性计数代表药物的血液浓度,计数-时间关系使用DAS 2.1.1软件(中国药物数学专业协会)进行分析、探索药代动力学数据。DAS软件的理论基础是Akaike标准的药代动力学模型(Akaike information criterion,AIC)。
在使用血样检测法收集药代动力学数据同时,也采用了动态显像法对计数-时间变化规律进行分析,其中ROI选择了反应血药浓度变化最敏感的部位——心脏。
1.5 肿瘤模型显像实验
小鼠和兔子在SPECT显像实验前均使用 2%戊巴比妥钠静脉麻醉,剂量为兔50 mg/kg,鼠40mg/kg。麻醉成功后经兔耳缘静脉和鼠尾静脉分别注射99TcmN-DGDTC 185 MBq(5 mCi,兔)或 37MBq(1mCi,鼠)。兔肿瘤显像研究分别采集血流相(2s/f,共 1 min),血池相(1 min,共 25 min),和连续静态图像直到注药后2 h。通过对感兴趣区(ROI)的计数(靶点)和对应的躯体对侧组织计数(本底)的对比,分析药物特异性摄取情况、计算靶/本比。为鉴别肿瘤血管丰富所带来的高灌注和高代谢所致的99TcmNDGDTC摄取,设置了99Tcm高锝酸盐对照组,方案为静脉注射99Tcm高锝酸盐(北京森科)185 MBq Ci(5 m)后以同样剂量和序列进行采集,并对二者的靶/本比值进行比较。小鼠肿瘤模型显像采集不同时间点的多f静态图像,未采集血流和血池像。兔子显像使用低能平行孔准直器,ECT平面采集(SKY light,荷兰PHILIPS公司),128×128矩阵,放大倍数1.0。小鼠显像采用带针孔准直器的ECT(Hawkeye,美国GE公司),同样参数为128×128矩阵,放大倍数为3.0。
1.6 数据分析
实验组和对照组肿瘤计数、本底计数、计数-时间曲线、靶/本比-时间曲线均使用eNTEGRA软件进行运算(美国GE公司)。药代模型以Akaike标准进行分析(Akaike information criterion,AIC)。
2 结果
2.1 标记合成
标记复合物的放化纯使用TLC测定法,在生理盐水展开体系中,99TcmO4-和99TcmN-DGDTC位于原点,而游离[99Tcm≡N]int2+涌动至前端。在乙腈展开体系中,99TcmO4-展开到Rf=0.3-0.5,而99TcmNDGDTC和[99Tcm≡N]int2+位于原点。结果表明制备的放化纯大于90%。
2.2 药代动力学
健康兔子静脉注射99TcmN DGDTC后,根据DAS软件计算各时间点血液中放射性计数的性质曲线符合两室模型(图1)。药动学中二室模型的药动学公式为,C=A◦e-α◦t+B ◦e-β◦t其中A 为341 147610,α为0.02,B为60 263 725.6,β为0.002。各项药代动力学参数见(表1),其中药物半衰期事实上是有效半减期,为34.05 min。显像药代动力学研究表明:心、肾、膀胱清晰可见,但肠道未见明显显示,提示药物代谢途径主要在泌尿系。对健康兔子心脏ROI进行的活度-时间曲线分析表明,其形态类似于体外的药代动力学曲线。
2.3 肿瘤模型显像实验
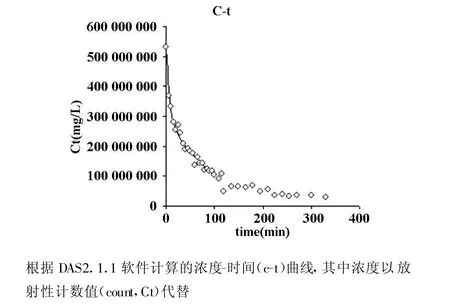
图1 药代动力学曲线
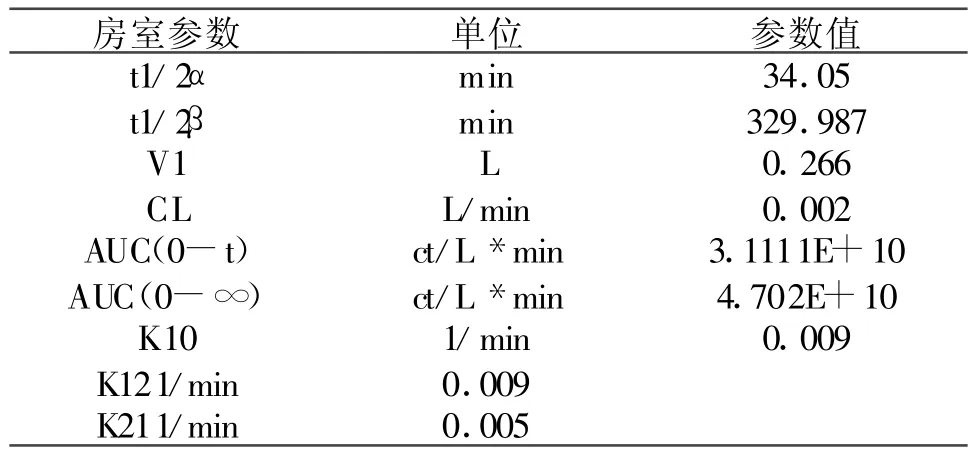
表1 药代动力学参数
接种细胞后2周左右一般均可构建成功肿瘤模型,其中小鼠肿瘤直径平均在10 mm左右。兔肿瘤的直径一般在50mm左右。两种肿瘤模型均能在实验组和对照组中清晰显示。兔耳缘静脉注射后,在髂动脉显影同时肿瘤组织即清晰显示,随时间延迟肿瘤组织摄取逐渐增高,在30 min左右达摄取高峰,之后逐渐下降。瘤区ROI高峰时计数在380 cts/s,1h45分为250 cts/s。对侧肢体选取相同区域相同面积的ROI,其摄取在15 min左右达到高峰,峰值在90 cts/s左右,其后缓慢下降,1 h 45分值为50 cts/s左右。靶/本比在检测的2 h内平均大于2(图2)。虽然鼠肿瘤模型的瘤块体积绝对值较小,但显像效果同样很明显。

图2 兔肿瘤模型显像结果
3 讨论
本组实验证明,该冻干试剂盒所采用的配体交换法合成标记99TcmN-DGDTC具有较高的产量和放化纯,制备过程也比较容易。同时,药物的体内稳定性也在显像时被间接证实:注射后2 h内,小鼠的甲状腺组织未见明显显示,证明锝的结合是稳定的。药代动力学研究显示,99TcmN-DGDTC在体内的代谢途径符合二室模型,主要在血液中分布,组织中蓄积少。药物在肿瘤组织中的吸收高峰在30 min,而药物半衰期为34 min,药物浓度达到诊断目的后能迅速排除体外。药物的代谢途径,经显像结果证实是经肾排泄。
在肿瘤模型的显像研究中,本组实验设计了99Tcm高锝酸盐对照组,是因为在血流丰富的组织,如肝脾和肿瘤,高锝酸盐可以因血液本底而显示组织轮廓。本组的结果表明了移植的肿瘤能被高锝酸盐所显示,但远远低于99TcmN-DGDTC显像时的浓集程度,提示了99TcmN-DGDTC浓集于肿瘤中不单纯是高血供的结果,也是癌细胞高代谢所致药物摄取增加的结果。在鼠肿瘤模型中,瘤块相对体积较小,但也能清晰显示。文献证实葡萄糖类似物18F-FDG的代谢途径至少包含2种:糖酵解和磷酸化[6-7]。但99TcmN-DGDTC的细胞内代谢途径并不明确,需要进一步研究。已有的文献表明[6-11],多数99Tcm标记的葡萄糖类似物与18F-FDG有着不同的转运途径和动力学,反映了显像剂不同的性质。
显像结果符合我们对99TcmN-DGDTC作为代谢显像剂的预期[5],与前期生物分布实验的结果相符合。本组实验证明了99TcmN-DGDTC作为肿瘤代谢显像剂在哺乳动物鼠和兔肿瘤模型显像的可行性,提示其未来有作为人类肿瘤代谢显像剂的探索价值。
虽然我们的结果支持99TcmN-DGDTC作为代谢显像剂的潜力,DGDTC也很容易被99TcmN核标记,标记率、放化纯、稳定性、效价比也都较理想,但是PET往往能提供更高的分辨率和敏感度。如果将来SPECT在分辨率和灵敏度上能获得更大进步,99Tcm标记的葡萄糖类似物必将大有前景。
致谢:对核医学科所有同志表示衷心的感谢,感谢他们对核医学科研和临床所做出的无私奉献。
[1]Brock CS,SR Meikle,P Price.Does fluorine-18 fluorodeoxyglucose metabolic imaging of tumours benefit oncology[J]?Eur J Nucl Med,1997,24(6):691.
[2]Yang DJ,CG Kim,NR Schechter,et al.Imaging with 99mTc ECDG targeted at the multifunctional glucose transport system:feasibility study with rodents[J].Radiology,2003,226(2):465.
[3]Kao CH,SP ChangLai,PU Chieng,et al.Technetium-99m methoxyisobutylisonitrile chest imaging of small cell lung carcinoma:relation to patient prognosis and chemotherapy response-a preliminary report[J].Cancer,1998,83(1):64.
[4]Van Nerom CG,GM Bormans,MJ De Roo,et al.First experience in healthy volunteers with technetium-99mL,L-ethylenedicysteine,a new renal imaging agent[J].Eur J Nucl Med,1993,20(9):738.
[5]Zhang J,J Ren,X Lin,et al.Synthesis and biological evaluation of a novel(99m)Tc nitrido radiopharmaceutical with deoxyglucose dithiocarbamate,showing tumor uptake[J].Bioorg Med Chem Lett,2009,19(10):2752.
[6]Marshall S,V Bacote,RR Traxinger.Discovery of a metabolic pathway mediating glucose-induced desensitization of the glucose transport system.Role of hexosamine biosynthesis in the induction of insulin resistance[J].J Biol Chem,1991,266(8):4706.
[7]Wells,L,K Vosseller,GW Hart.Glycosylation of nucleocytoplasmic proteins:signal transduction and O-GlcNAc[J].Science,2001,291(5512):2376.
[8]Ilgan,S,DJ Yang,T Higuchi,et al.99mTc-ethylenedicysteine-folate:a new tumor imaging agent.Synthesis,labeling and evaluation in animals[J].Cancer Biother Radiopharm,1998,13(6):427.
[9]Kereiakes,JG,Biophysical aspects:medical use of technetium-99m.Topical review series.Woodbury,NY:American Institute of Physics,1992,240.
[10]Petrig J,R Schibli,C Dumas,et al.Derivatization of glucose and 2-deoxyglucose for transition metal complexation:substitution reactions with organometallic 99mTc and Re precursors and fundamental NMR investigations[J].Chemistry,2001,7(9):1868.
[11]Bormans,GM,BJ Cleynhen,MJ De Roo,et al.Evaluation of the renal excretion characteristics oftechnetium-99m mercaptoacetylglycyl-D-alanylglycine in healthy volunteers[J].Eur J Nucl Med,1992,19(4):271.

