降解木素白腐菌产漆酶的研究进展
傅 恺 付时雨 詹怀宇
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
降解木素白腐菌产漆酶的研究进展
傅 恺 付时雨 詹怀宇
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
综述了近年来国内外对于白腐菌产漆酶的研究进展,对液体和固体发酵提高漆酶产量的技术和方法进行了讨论和评述,并对今后的研究工作提出了展望。
白腐菌;漆酶;液体发酵;固体发酵;有机废料;发酵罐
随着环境保护要求的日益严格,制浆造纸清洁生产成为研究热点。在纸浆的漂白过程中引入生物酶,不仅可以减少化学药品用量,还能降低废水的污染负荷,如COD、BOD和AOX等。因此,纸浆生物漂白越来越受到国内外造纸界的关注和重视,其中纸浆的半纤维素酶辅助漂白已实现工业化应用,但是半纤维素酶不能直接降解纸浆中的残余木素,难以从根本上解决残余木素的脱除问题[1]。于是开发了新型木素降解酶,利用其直接作用和降解纸浆中的残余木素成为生物漂白领域的迫切需求。
白腐菌分泌的木素降解酶系主要包括木素过氧化物酶、锰过氧化物酶和漆酶,其中漆酶在纸浆漂白工业中最具应用前景。近几年,随着研究的不断深入,白腐菌漆酶对木素和与木素结构相似的许多环境污染物的降解作用也越来越受到科研工作者的关注,特别是在纸浆生物漂白[2]、工业废水处理[3]、有机染料脱色[4]和高分子催化合成[5]等方面,表现出了很大的研究价值和应用潜力。
但是白腐菌漆酶在上述领域中的成功应用,目前需要解决的一个关键性问题是如何在控制成本的前提下提高漆酶的产量。优化发酵条件以提高白腐菌产酶能力并降低生产和应用成本是一种最基本也是最常用的研究思路。Borras等[6]学者研究了白腐菌Trametes versicolor在麦芽汁半合成培养基中,对酸性染料兰纳洒脱灰脱色过程中的成本控制问题,发现培养基原料的费用占脱色总成本的比例高达95%,而通过优化培养条件,选用低价的无麦芽汁合成培养基,能够将脱色成本降低96%,并且脱色效果不变。白腐菌漆酶高效生产的另一种思路是寻找合适的载体进行漆酶基因的异源表达[7],但是由于白腐菌漆酶中糖基的存在能够促使漆酶蛋白的水解,因此相对于其他一些已实现工业化生产的氧化还原酶来说——如通过丝状真菌的基因重组生产葡萄糖氧化酶——白腐菌漆酶在活性宿主上的异源高效表达还较为困难[8],总体上还处于探索阶段,难以满足漆酶工业化生产和应用的要求。因此目前关于漆酶生产的研究主要还是集中于优化白腐菌的发酵条件上。本文重点介绍了近年来国内外对于白腐菌产漆酶的研究进展,对提高漆酶产量的技术和方法进行了讨论和评述。
1 白腐菌产漆酶的培养方法
微生物产酶的发酵过程与菌体周围的环境因素关系密切,不同的发酵方法对白腐菌分泌漆酶有很大影响,见表1[3-4,9-36],按照培养方式的不同可将其分为液体培养和固体培养两大类。
1.1 液体培养
液体培养是指菌丝体在含有一定营养成分的液体培养基中生长和产酶的过程,由于这种方式便于工业化生产和应用,因此,目前对于液体培养白腐菌产漆酶的研究报道较多。其中大部分研究都表明,在液体培养基中添加适量的诱导剂或Cu2+,对白腐菌分泌漆酶具有较为显著的促进作用。
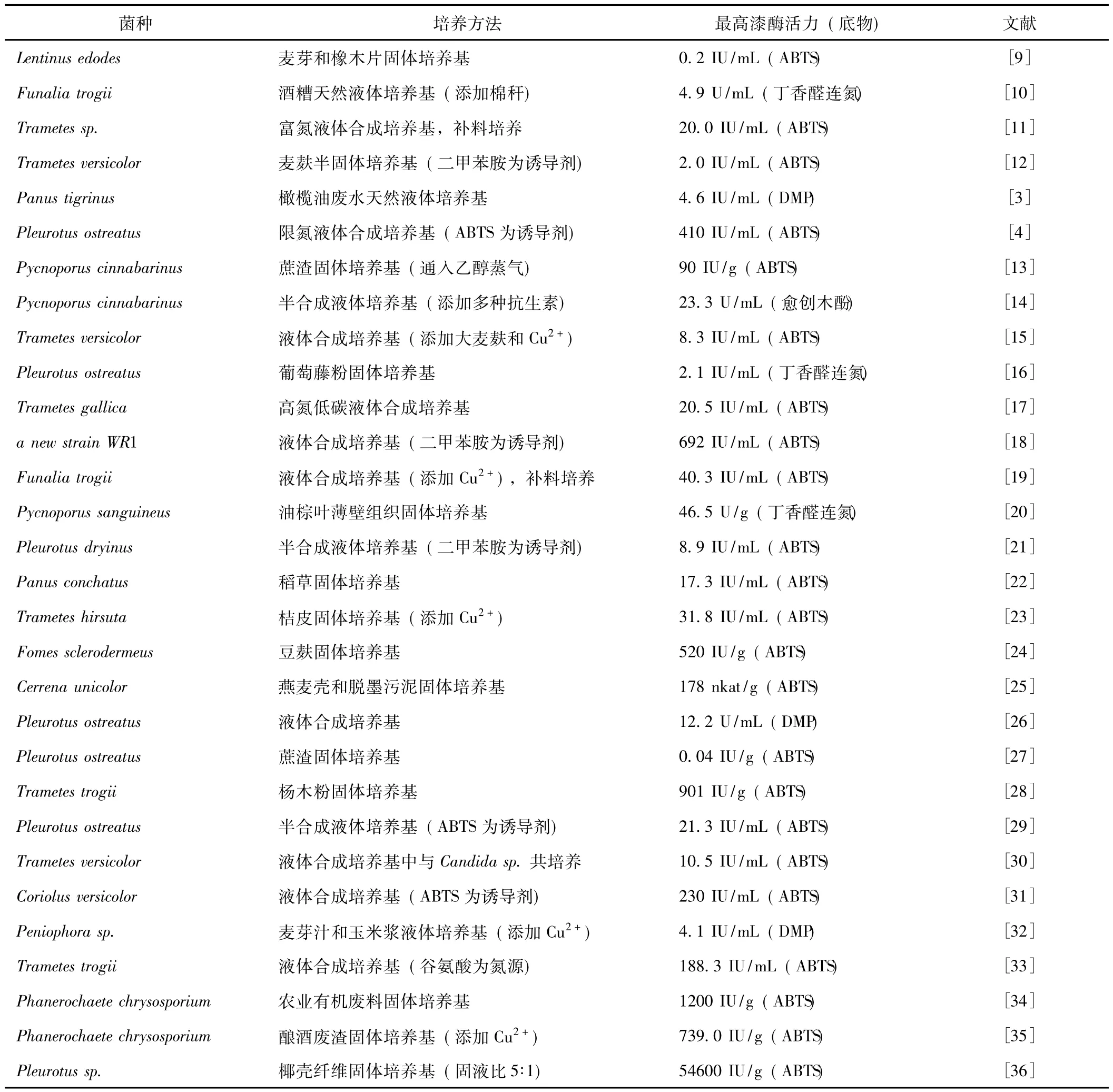
表1 不同菌种、培养方法和测定底物对漆酶活力的影响
诱导剂的作用机理是它能够与某些阻遏酶蛋白合成的物质结合,使其发生变构效应,降低这些物质对酶蛋白合成的阻遏作用,启动结构基因转录、翻译以生成相应的酶蛋白[37]。白腐菌漆酶的诱导剂大多为一些与木素结构类似的低分子芳香化合物或木素降解后的碎片化合物,通常也是漆酶的作用底物,如黎芦醇、愈创木酚、2,2-连氮-二 (3-乙基苯并噻唑-6-磺酸)(ABTS)、二甲苯胺、阿魏酸、丁香醛、单宁酸、香草酸、香豆酸等。它们在结构上的共同特征是芳环上通常连有—OH或—NH2基团。吴香波等[31]报道白腐菌Coriolus versicolor在液体培养时,添加0.5~1 mmol/L ABTS可将漆酶产量提高5倍,漆酶活力高达230 IU/mL。Madhavi等学者[18]的研究也发现,多种芳香族诱导剂对一株野生型白腐菌WR-1分泌漆酶都具有促进作用,其中0.8 mmol/L二甲苯胺的诱导效果最为明显,发酵液中漆酶最高活力可达692 IU/mL。一般来讲,不同的诱导剂对同一株白腐菌产酶的影响往往不同,而不同的菌株通常具有不同的最适宜诱导剂。
此外,金属元素,如铜、锰、铁、锌等,往往或是酶蛋白活性基团的组成部分,或是酶的激活剂,对酶活力的影响也不容忽视。许多研究都证实[15,19,23,32,35],在培养基中添加一定量的 Cu2+离子,对多种白腐菌分泌漆酶都具有显著的促进作用。Kurtz等[38]对此提出的解释为:白腐菌漆酶是一种含铜的多酚氧化酶,每个酶蛋白分子中一般都含有4个Cu2+,可能是由于相关基因转录合成漆酶时需要元素铜,因此在限铜或缺铜的培养条件下,漆酶的合成会受影响。
1.2 固体培养
固体培养就是利用固体培养基,在没有或者含有少量液体的环境中,使菌丝体贴附在固体培养基质表面上生长和产酶的过程。随着研究的不断发展和深入,真菌固体培养产酶越来越受到国内外学者们的关注,研究和实践表明,白腐菌固体发酵也能够得到较高的漆酶产量,相比于液体发酵方式,固体培养的氧气循环流通较好,有利于白腐菌等好氧真菌的生长代谢,而且由于是静态处理过程,因此可以省去机械动力所消耗的能量,后续处理过程也较为简便,并且这种培养方式与大部分真菌在野生状态时的生长环境更为接近,因此特别适合于丝状真菌的发酵产酶[39]。
1.3 白腐菌产漆酶研究的新趋势
最近几年,对于白腐菌产漆酶的研究,无论是液体培养还是固体培养都出现了一个新的特点,就是大量利用天然物质,特别是利用工农业生产中产生的木质纤维素有机副产品和废弃物,作为白腐菌生长和产酶的培养底物。这些有机物主要包括麦麸、蔗渣、稻草、麦草、木屑、秸皮、酒糟、豆粕、玉米芯、脱墨污泥、葡萄藤和橄榄油厂废水等,它们通常都富含糖类物质,能够为菌体的生长代谢提供养料,并且还含有一定量的木素、纤维素和半纤维素 (表2)[16,39-40],可作为刺激白腐菌分泌漆酶的诱导物。有报道指出[41],小麦麸中还含有一种天然漆酶诱导物质——阿魏酸 (约0.4% ~1.0%),对白腐菌分泌漆酶具有较强的诱导作用[4,18]。虽然到目前为止还未见有报道证实其他天然底物是否也含有某些特殊诱导物质,但是将这些天然有机物作为白腐菌发酵底物的可行性已经得到了广泛的认同。
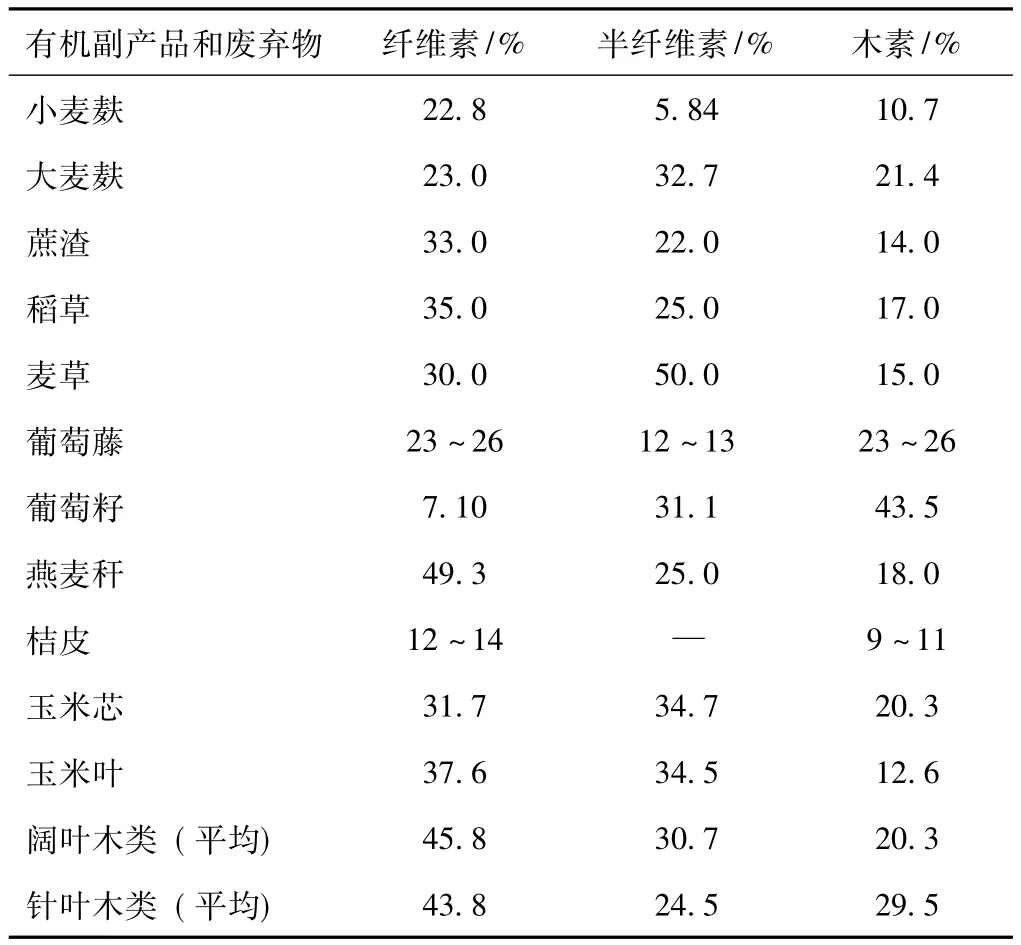
表2 几种用于白腐菌漆酶发酵的有机副产物的木质纤维素含量
例如Membrillo等[27]采用不同颗粒尺寸的蔗渣作为培养底物,进行白腐菌Pleurotus ostreatus漆酶的固体发酵,发现蔗渣颗粒大小和外加氮源对漆酶产量有很大影响,最佳发酵条件为蔗渣湿度80%,颗粒直径1.68 mm,纤维长径比 8.7 ±1.1,外加氮源硫酸铵,碳氮比20,每克绝干底物发酵漆酶活力最高可达0.04 IU。Stajic等[16]利用桔皮和葡萄藤粉作为碳源,对多株白腐菌进行液体和固体培养,结果表明,在液体培养基中添加4%桔皮和20 mmol/L硫酸铵最适宜白腐菌Pleurotus eryngii分泌漆酶,培养基中酶活最高可达246.4 IU/L;而白腐菌Pleurotus ostreatus漆酶产量最高为445 IU/L,其最佳培养方式为固体培养,培养基含4 g葡萄藤粉,12 mL液体合成培养基(氮源为 30 mmol/L 硫酸铵)。Winquist等[25]将燕麦壳、纤维残渣和脱墨污泥等3种工农业废弃物作为白腐菌的固体发酵底物,发现培养基的成分对白腐菌产酶影响较大,在燕麦壳中加入20%的脱墨污泥能显著提高白腐菌Cerrena unicolor的漆酶分泌能力,最高酶活达到178nkat/g(绝干质量)。
这些副产品和废弃物来源十分广泛,而且产量巨大,但是由于长期以来缺乏规模化地深加工和利用,大量宝贵的资源被作为初级产物而浪费,经济附加值很低。而利用这些有机物作为白腐菌发酵漆酶的培养底物,不仅可以促进白腐菌生长,提高漆酶的产量,而且能够充分利用低价值的工农业副产品和废弃物,降低生产成本,减少对环境的污染负荷。
2 白腐菌漆酶的发酵方式
提高白腐菌漆酶的产量,并降低生产成本,使其在工农业生产中得到广泛应用,还要依赖于成熟的工业化发酵技术。在实验室研究时,摇瓶发酵虽然最为常用,但是由于其发酵规模相对较小并且缺乏对工程控制的选择 (如pH值、通气量、外加营养物质等),具有一定的局限性,因此采用有适当控制和检测仪器的小型发酵罐 (约1~10 L) 是较为合适的选择[42]。但是在工业化生产中,缺乏高效的大规模发酵罐系统仍然是目前制约白腐菌漆酶生产和应用的一个关键性因素,为了解决这一问题,近年来国内外的科研工作者们设计了多种用于发酵罐生产漆酶的工艺和策略。按照培养方式的不同也可将它们概括为液体发酵和固体发酵两大类。
2.1 液体深层发酵
发酵罐规模的微生物液体培养通常称为深层发酵(Submerged fermentation,SmF)。机械搅拌式发酵罐(Stirred tank reactor,STR)是目前最常用的深层发酵设备,是已经形成标准化的通用设备,适合于大多数微生物的培养发酵过程。它结构简单,不需要特殊设备,利用机械搅拌器的作用,使菌体、发酵液、空气和热量等充分混合,促进物料的均匀分布和氧气的溶解,以保证供给微生物生长繁殖和代谢所需的营养、温度和溶解氧等。但是这种发酵罐用于白腐菌的培养发酵时,还存在一些不利因素,主要表现在罐体中白腐菌菌体的生长不易控制,菌丝的无序扩张会提高发酵液的黏稠度,并且缠绕在搅拌叶轮上,堵塞管路,严重影响物料、热量和氧气的均匀传递。虽然可以通过提高搅拌转速改善上述问题,但是过高的转速会导致菌丝受到的剪切力增大,抑制细胞繁殖代谢和漆酶的分泌,甚至导致细胞破裂[7]。
针对传统发酵工艺培养白腐菌的缺陷,很多研究者利用白腐菌的菌丝体具有向物体表面黏附的自然属性,采用细胞固定化技术来控制白腐菌的自由生长,其最大的优势是能够使菌丝在发酵液中均匀分布,有利于简化补料和后续进程的操作,以实现连续培养发酵。细胞固定化技术还能够降低发酵液的黏稠度,改善氧气的供给和物料的传递,保护菌丝细胞免受剪切力的作用,提高细胞对pH值、温度、有毒物质等外界环境的抗干扰能力[7],从而加快细胞的繁殖代谢,促进漆酶的分泌。常用的细胞固定载体主要有海藻酸钠、壳聚糖、几丁质、纤维素衍生物等天然聚合物和聚氨酯泡沫、尼龙海绵、不锈钢海绵等惰性物质。Prasad等[44]报道采用聚氨酯泡沫固定化培养白腐菌Pleurotus ostreatus,能显著提高漆酶产量,并将发酵体系扩大到280 mL填充床反应器 (Packed-bed bioreactor) 中,漆酶产量可达 1.4 IU/mL。Couto等[44]研究了多种载体在固定床反应器 (Fixed-bed bioreactor)分批发酵时对白腐菌漆酶产量的影响,结果表明,不锈钢海绵最适合白腐菌Trametes hirsuta产漆酶,最高活力可达2.2 IU/mL。而 Shin等[45]指出,采用海藻酸钠、壳聚糖等材料固定化培养白腐菌成本较高,不利于漆酶的大规模生产,因此他们选用麦麸、黄麻、大麻和枫木片等多种低价天然材料作为固定化载体,其中黄麻是最适合于白腐菌Trametes versicolor固定化发酵漆酶的天然载体。
此外,发酵罐规模的分批补料策略也是一种提高白腐菌漆酶产量的有效手段。补料培养是指根据菌株生长和初始培养基的性质,在培养发酵的某些阶段适当补加培养基或营养物质,使菌体生长和代谢产物合成的时间相对延长。这种方法用于白腐菌产酶的优势主要体现在能够通过调节底物浓度来控制菌体的生长速度,降低代谢产物对菌体生长代谢的抑制作用,特别是避免某些使漆酶失活的蛋白水解酶的合成[7,37]。Galhaup等[46]的研究表明,在20 L机械搅拌式发酵罐中采用多次补料策略,机械搅拌只需要一个较低的转速 (100 r/min),白腐菌 Trametes pubescens的漆酶产量就可提高约2倍,达到相对较高的水平(740 IU/mL)。
2.2 固态发酵
白腐菌固态发酵 (Solid-state fermentation,SSF)的规模扩大化也越来越受到研究者的关注,Coute等[23,47]的课题组比较了3种采用不同传质机理的发酵罐,分别是机械作用的浸入式反应器、气动式的膨胀床反应器和静置的盘式反应器,发现发酵罐传质系统的不同对白腐菌漆酶产量影响较大,当采用大麦麸为非惰性底物时,盘式反应器更适合于白腐菌Trametes versicolor漆酶的生产,最高漆酶活力达到3.5 IU/mL,是其他两种发酵罐中最高酶活的6倍。之后他们又采用桔皮作为固态发酵底物,结果表明,盘式反应器同样适用于白腐菌Trametes hirsuta漆酶的生产,其最高酶活可达12 IU/mL。盘式反应器之所以优于其他两种固态发酵罐,这些学者认为主要是由于浸入式和膨胀床反应器的传质动作会对菌丝体产生一定的剪切力,影响了菌体的生长和代谢产酶,由此提出对于固态发酵罐,传质系统的设计是影响产酶效率的关键因素。
目前国内外对于高效的固态发酵罐规模的白腐菌产漆酶报道仍比较少,这主要是由于固态发酵罐还面临着一些难以克服的问题,除了传质系统的设计外,发酵过程中pH值、温度、通气和氧气传递、湿度、搅动等参数不易控制也是相当重要的原因。因此,当前的研究主要集中于改良已有固态发酵罐系统或设计开发新型发酵设备和工艺,例如Boehmer等[48]研究者采用新型 RITA(Recipient Immersion Temporaire Automatique)间歇浸入式系统,将在固体底物上生长的菌丝体间歇浸入含染料的液体培养基中,以提高白腐菌发酵产酶的效率并同时对染料进行脱色,其优势是既避免了对菌体的机械剪切作用,又能够克服代谢产物及有机染料对菌体生长和产酶的抑制作用。
3 总结与展望
综上所述,白腐菌漆酶的液体和固体发酵分别具有各自的特点,目前关于哪种方法更具优势尚无明确定论,因此它们仍然会是今后一段时间内漆酶生产研究的两个主要方向。同时,采用工农业生产中的木质纤维素有机副产品和废弃物,作为白腐菌菌体生长和分泌漆酶的培养底物,也已经得到了广大研究者们的认同,成为漆酶研究领域的一个新趋势。
但是,目前白腐菌产漆酶的研究总体上还处于由实验室研究向工业化生产的过渡阶段,生产成本较高和缺乏高效的大规模发酵系统仍然是限制漆酶工业化生产和应用的关键因素,因此,今后的科研工作除了继续设计、改良和优化各种类型的发酵体系,深入系统地研究其发酵参数的控制及动力学模型,以使之更加完善高效外,还应该通过应用各种最新的生物科学技术,特别是基因克隆和重组技术来开拓白腐菌漆酶研究的新方法和新思路,从根本上提高白腐菌生长和产酶能力。
[1] 林 鹿,詹怀宇.制浆漂白生物技术[M].北京:中国轻工业出版社,2001.
[2] 闵江马,付时雨,刘梦茹,等.硫酸盐竹浆LMS生物漂白的研究[J].中国造纸,2005,24(10):74.
[3] Fenice M,Sermanni G G,Federici F,et al.Submerged and solidstate production of laccase and Mn-peroxidase by Panus tigrinus on olive mill wastewater-based media[J].Journal of Biotechnology,2003,100:77.
[4] Hongman Hou,Jiti Zhou,Jing Wang,et al.Enhancement of laccase production by Pleurotus ostreatus and its use for the decolorization of anthraquinone dye[J].Process Biochemistry,2004,39:1415.
[5] 周攀登,付时雨.漆酶催化对苯基苯酚的聚合[J].高分子学报,2004,8(4):614.
[6] Borras E,Blanquez P,Sarra M,et al.Trametes versicolor pellets production:low-cost medium and scale-up[J].Biochemical Engineering Journal,2008,42:61.
[7] Couto S R,Jose L T.Laccase production at reactor scale by filamentous fungi[J].Biotechnology Advances,2007,25:558.
[8] Jonsson L J,Saloheimo M,Penttila M.Laccase from the white-rot fungus Trametes versicolor:cDNA cloning of lcc1 and expression in Pichia pastoris[J].Curr Genet,1997,32:425.
[9] Hatvani N,Mecs I.Production of laccase and manganese peroxidase by Lentinus edodes on malt-containing by-production of the brewing process[J].Process Biochemistry,2001,37:491.
[10] Kahraman S S,Gurdal I H.Effect of synthetic and natural culture media on laccase production by white rot fungi[J].Bioresource Technology,2002,82:215.
[11] Moon Yup Jang,Won Ryul Ryu,Moo Hwan Cho.Laccase production from repeated batch cultures using free mycelia of Trametes sp.[J].Enzyme and Microbial Technology,2002,30:741.
[12] Couto S R,Gundin M,Lorenzo M,et al.Screening of supports and inducers for laccase production by Trametes versicolor in semi-solidstate conditions[J].Process Biochemistry,2002,38:249.
[13] Dhawan S,Lal R,Hanspal M,et al.Effect of antibiotics on growth and laccase production from Cyathus bulleri and Pycnoporus cinnabarinus[J].Bioresource Technology,2005,96:1415.
[14] Meza J C,Lonascolo A,Casalot L,et al.Laccase production by Pycnoporus cinnabarinus grown on sugar-cane bagasse:Influence of ethanol vapours as inducer[J]. Process Biochemistry, 2005,40:3365.
[15] Lorenzo M,Moldes D,Sanroman MA.Effect of heavy metals on the production of several laccase isoenzymes by Trametes versicolor and on their ability to decolourise dyes[J].Chemosphere,2006,63:912.
[16] Stajic M,Persky L,Friesem D,et al.Effect of different carbon and nitrogen sources on laccase and peroxidases production by selected Pleurotus species[J].Enzyme and Microbial Technology,2006,38:65.
[17] 黄乾明,谢 君,张寒飞,等.漆酶高产菌株的诱变选育及其产酶条件[J].菌物学报,2006,25(2):263.
[18] Madhavi S Revankar,Lele S S.Enhanced production of laccase using a new isolate of white rot fungus WR-1[J].Process Biochemistry,2006,41:581.
[19] Emre Birhanli,Ozfer Yesilada.Increased production of laccase by pellets of Funalia trogii ATCC 200800 and Trametes versicolor ATCC 200801 in repeated-batch mode[J].Enzyme and Microbial Technology,2006,39:1286.
[20] Vikineswary S,Abdullah N,Renuvathani M,et al.Productivity of laccase in solid substrate fermentation of selected agro-residues by Pycnoporus sanguineus[J]. Bioresource Technology, 2006,97:171.
[21] Elisashvili V,Penninckx M,Kachlishvili E,et al.Use of Pleurotus dryinus for lignocellulolytic enzymes production in submerged fermentation of mandarin peels and tree leaves[J].Enzyme and Microbial Technology,2006,38:998.
[22] 莫佳琳,付时雨,詹怀宇.贝壳状革耳菌诱变提高产漆酶能力及其生物漂白的研究[J].中国造纸学报,2007,21(4):29.
[23] Rosales E,Couto S R,Sanroman MA.Increased laccase production by Trametes hirsuta grown on ground orange peelings[J].Enzyme and Microbial Technology,2007,40:1286.
[24] Papinutti V L,Forchiassin F.Lignocellulolytic enzymes from Fomes sclerodermeus growing in solid-state fermentation[J].Journal of Food Engineering,2007,81:54.
[25] Winquist E,Moilanen U,Mettala A,et al.Production of lignin modifying enzymes on industrial waste material by solid-state cultivation of fungi[J].Biochemical Engineering Journal,2008,42:128.
[26] Beristain S T,Sanchez C,Loera O,et al.Laccases of Pleurotus ostreatus observed at different phases of its growth in submerged fermentation production of a novel laccase isoform[J].Mycological Research,2008,112:1080.
[27] Membrillo I,Sanchez C,Meneses M,et al.Effect of substrate particle size and additional nitrogen source on production of lignocellulolytic enzymes by Pleurotus ostreatus strains[J].Bioresource Technology,2008,99:7842.
[28] Levin L,Herrmann C,Papinutti V L.Optimization of lignocellulolytic enzyme production by the white-rot fungus Trametes trogii in solid-state fermentation using response surface methodology[J].Biochemical Engineering Journa,2008,39:207.
[29] 方 华,黄 俊,丁莉芸,等.白腐菌分泌漆酶的培养条件研究[J].化学与生物工程,2008,25(8):30.
[30] Wang Hailei,Yu Guangli,Li Ping,et al.Overproduction of Trametes versicolor laccase by making glucose starvation using yeast[J].Enzyme and Microbial Technology,2009,45:146.
[31] 吴香波,谢益民,冯晓静.白腐菌Coriolus versicolor的培养及产漆酶条件的研究[J].纤维素科学与技术,2009,17(2):12.
[32] Fonseca MI,Shimizu E,Zapata P D,et al.Copper inducing effect on laccase production of white rot fungi native from Misiones(Argentina)[J].Enzyme and Microbial Technology,2010,46(6):534.
[33] Levin L,Melignani E,Ramos A M.Effect of nitrogen sources and vitamins on ligninolytic enzyme production by some white-rot fungi.Dye decolorization by selected culture filtrates[J].Bioresource Technology,2010,101:4554.
[34] Zeng Guangming,Yu Man,Chen Yaoning,et al.Effects of inoculation with Phanerochaete chrysosporium at various time points on enzyme activities during agricultural waste composting[J].Bioresource Technology,2010,101:222.
[35] Gassara F,Brar S K,Tyagi R D,et al.Screening of agro-industrial wastes to produce ligninolytic enzymes by Phanerochaete chrysosporium[J].Biochemical Engineering Journal,2010,49:388.
[36] Bhattacharya S S,Garlapati V K,Banerjee R.Optimization of laccase production using response surface methodology coupled with differential evolution[J].New Biotechnology,2010.
[37] 岑沛霖,蔡 谨.工业微生物学[M].北京:化学工业出版社,2000.
[38] Kurtz MB,Champe S P.Purification and characterization of the conidial laccase of Aspergillus nidulans[J].J Bacteriol,1982,15:1138.
[39] Couto S R,Sanroman MA.Application of solid-state fermentation to ligninolytic enzyme production[J].Biochemical Engineering Journal,2005,22:211.
[40] 燕 红,杨 谦.地衣芽孢杆菌对麦麸降解作用的研究[J].林产化学与工业,2007,27(4),97.
[41] 周利茗,张志清.麦麸中阿魏酸检测方法及其提取工艺研究进展[J].粮油加工,2009,11:110.
[42] 埃 拉.工业酶:制备与应用[M].第二版.北京:化学工业出版社,2005.
[43] Prasad K K,Mohan S V,Bhaskar Y V,et al.Laccase production using Pleurotus ostreatus 1804 immobilized on PUF cubes in batch and packed bed reactors:influence of culture conditions[J].J Microbiol,2005,43:301.
[44] Couto S R,Sanroman MA,Hofer D.Stainless steel sponge:a novel carrier for the immobilization of the white-rot fungus Trametes hirsuta for decolourisation of textile dyes[J].Bioresour Technol,2004,95:67.
[45] Shin M,Nguyen T,Ramsay J.Evaluation of support materials for the surface immobilization and decoloration of amaranth by Trametes versicolor[J].Appl Microbiol Biotechnol,2002,60:218.
[46] Galhaup C,Wagner H,Hinterstoisser B,et al.Increased production of laccase by the wood-degrading basidiomycete Trametes pubescens[J].Enzyme Microb Technol,2002,30:529.
[47] Couto S R,Moldes D,Liebanas A,et al.Investigation of several bioreactor configuration for laccase production by Trametes versicolor operating in solid-state conditions[J].Biochemical Engineering Journal,2003,15:21.
[48] Boehmer U,Suhardi S H,Bley T.Decolorizing reactive textile dyes with white-rot fungi by temporary immersion cultivation[J].Engineering in Life Sciences,2006,6:417.
(责任编辑:马 忻)
Research Progress of Laccase Production by Lignin-degrading White Rot Fungi
FU KaiFU Shi-yu*ZHAN Huai-yu
(State Key Lab of Pulp& Paper Engineering,South China University of Technology,Guangzhou,Guangdong Province,510640)
(*E-mail:shyfu@scut.edu.cn)
Laccase is one of the ligninolytic enzymes secreted by white rot fungus which is the most important microorganism involved in degrading lignin in nature.Application of laccase to pulp bleaching is an attractive alternative to decrease chemicals demand and wastewater pollution.Therefore,the production of laccase in high yield has
much attention from researchers in past decades.The research progress of laccase production from white rot fungi in recent years is overviewed in this paper.Several effective methods to improve laccase yield in submerged and solid-state fermentation are mainly discussed,and the prospect of such research field in the future is also presented.
white-rot fungi;laccase;submerged fermentation;solid-state fermentation;organic waste;fermentor
Q55
A
0254-508X(2011)03-0065-06
傅 恺先生,在读博士研究生;主要研究方向:制浆造纸生物技术。
2010-12-01(修改稿)
国家自然科学基金 (30771689);广东省科技计划项目(2007B031600002)。

