阿魏酸酯酶产生菌的筛选及产酶条件的优化
邓轶韬,李夏兰,陈宗香,蔡婀娜
(华侨大学化工学院,福建泉州 362021)
阿魏酸酯酶产生菌的筛选及产酶条件的优化
邓轶韬,李夏兰,陈宗香,蔡婀娜
(华侨大学化工学院,福建泉州 362021)
从土壤中筛选到1株阿魏酸酯酶活力较高的菌株,通过形态观察,初步鉴定其为曲霉.通过单因素轮换法,对其液态发酵的产酶条件进行优化.结果表明:在查氏培养基中,以质量体积比为6%的麦麸为碳源,质量体积比为5%的硝酸钠为氮源,在30℃下发酵培养6 d后,其酶活力最高可达16.33μkat·L-1.
阿魏酸;阿魏酸酯酶;曲霉;筛选
阿魏酸酯酶(Feruloyl Esterases,FA Es)是羧酸酯酶的一个亚类,能水解植物细胞壁中羟基肉桂酸与糖之间的酯键[1],可应用于从农副产品中释放阿魏酸[2],漂白纸浆[3],生产燃料乙醇[4],以及生物合成酚酸衍生物[5].自1991年 Faulds等[6]首次分离出阿魏酸酯酶以来,已有超过30种阿魏酸酯酶被纯化[7].国内对阿魏酸酯酶的研究主要集中于黑曲霉.欧仕益等[8]开展了黑曲霉液态发酵产阿魏酸酯酶和阿拉伯木聚糖酶的研究;王洪川等[9]利用黑曲霉进行固态发酵生产阿魏酸酯酶,其酶活可达7.421 nkat·g-1;张帅兵等[10]完成了黑曲霉阿魏酸酯酶A的克隆和表达;谢春元等[11]研究了阿魏酸酯酶在饲料瘤胃降解中的功效,发现阿魏酸酯酶既能加快饲料的降解速率,又能提高降解程度.本文通过初筛和复筛从土壤中获得1株阿魏酸酯酶产生菌,并优化其液态发酵的产酶条件.
1 材料与方法
1.1 培养基成分及培养条件
(1)菌种保藏培养基(马铃薯琼脂培养基).取200 g马铃薯切成小块,加水煮沸0.5 h,过滤,取滤液,加入20 g葡萄糖,15 g琼脂,补足水至1 L,p H值自然;然后,倒入试管中,于121℃灭菌20 m in后制成斜面.菌种接种到培养基后于30℃培养数天,待菌落成熟后转到4℃保存.
(2)菌种分离培养基.将灭过菌的马铃薯培养基倒入无菌平皿中室温冷却凝固;将菌液涂布于培养基上,于30℃培养至成熟.
(3)初筛培养基.FeSO4·7H2O 0.01 g,NaNO32.0 g,KCl 0.5 g,M gSO4·7H2O 0.5 g,K2HPO41.0 g,蔗糖30 g,琼脂20 g,蒸馏水1 L,p H值自然;121℃灭菌20 min.每块平板倒入约20 m L培养基后,立即加入0.3 m L无菌的含阿魏酸乙酯的二甲基甲酰胺溶液(质量体积比为10%),摇匀至平板呈均匀的乳白色.接种后于30℃培养数天,观察是否有透明圈出现.
(4)种子培养基(马铃薯培养基,不含琼脂).在250 mL摇瓶中加入50 mL培养基,于121℃灭菌20 min.取一环保存于4℃马铃薯斜面上的菌种接种到50 m L马铃薯摇瓶培养基中,于30℃,200 r· min-1下培养24 h.
(5)复筛培养基(发酵培养基).FeSO4·7H2O 0.01 g,NaNO32.0 g,KCl 0.5 g,K2HPO40.76 g, M gSO4·7H2O 0.5 g,麦麸20 g,蒸馏水1 L,p H值自然.在250 mL摇瓶中称取1 g麦麸,再加入50 mL液体部分,于121℃灭菌20 min.将培养24 h的种子液按体积比为4%的接种量接种到50 mL发酵培养基中,于30℃,200 r·min-1下培养一定时间.
1.2 菌种筛选与鉴定
土样分别取自福建泉州华侨大学附近的菜地和果园.将一定量的土样置于无菌平皿中,再以体积比为1∶1.5的比例加入麦糟(50目),搅拌均匀后用无菌水润湿,于30℃培养3 d.称取1 g土样放入盛有99 m L无菌水和玻璃珠的三角烧瓶中,逐步稀释制成10-2,10-3,10-4,10-5的土壤溶液;然后,各取0.1 mL的土壤溶液接种在PDA培养基的平板上,用涂布棒涂布均匀后,在30℃培养3 d.
用无菌牙签将产生的单菌落接种到初筛培养基的平板上,于30℃培养5 d;然后,将产生透明圈的菌落用划线分离的方法再一次接种于初筛培养基的平板上,培养4 d得到纯菌落平板.最后,从纯菌落平板上选取1株透明圈最大的菌种,接种于50 mL的PDA种子培养基,于30℃培养1 d后以体积比为4%的接种量接于50 mL复筛培养基中,于30℃培养7 d,每24 h取样1次测定酶活.
在马铃薯琼脂平板上培养菌株,观察菌落培养特征和显微形态,对其进行鉴定.
1.3 产酶条件的优化
采用单因素轮换法,考察碳源、氮源、麦麸浓度、硝酸钠浓度、培养温度和发酵时间等因素对产酶量的影响,并对发酵条件进行优化.每次试验中只变化一个因素的水平,其他因素的水平保持固定不变,得到的每个因素的最优水平用于后续试验,逐一考察每个因素对产酶的影响,最终得到最优的发酵条件.
1.4 粗酶液的制备
取1 mL发酵液于4℃,10 000 r·min-1离心10 min,上清液即为粗酶液.
1.5 阿魏酸酯酶活力的测定
取250μL粗酶液于2 m L离心管中,于50℃保温5 min;然后,加入250μL一定浓度的阿魏酸甲酯溶液,反应10 min,再加入体积比为10%的500μL的冰乙酸终止反应.样品离心后于4℃保存,用高效液相色谱(HPLC)法测定样品中的阿魏酸含量.空白样品中冰乙酸在反应前加入,其他处理同上.
2 结果与讨论
2.1 菌种筛选
经过筛选得到1株阿魏酸酯酶活力较高的菌株,在初筛平板上培养3 d后产生明显的透明圈,如图1所示.图2为菌株的液态发酵产酶曲线.从图2可知,第3 d开始产酶,随后酶活稳定,至第7 d开始下降.菌株在马铃薯培养基上生长3 d后,菌落中部呈黄绿色,分生孢子头呈半圆形,小梗1层,顶囊半球形.初步鉴定其属于真菌门、半知菌类、丛梗孢目、丛梗孢科、曲霉族、曲霉属、黄-米曲霉组.
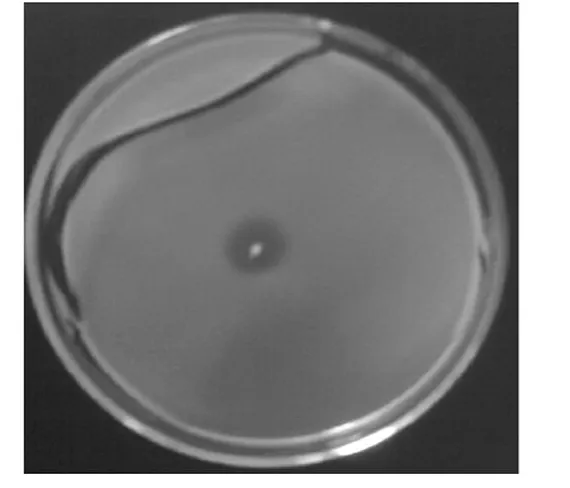
图1 培养3 d后初筛平板中的菌落形态Fig.1 Colony mo rphology in first screening plate after 3 d
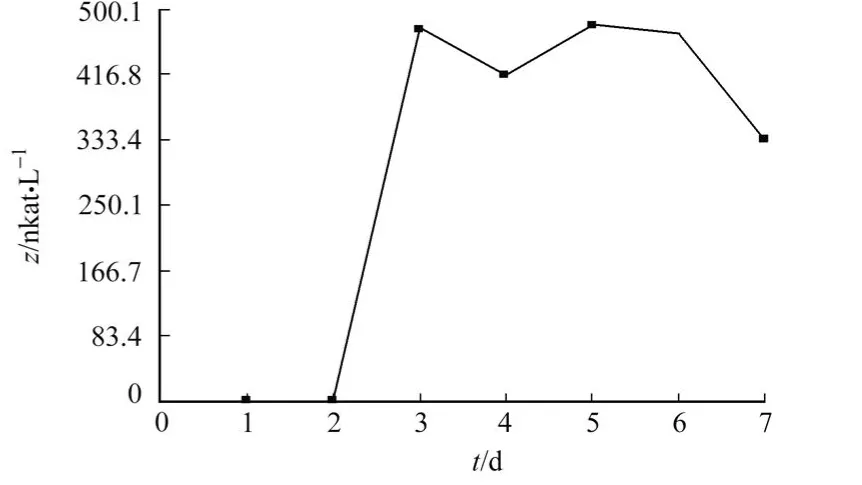
图2 真菌的液态发酵产酶曲线Fig.2 Time-course of feruloyl esterase of fungus liquid fermentation
2.2 产酶条件对产酶的影响
2.2.1 碳源和氮源 将种子液接种于不同种类碳源的发酵培养基中,于200 r·min-1,30℃下培养3 d后取样测定酶活.考察不同碳源和氮源对产酶的影响,结果如表1所示.
从表1可知,麦麸的发酵产酶最高,是脱淀粉麦麸发酵产酶的184%,表明去除麦麸中的淀粉后进行发酵,产酶量下降.但是,以淀粉为唯一碳源发酵,其结果与以木糖为唯一碳源一样,都不产阿魏酸酯酶.这与Shin等[12]的报道结果一致,其原因可能与诱导机制有关.麦麸中的淀粉可能仅仅有利于发酵初期菌体的生长,对阿魏酸酯酶的产生无诱导作用.
从表1可知,添加有机氮源(如酵母粉和蛋白胨)进行发酵,产酶普遍高于添加无机氮源(如酒石酸铵、氯化铵和硝酸铵),但硝酸钠除外.以硝酸钠为氮源进行发酵,产酶最高.

表1 碳源和氮源对产酶的影响Tab.1 Effectsof carbon sources and nitrogen sources on feruloyl esterase production
2.2.2 麦麸质量体积比 考察不同麦麸质量体积比w(麦麸)对产酶的影响,如图3所示.从图3可知,当麦麸质量体积比较低时,培养基中的麦麸不能满足菌体生长的需要,酶活较低;当麦麸质量体积比为6%~8%时,产酶最高;进一步提高麦麸浓度后,培养基中水含量减少,菌体的生长受到抑制,酶活降低.
2.2.3 硝酸钠质量体积比 考察了不同硝酸钠质量体积比w(硝酸钠)对产酶的影响,结果如图4所示.从图4可知,当硝酸钠质量体积比较低时,培养基中的硝酸钠不能满足菌体生长的需要,酶活较低;随着硝酸钠质量体积比的增大,酶活逐渐提高;当硝酸钠质量体积比为5%时,产酶最高;进一步提高硝酸钠质量体积比,培养基中离子浓度增大,抑制了菌体的生长,酶活降低.

图3 麦麸质量体积比对产酶的影响Fig.3 Effect of w heat bran mass/volume on feruloyl esterase production
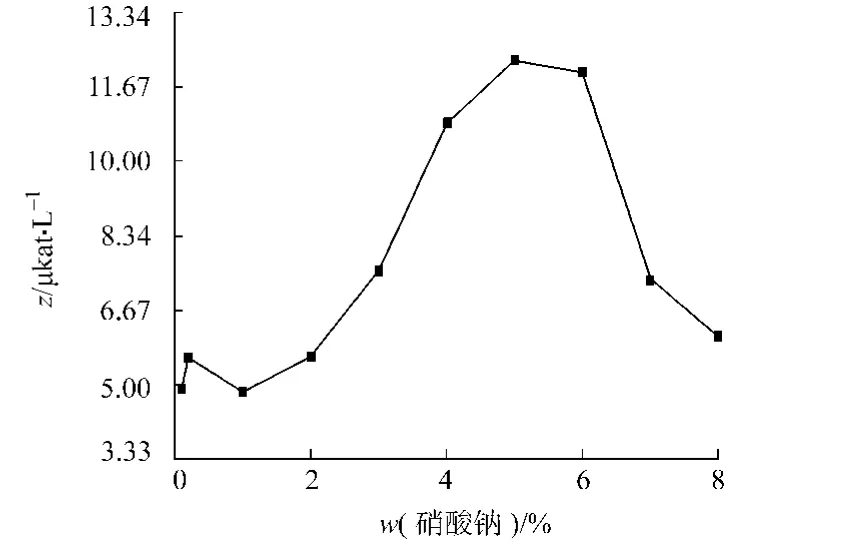
图4 硝酸钠质量体积比对产酶的影响Fig.4 Effect of sodium sulfate mass/volume on feruloyl esterase production
2.2.4 培养温度 不同培养温度(θ)对发酵产酶的影响,如图5所示.从图5可知,当温度为24℃时,产酶较少;随着温度的提高,酶产量增大;温度为30℃时产酶最多,温度至33℃时酶活略有下降.
2.3 发酵产酶时间曲线
考察了菌株产酶的时间曲线,如图6所示.从图6可知,发酵至第3 d开始产酶,并以每天约10%的速度增长;发酵至第6 d达到最高,酶活为16.33μkat·L-1,随后开始下降.
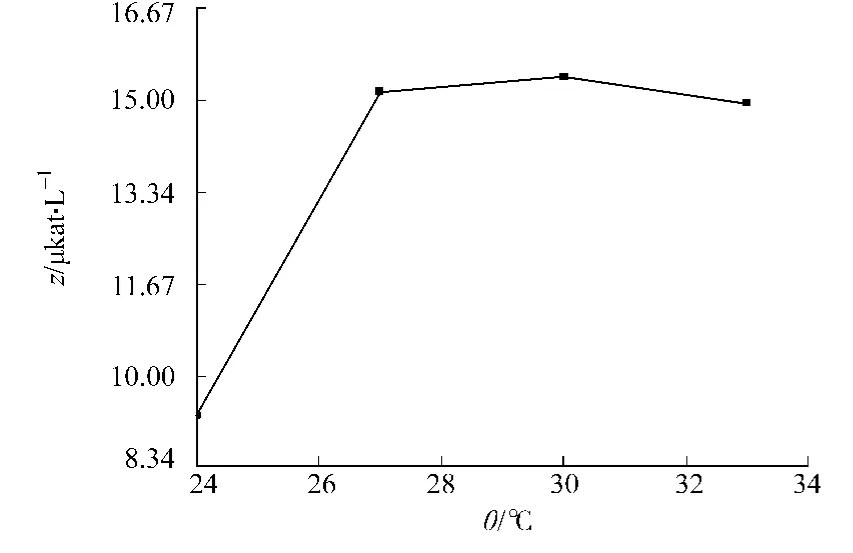
图5 培养温度对产酶的影响Fig.5 Effect of cultivation temperature on feruloyl esterase production
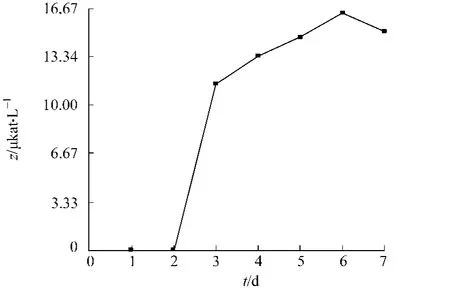
图6 发酵产酶的时间曲线Fig.6 Time-course of feruloyl esterase production
3 结束语
通过富集培养、梯度稀释、平板初筛和摇瓶复筛的方法,从土壤中得到1株阿魏酸酯酶活力较高的菌株,初步鉴定为曲霉.运用单因素法对其液态发酵的产酶条件进行优化,酶活最高可达16.33μkat· L-1,为阿魏酸酯酶的进一步研究打下了良好的基础.
[1]CREPIN V,FAULDS C,CONNERTON I.Functional classification of the microbial feruloyl esterases[J].App lied Microbiology and Biotechnology,2004,63(6):647-652.
[2]BENO IT I,NAVARRO D,MARNET N,et al.Feruloyl esterases as a tool for the release of phenolic compounds from agro-industrial by-p roducts[J].Carbohydrate Research,2006,341(11):1820-1827.
[3]RECPRD E,ASTHER M,SIGO ILLOT C,et al.Overp roduction of theAspergillus nigerferuloyl esterase for pulp bleaching application[J].App lied Microbiology and Biotechnology,2003,62(4):349-355.
[4]TABLA M,HERPOËl-GIMBERT I,MONOD F,et al.Enzymatic saccharification of w heat straw for bioethanol production by a combined cellulase xylanase and feruloyl esterase treatment[J].Enzyme and M icrobial Technology, 2006,39(4):897-902.
[5]GIUL IAN IS,PIANA C,SETTIL,et al.Synthesis of pentylferulate by a feruloyl esterase fromAspergillus nigerusing water-in-oilmicroemulsions[J].Biotechnology Letters,2001,23(4):325-330.
[6]FAULDSC,will IAM SON G.The purification and characterization of 4-hydroxy-3-methoxycinnamic(ferulic)acid esterase f romStreptom yces olivochromogenes[J].M icrobiology,1991,137(10):2339-2345.
[7]TOPA KAS E,VAFIAD IC,CHRISTA KOPOULOS P.Microbial production,characterization and applications of feruloyl esterases[J].Process Biochemistry,2007,42(4):497-509.
[8]欧仕益,张璟,汪勇,等.采用黑曲霉发酵制备阿拉伯木聚糖酶和阿魏酸酯酶的研究[J].食品科技,2004,(4):90-95. [9]王洪川,陈洪章.高产阿魏酸酯酶菌株的筛选及其固态发酵的研究[J].食品与发酵工业,2007,33(4):11-14.
[10]张帅兵,裴小琼,吴中柳.黑曲霉阿魏酸酯酶A的克隆、表达及快速酶活检测体系的建立[J].应用与环境生物学报,2009,15(2):276-279.
[11]谢春元.阿魏酸酯酶在饲料细胞壁瘤胃降解中的功效和饲用复合酯酶配伍筛选[D].北京:中国农业大学,2007.
[12]SH IN H,CHEN R.Production and characterization of a type B feruloyl esterase from fusarium proliferatum NRRL 26517[J].Enzyme and Microbial Technology,2006,38(3/4):478-485.
[13]DONAGHY J,KELL Y P,MCKA Y A.Detection of ferulic acid esterase production byBacillus spp.and lactobacilli[J].App lied M icrobiology and Biotechnology,1998,50(2):257-260.
(责任编辑:黄晓楠英文审校:刘源岗)
Screen ing of Feruloyl Esterases Producing Strain and Optim ization of the Enzyme Production
DENG Yi-tao,L IXia-lan,CHEN Zong-xiang,CA IE-na
(College of Chemical Engineering,Huaqiao University,Quanzhou 362021,China)
A strain producing feruloyl esterases was obtained from the soil.It was preliminarily identified asAspergillus sp.according to the morphological characteristics.Production of feruloyl estserses was op timized by single facto r method.Results showed that the highest enzyme activity could reach 16.33μkat·L-1after 6 days at 30℃in Czapek medium containing 6%(mass/volume)w heat bran and 5%(mass/volume)sodium nitrate.
ferulic acid;feruloyl esterase;Aspergillus sp.;screening
Q 556.1
A
1000-5013(2011)03-0300-04
2010-04-23
李夏兰(1965-),女,教授,主要从事生物化工的研究.E-mail:xialan@hqu.edu.cn.

