低温对EBPR系统生物除磷特性的影响
(北京工业大学 北京市水质科学与水环境恢复工程重点实验室,北京,100124)
温度对EBPR生物除磷系统的影响可以从2个方面来阐述。一方面,温度降低,使得聚磷菌的代谢速率降低[1−3],其吸放磷速率会受到一定的影响,在特定的周期时间内,EBPR系统的除磷效率会有所下降[3];另一方面,从PAO(聚磷菌)-GAO(聚糖菌)的竞争角度来说,低温条件易于EBPR系统的稳定运行。这是由于PAO是一种嗜冷性细菌[4−6],其在低温条件下对挥发性脂肪酸(VFAs)依然具有较强的利用能力,而GAO对低温的适应能力较弱,因此,在低温条件下,聚磷菌在PAO-GAO竞争中占优势,可有效抑制聚糖菌对EBPR系统的不利影响[7−9]。从已报道的研究结果来看:EBPR系统在低温条件下运行时不但不会发生恶化,其运行效果反而被增强[10−12]。但是,在以往的研究中,多采用配水展开实验,配水水质与实际污水的水质状况存在较大差距,得到的结论也与实际污水厂的运行情况存在较大的差异[12]。在此,本文作者以实际生活污水为研究对象,考察低温对EBPR系统除磷性能的影响以及对PAO-GAO竞争的影响。
1 实验材料与方法
1.1 实验水质
本实验采用试验采用北京工业大学家属区排放的实际生活污水,试验期间其主要水质指标如表1所示。

表1 实际生活污水水质指标Table 1 Real domestic wastewater characteristics
1.2 实验装置及运行阶段
本试验为实验室小试研究。采用SBR有机玻璃反应器,如图1所示。反应器直径为20 cm,高为40 cm,总容积为12 L,有效容积为10 L。

图1 SBR反应器示意图Fig.1 Schematic diagram of SBR reactor
反应器每天运行2个周期,采用瞬间进水方式,1个周期包括进水、厌氧2 h、好氧2 h、沉淀0.5 h和排水15 min共5个阶段。维持污泥质量浓度3 g/L,控制污泥龄为10 d,排水比为80%。反应器配有溶解氧(DO)在线监测仪。
试验共分4个阶段进行,不同阶段控制不同的实验温度(20,15,10和5 ℃),考察不同温度下聚磷菌的放吸磷特性,运行工况如表2所示。在好氧阶段初期投加烯丙基硫脲(Allylthiourea,简称 ATU)消除硝化反应对EBPR系统的影响[5]。各工况下的曝气量为160 L/h。

表2 实验运行阶段Table 2 Running phase of experiment
1.3 试验水质分析方法
COD采用COD快速测定仪测定;PO43−-P采用抗坏血酸−钼酸铵法测定;VFAs采用气相色谱法测定;采用WTW测定仪及相应探头在线监测液相内DO和温度。
2 实验结果与讨论
2.1 中温条件(20 )℃下EBPR系统驯化
试验污泥在20 ℃(中温)条件下,在SBR反应器中进行驯化,驯化持续 30周期。20周期后,出水PO43−-P质量浓度可稳定维持在0.5 mg/L以下,除磷率稳定维持在90%以上,如图2所示。
20 ℃下,典型周期(第27周期)中COD,VFA和P的变化规律如图3所示。从图3可见:进水PO43−-P质量浓度为 7.85 mg/L,厌氧末 PO43−-P质量浓度为28.15 mg/L,厌氧释磷率为358.5%,厌氧阶段前30 min的释磷速率为5.37 mg/(g·h);进水中VFA质量浓度为23.21 mg/L,在厌氧阶段60 min时几乎利用完全(1.34 mg/L),释磷速率收到底物VFAs浓度的限制,逐渐减小;吸磷过程在好氧阶段90 min时完成,出水PO43−-P质量浓度为0.34 mg/L,好氧吸磷率为98.7%,除磷率95.6%;好氧阶段前 30 min的平均吸磷速率为11.67 mg/(g·h)。
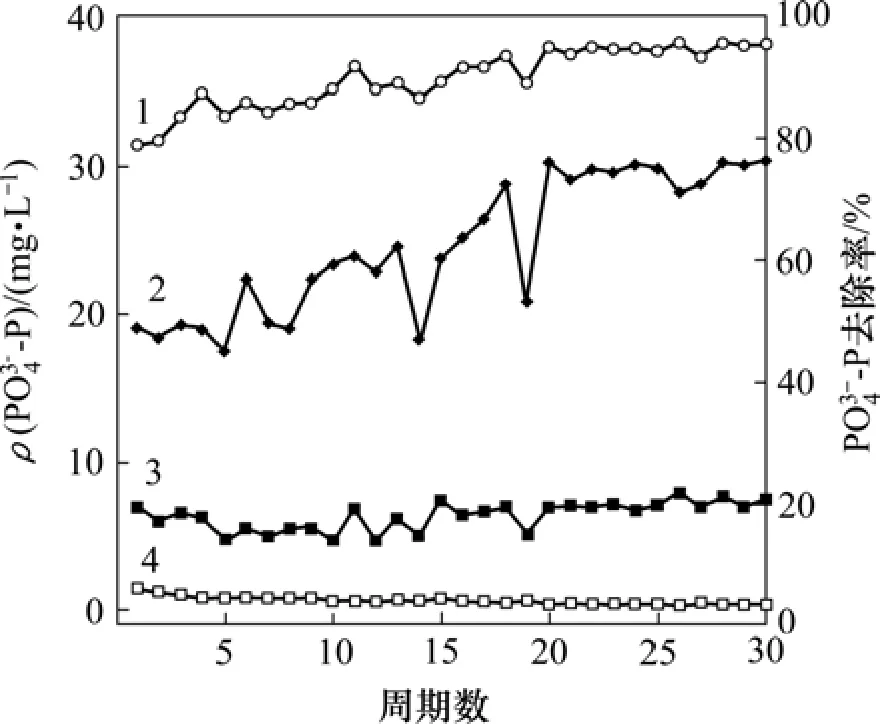
图2 EBPR系统驯化过程中除磷率的变化曲线Fig.2 Variety of PO43−-P during adjusting range of EBRP system

图3 20 ℃典型周期中COD,VFA和P的质量浓度变化规律Fig.3 Profiles of mass concentration of COD, VFA and P in typical operational cycle at 20 ℃
2.2 低温条件下EBPR系统的除磷性能
从第31个周期开始,EBPR系统先后在 15,10和5 ℃下运行,每个阶段持续10个周期,以考察低温对EBPR系统的短期影响。3个阶段的PO43−-P,COD和VFA质量浓度的典型变化曲线分别如图4~6所示,图7所示为3个阶段的DO质量浓度的比较结果。
从图4~6可以看出:低温(≤15 ℃)条件下,聚磷菌的吸放磷速率均较中温条件下的有所下降。15,10和5 ℃ 3个阶段典型周期的进水PO43−-P质量浓度分别为6.06,7.74和6.17 mg/L,厌氧末PO43−-P质量浓度分别为23.67,19.18和12.90 mg/L;厌氧释磷率分别为358.5%,247.8%和209.1%,较20 ℃时分别下降了0,30.8%和41.6%;厌氧阶段前30 min的释磷速率分别为 3.84,2.35和 1.37 mg/(g·h),较 20 ℃时分别下降了26.0%,56.2%和74.5%;厌氧阶段VFAs的利用率分别为88.9%,58.4%和33.8%。
聚磷菌在15,10和5 ℃ 3个阶段的好氧吸磷率分别为97.1%,76.0%和46.1%,较20 ℃时分别下降了1.0%,22.9%和57.8%;好氧阶段前30 min的吸磷速率分别为 6.43,2.24和1.34 mg/(g·h),较 20 ℃时分别下降了 44.9%,80.8%和 88.5%。出水 PO43−P质量浓度分别为 0.67,4.60和 6.95 mg/L,除磷率分别为88.9%,24.0%和−12.6%,较20 ℃时分别下降了7.0%,74.9%和112.6%。

图4 15 ℃典型周期中COD,VFA和P质量浓度的变化规律Fig.4 Profiles of mass concentration of COD, VFA and P in typical operational cycle at 15 ℃

图5 10 ℃典型周期中COD,VFA和P的质量浓度变化规律Fig.5 Profiles of mass concentration of COD, VFA and P in typical operational cycle at 10 ℃

图6 5 ℃典型周期中COD,VFA和P质量浓度的变化规律Fig.6 Profiles of mass concentration of COD, VFA and P in a typical operational cycle at 5 ℃
图7所示为4种温度下典型周期的DO质量浓度变化曲线。由图 7可以看到:随着温度的降低,DO质量浓度曲线的上升速率逐渐加快,且DO质量浓度逐渐增大。本试验各个阶段维持恒定曝气量160 L/h,DO质量浓度为充氧量质量浓度与耗氧量质量浓度之差,表明温度越低,微生物的耗氧速率越低。从侧面反映了聚磷菌在低温条件下的活性受到了抑制。

图7 不同工况的典型周期下DO质量浓度变化趋势Fig.7 Profiles of mass concentration of DO in typical circles of different stages
通过比较可以看出:15 ℃时,EBPR系统仍有较好的除磷性能,尽管在聚磷菌的最大吸放磷速率受到了较大影响。但是,在本试验的周期时间下,其释磷率和吸磷率仍然可以保证,能够取得较好的出水效果。当温度降至10 ℃及以下时,聚磷菌的吸放磷速率受到较为严重的抑制,出水效果严重恶化。
2.3 低温对PAO-GAO竞争的影响
在EBPR系统中,聚糖菌(GAO)是造成其运行不稳定的主要原因。GAO与PAO在厌氧条件下竞争有机底物VFAs,从而影响PAO的释磷量及PHA的合成,使得 EBPR系统的除磷效率下降。本实验通过分析VFAs和PO43−-P质量浓度在不同温度下的变化情况,来推测PAO−GAO竞争情况的改变。
图 8所示为不同工况下磷在厌氧段的变化趋势图。由图8可见:低温(15,10和5 ℃)下的释磷曲线与20 ℃下的不同,在厌氧阶段,释磷量与时间几乎呈线性关系。这主要是因为低温条件下的VFAs在厌氧段没有降解完,聚磷菌的释磷速率没有收到底物的限制,释磷量随时间线性增长。

图8 不同工况下磷质量浓度在厌氧段的变化趋势Fig.8 Profiles of mass concentration of P in typical circles of different stages in aerobic phase
图9所示为不同工况下VFAs在厌氧段的变化趋势图。从图9可以看出:在10 ℃和5 ℃时,VFAs的质量浓度也与时间呈较好的线性关系,但是,在15 ℃时,VFA的质量浓度变化曲线与时间不再呈线性关系,其变化曲线与 20 ℃时的更为相近;在厌氧前30 min内,于温度5,10,15和20 ℃时释磷量的比为1:1.7:2.6:3.01,但VFAs利用量的比为1:1.7:4.5:9.09,表明在15~20 ℃时,厌氧阶段初期的一部分VFAs被聚糖菌利用,聚磷菌和聚糖菌存在一定的竞争;而在5~10 ℃时,聚糖菌的活性受到了一定的抑制,且由于释磷量的比与VFAs利用量的比相同,表明聚糖菌的活性在10 ℃与5 ℃时没有明显的变化。
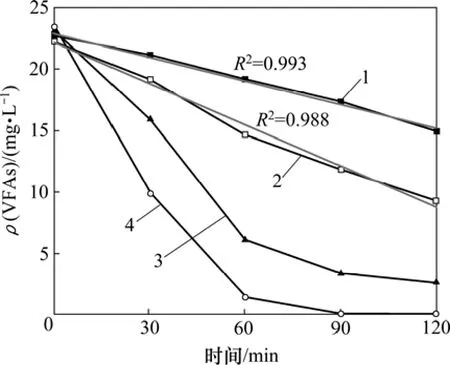
图9 不同工况下VFAs质量浓度在厌氧段的变化趋势Fig.9 Profiles of mass concentration of VFAs in typical circles of different stages in aerobic phase
3 结论
(1) EBPR系统的释磷和吸磷速率随着温度的降低而下降。但是,在周期时间为4 h(厌氧段和好氧段各2 h)时,15 ℃下的EBPR系统仍能表现出较好的除磷特性,而10 ℃及5 ℃的EBPR系统的吸放磷量受到严重影响,EBPR系统无法正常运行。
(2) 低温可有效抑制聚糖菌(GAO)的活性。在5~10 ℃时,GAO的活性受到较明显的抑制,且GAO在10 ℃和5 ℃时的活性没有明显的变化。
(3) 当厌氧阶段VFAs不作为限制因素时,释磷量与时间呈线性增长关系。
[1] Grady C P L Jr, Daigger G T, Lim H C. Biological wastewater treatment[M]. 2nd ed. New York: Marcel Dekker, 1999: 1−1076.
[2] Beatons D, Vanrolleghem P A, Hosten L H. Temperature effects in bio-P removal[J]. Wat Sci & Tech, 1999, 39(1): 215−225.
[3] Damir B, Susanne L M C, van Loosdrecht M. Influence of temperature on EBPR: Process and molecular ecological studies[J]. Wat Res, 1998, 32(4): 1035−1048.
[4] Knoop S, Kunst S. Influence of temperature and sludge loading on activated sludge settling, especially on microthrix parvicella[J]. Wat Sci & Tech, 1998, 37(4/5): 27−35.
[5] Euiso C, Daewhan R, Zuwhan Y, et al. Temperature effects on biological nutrient removal system with weak municipal wastewater[J]. Wat Sci & Tech, 1998, 37(9): 219−226.
[6] Helmer C, Kunst S. Low temperature effects on phosphorus release and up take by microorganisms in EBPR plants[J]. Wat Sci & Tech, 1998, 37(4/5): 531−539.
[7] Panswad T, Doungchai A, Anotai J. Temperature effect on microbial community of enhanced biological phosphorus removal system[J]. Water Res, 2003, 37(2): 409−415.
[8] Erdal U G, Erdal Z K, Randall C W. The competition between PAOs (phosphorus accumulating organisms) and GAOs(glycogen accumulating organisms) in EBPR (enhanced biological phosphorus removal) systems at different temperatures and the effects on system performance[J]. Wat Sci& Tech, 2003, 47(11): 1−8.
[9] Erdal Z K, Erdal U G, Randall C W. Biochemistry of enhanced biological phosphorus removal and anaerobic COD stabilization[J]. Water Sci & Tech, 2005, 52(10/11): 557−567.
[10] 姜体胜, 杨琦, 尚海涛, 等. 温度和 pH 值对活性污泥法脱氮除磷的影响[J]. 环境工程学报, 2007, 1(9): 10−14.JIANG Ti-sheng, YANG Qi, SHANG Hai-tao, et al. Effects of temperature and pH on nitrogen and phosphorus removal by activated sludge[J]. Chinese Journal of Environmental Engineering, 2007, 1(9): 10−14.
[11] Henze M, Harrenmoes P, Jansen J L C, et al. Wastewater treatment/biological and chemical processes[M]. 2nd ed. New York: Springer, 1997: 109−115.
[12] Barnard J L, Stevens G M, Leslie P J. Design strategies for nutrient removal plant[J]. Wat Sci & Tech, 1985, 17(11/12):233−242.

