水稻锌指蛋白基因OsZRL 过表达对根系发育的影响
玉晓红,曾正明,苗雁文,牛向丽
(重庆大学 农学及生命科学研究院,重庆400044)
在生物体中,转录因子通过与基因启动子区的顺式作用元件特异结合而激活或抑制功能基因的转录,调控基因的表达和机体功能。锌指蛋白(zinc-finger protein)是转录因子中研究得比较深入的类型[1],锌指蛋白因其具有可以结合锌离子的指状结构域-锌指结构域(zinc-finger domain)而命名。根据锌指结构域中半胱氮酸(C)和组氨酸(H)残基的数目和位置可将锌指蛋白分为C2H2、C2HC、C2C2等亚类。锌指蛋白中有单个或成簇出现的锌指结构域,依赖在长期进化过程中形成的锌指结构域的多变组合,使其不仅可以结合DNA,还可以结合RNA、蛋白质和脂类底物,甚至同一类锌指蛋白也显示不同的结合特性。因此,锌指蛋白具有调控基因转录、染色质重构等多种生理功能[2]。
在植物中普遍存在锌指蛋白,如在模式植物拟南芥基因组中预测有176个C2H2型锌指蛋白基因,这些锌指蛋白通过基因复制(gene duplication)机制、进化中变异而形成基因家族。有些锌指蛋白是植物所特有的,可能与植物的特异生活方式密切相关[3~4]。锌指蛋白广泛参与植物各个时期的生长发育调控、胁迫应答等[3,5~6]。如在玉米中锌指蛋白ID1基因调控开花时间,水稻中同源基因RID1控制着水稻植株从营养生长向生殖生长的转变[7~8]。但总体来说,在单子叶植物中相应系统研究还较少,而生长发育调控基因及其分子机制的探讨对于提高水稻等重要粮食作物产量、改善其田间农艺性状来说尤为重要。
本研究分离了一个水稻C2H2型锌指蛋白基因,命名为 OsZRL (Zinc-finger Rootless)。通过构建ZRL基因过量表达载体,利用农杆菌介导转化法获得转基因水稻。转基因植株表型显示,锌指蛋白基因OsZRL参与调控水稻的根系发育。
1 材料和方法
1.1 材料与试剂
1.1.1 水稻材料
水稻粳稻品种日本晴(Oryza sative L.Nipponbare)种子由本实验室提供。
1.1.2 菌株、质粒和试剂
大肠杆菌(Escheriachia coli)DH5a,根癌农杆菌(Agrobacterium tumefaciens)EHA105,植物表达载体pHB由本实验室保存。植物RNA提取试剂盒、基因组DNA提取试剂盒购于北京天根生化有限公司。pEASY Blunt载体、高保真DNA聚合酶、质粒提取试剂盒、琼脂糖胶回收试剂盒Transgene公司。限制性内切酶、Real-time PCR试剂盒购于TaKaRa公司。反转录试剂盒购于TOYOBO公司。引物利用Primer Premier软件设计,由上海英骏生物技术有限公司合成。序列测定由北京华大基因科技有限公司完成。
1.2 方法
1.2.1 OsZRL基因扩增与载体构建
根据水稻OsZRL基因(Genebank登录号:NM_001062214)序列设计巢式引物扩增OsZRL基因,分别为:外侧引物 OsZRLF1:5'CGTCGGCATAAAGCAGTCTC 3',OsZRLR1:5'GCTGCTTCACTGCCTTTAGC 3';内侧引物 OsZRLF2:5'AAGCTTCGAGCTGAAGTAGGGATGG 3',OsZRLR2:5'GAGCTCTTGCATTTTGTGTGGGTGTG 3'(下划线为限制性内切酶位点Hind III、Sac I)。按照植物RNA提取试剂盒说明从水稻品种日本晴叶片中提取总RNA,取1μg合成第一链cDNA。第一轮PCR条件为:98℃2min,98℃10s,56℃10s,72℃80s,30个循环,72℃总延伸5min。第二轮PCR条件为:98℃2min,98℃10s,58℃10s,72℃75s,30个循环,72℃总延伸5min。PCR产物经琼脂糖电泳检测、胶回收后连接于pEASY Blunt载体。将连接产物转化大肠杆菌DH5a感受态细胞、鉴定阳性克隆并送测序。
测序正确的OsZRL基因经HindIII、SacI双酶切、胶回收后连接于植物表达载体pHB。经菌落PCR、酶切鉴定获得35S::OsZRL载体,命名为pHB-OsZRL。然后利用冻融法转化农杆菌EHA105,并鉴定阳性转化菌,用于侵染水稻愈伤组织。
1.2.2 OsZRL基因生物信息学分析
通 过 BLAST (http://www.ncbi.nlm.nih.gov/BLAST/)寻找OsZRL基因在拟南芥中的同源基因,并通过DNAMAN软件进行比对。利用SMART 软 件 (http://smart.embl - heidelberg.de/)预测OsZRL基因的功能结构域。
1.2.3 OsZRL基因过表达载体遗传转化
本实验水稻遗传转化采用农杆菌介导法。将日本晴成熟种子去壳得到成熟胚,分别于75%乙醇(v/v)、25%次氯酸钠溶液(v/v)消毒1min、25 min后,接种于诱导培养基。连续间隔14d继代2次后进行农杆菌浸染,共培养2d后去除农杆菌。在含有潮霉素的培养基中筛选抗性愈伤,然后转入分化培养基,分化后移至生根培养基。
诱导培养基:NB + 2mg·L-12,4-D,pH 5.8~5.9;共培养培养基:NB+2mg·L-12,4-D+100μmol·L-1乙酰丁香酮,pH 5.2;筛选培养基:NB+2mg·L-12,4-D +250mg·L-1羧苄青霉素 +30~50mg·L-1潮霉素,pH 5.8~5.9;分化培养基:NB + 10mg·L-1KT + 0.4 mg·L-1NAA +250mg·L-1羧苄青霉素,pH 5.8~5.9;生根培养基:1/2MS,pH 5.8~5.9。
1.2.4 OsZRL基因过表达转基因植株表型分析
将转基因分化小苗从生根培养基移至土壤中生长,进行表型观察。提取野生型、转基因小苗基因组DNA,利用载体所带潮霉素抗性标记基因Hpt序列(Genebank登录号:E00777),进行PCR检测鉴定转基因阳性植株。扩增引物分别为HPTF:5'TCGTTATGTTTATCGGCACTTTG 3',HPTR:5'GCGTCTGCTGCTCCATACAAG 3'。提取野生型、转基因阳性植株RNA,利用实时定量PCR(RT-PCR)检测OsZRL基因表达水平。以ACTIN(Genebank登录号:X16280)做为内参基因。所用 ACTIN 引物为:RTACTF:5'AGTGATTGCACCACCAGAAAGA 3',RTACTR:5'CAGGACCAGATTCATCATACTCG 3';OsZRL引物为:RTZRLF:5'GGATGAAGAAGACGATGATGACG 3',RTZRLR:5'CGATCCCTCGCTATGTACTTGC 3'。RT-PCR反应条件:95℃30 s;95℃5s,60℃20s,40个循环。扩增后,样品在95℃保持15s,60℃保持1min。后每15s上升0.5℃进行溶解曲线分析。每个样品重复三次。PCR 反 应 在 Applied Biosystems Step-One RTPCR system上运行。
2 结果与分析
2.1 OsZRL基因克隆与载体构建
利用野生型水稻品种日本晴叶片cDNA扩增OsZRL基因,第二轮PCR产物得到预期片段(1283bp,图1A)。将PCR产物连接于pEASY Blunt载体,阳性克隆进行测序。测序结果经比对确认为水稻OsZRL基因全长编码序列。分别用HindIII、Sac I双酶切测序pEASY Blunt载体和pHB植物表达载体,连接、转化后获得过表达载体pHB-OsZRL。酶切结果显示所得片段与预期相符,表明OsZRL基因过表达载体构建正确(图1B,C)。提取pHB-OsZRL质粒,冻融法转化农杆菌EHA105用于侵染。

图1 OsZRL基因过量表达载体构建Fig.1 Construction of OsZRLoverexpression vector
2.2 OsZRL基因生物信息学分析
利用SMART软件对OsZRL基因编码序列功能域进行分析,在第211~233位氨基酸有一个C2H2型锌指结构域,第298~320位氨基酸有一个C2HC型锌指结构域(图2)。序列比对表明,OsZRL基因与拟南芥中一个未知功能的锌指蛋白At1g08290有较高同源性,在锌指结构域有很高保守性(图2)。因此,推测OsZPL基因为一典型的锌指蛋白转录因子,可能在水稻中具有基因表达及发育调控作用。
2.3 转基因植株表型观察
通过农杆菌介导法转入野生型水稻品种日本晴,共获得35株独立转基因阳性分化植株,其中共有7株转基因小苗因根系不能正常发育,将转基因植株OX-1~OX-4移入土壤生长约一周后萎蔫死亡(图3A,B)。OX-5~OX-7持续在封闭培养瓶中培养,虽然有较多幼茎、叶发育,但由于始终只有极少根系发育,影响植株地上部分生长,茎叶褪绿发白,部分开始萎蔫死亡(图3C)。

图2 水稻OsZRL基因与拟南芥同源基因的氨基酸序列比对Fig.2 The amino sequence alignment between rice OsZRLand its homologous genes in Arabidopsis

图3 转基因植株表型Fig.3 Phenotype of transgenic plants
2.4 转基因植株鉴定与OsZRL基因表达量检测
提取转基因、野生型水稻叶片DNA,用于潮霉素抗性标记基因Hpt序列PCR扩增检测。阳性植株扩增出Hpt目标条带(560bp),而野生型植株未能扩增出目标条带(图4)。检测结果显示转基因根系不发育植株(OX-5~OX-7)、根系发育正常植株(OX-8、OX-9)均为阳性植株。
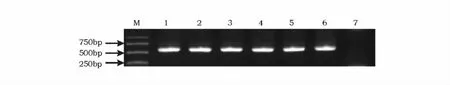
图4 OsZRL转基因植株阳性鉴定Fig.4 PCR analysis of OsZRLtransgenic plants
提取野生型水稻、5个转基因阳性植株(OX-5~OX-9)叶片RNA,采用RT-PCR法,分析转基因植株中OsZRL的表达情况。结果表明,3个根系不发育植株(OX-5~OX-7)中OsZRL基因较根系发育正常植株(OX-8、OX-9)及野生型显著提高(图5),初步表明OsZRL基因参与调控水稻根系生长发育。

图5 OsZRL转基因植株real-time RT-PCR分析Fig.5 Real-time RT-PCR analysis of expression levels of OsZRLin transgenic plants
3 讨论
尽管对植物锌指蛋白的研究工作已经进行了20多年,但是大部分被克隆的基因多局限于双子叶植物,对单子叶植物中锌指蛋白的研究还相对偏少[9]。本研究通过从水稻品种日本晴中克隆了一个具有锌指结构域的基因OsZRL,并构建过表达载体、转化野生型水稻对其功能进行初步分析,转基因植株表型分析结果表明锌指蛋白基因OsZRL参与调控水稻根系发育。
水稻根系是吸收水分、矿物质和感受土壤环境的桥梁,又是氨基酸、多种激素同化、合成的场所,根系状况直接影响着植株地上部分生长发育及产量的形成,是制约水稻产量潜力进一步发挥的关键因素。但由于植物根系隐藏于地下,其发育的形态和生理学观察不易进行,相应分子机制的研究也较其他植物器官滞后。虽然,近年在双子叶模式植物拟南芥根的发育方面有了比较大的进展[10],但由于单、双子叶植物根系的不同,如在拟南芥中有主根,然后顺序分生出侧根,而水稻、玉米等则是形成庞大而复杂的不定根系[11~12]。所以,谷类作物还没有一套具体的根系形态、生理特征改良指标,对根系发育的分子调控机制也所知甚少。
在已知的水稻根发育相关基因研究中,CRL1(CROWN ROOTLESS 1)和 WOX11(WUSCHEL-related homeobox gene)基因分别通过介导生长素信号传导或生长素/细胞分裂素信号整合调控水稻不定根的生长发育[13~14];OsRMC基因通过茉莉酸信号途径促进水稻根的发育、弯曲和卷曲[15];另一类basic helix-loop-helix(bHLH)转录因子基因RSL4(ROOT HAIR DEFECTIVE6-LIKE4)也控制着根部细胞生长的大小[16]。本研究通过转基因方法对锌指蛋白基因OsZRL功能的分析,为水稻根系发育分子调控机制的探讨提供了基础与新的线索。
[1]Yang Z R,Wang X C,Li X M,et al.Advance on the study of transcription factors in higher plants[J].Hereditas Lerview ,2004,26(3):403-408.
[2]Gamsjaeger R,Liew C K,Loughlin F E,et al.Sticky fingers:zinc-fingers as protein-recognition motifs[J].Trends in Biochemical Sciences,2007,32(2):63-70.
[3]Englbrecht C,Schoof H,B?hm S.Conservation,diversification and expansion of C2H2zinc finger proteins in the Arabidopsis thaliana genome[J].BMC Genomics,2004,5(1):39.
[4]Riechmann J L,Heard J,Martin G,et al.Arabidopsis transcription factors:genome-wide comparative analysis among eukaryotes[J].Science,2000,290(5499):2105-2110.
[5]Kasuga M,Liu Q,Miura S,et al.Improving plant drought,salt and freezing tolerance by gene transfer of a single stress inducible transcription factor[J].Nature Biotechnology,1999,17(3):287-291.
[6]Singh K,Foley RC,Onate-Sanchez L.Transcription factors in plant defense and stress responses[J].Current Opinion in Plant Biology,2002,5(5):430-436.
[7]Akiko Kozaki,Sarah H,Joseph C.The maize ID1flowering time regulator is a zinc finger protein with novel DNA binding properties[J].Nucleic Acids Research,2004,32(5):1710-1720.
[8]Wu C Y,You C J,Li C S.RID1,encoding a Cys2-His2-type zinc finger transcription factor,acts as a master switch from vegetative to floral development in rice[J].PNAS,2008,105(35):2915-2920.
[9]Guo S Q,Huang J,Jiang Y,et al.Cloning and characterization of RZF71encoding a C2H2-type zinc finger protein from rice[J].Hereditas,2007,29(5):607-613.
[10]Benfey PN,Bennett M,Schiefelbein J.Getting to the root of plant biology-impact of the Arabidopsis genome sequence on root research[J].The Plant Journal,2010,61(6):992-1000.
[11]Hochholdinger F,Park W J,Sauer M,et al.From weeds to crops:genetic analysis of root development in cereals[J].Trends in Biochemical Sciences 2004,9(1):42-48.
[12]Osmont K S,Sibout R,Hardtke C S.Hidden branches:developments in root system architecture[J].Annual Review of Plant Physiology and Plant Molecular Biology,2007,58:93-113.
[13]Inukai Y,Sakamoto T,Ueguchi-Tanaka M,et al.which is essential for crown root formation in rice,is a target of an AUXIN RESPONSE FACTOR in auxin signaling[J].The Plant Cell,2005,17(5):1387-1396.
[14]Zhao Y,Hu Y F,Dai M Q,et al.The WUSCHEL-related homeobox gene WOX11is required to activate shoot-borne crown root development in rice[J].The Plant Cell,2009,21(3):736-748.
[15]Jang J,Li J,Xu Y,et al.RNAi knockdown of Oryza sativa root meander curling gene led to altered root development and coiling which were mediated by jasmonic acid signalling in rices[J].Plant cell & Environment,2007,30(3):690-699.
[16]Yi K,Menand B,Bell E,et al.A basic helix-loop-helix transcription factor controls cell growth and size in root hairs[J].Nature genetics,2010,42(3):264-267.

