鸡胚盲肠上皮细胞体外培养纯化方法的研究
古少鹏,王敏霞,赵素芬,郑明学
(山西农业大学 动物科技学院,山西 太谷030801)
鸡盲肠上皮细胞是鸡柔嫩艾美尔球虫(E.tenella)的宿主细胞,研究盲肠上皮细胞体外培养技术,为E.tenella入侵宿主细胞提供体外模型,对研究E.tenella损伤机制及抗球虫药有着重要的意义。获得高纯度的上皮细胞是用其进行实验研究的前提和基础,但用消化酶消化法分离盲肠上皮细胞时必然混有大量的成纤维细胞等非目的细胞,且容易“疯长”成优势细胞群,造成上皮细胞纯度过低,无法进行试验研究。因此,选择适宜的消化酶和消化条件可获得大量健全的绒毛隐窝单位[1],有助于上皮细胞的纯化。此外,适宜的生长环境和种植密度也有利于获得高纯度上皮细胞。在此基础上,培养中应进一步选择适宜的方法纯化[2],方能满足研究需要。国内外学者对肠上皮细胞(IEC)进行了培养和纯化,来源涉及鼠、人、鸡、兔等物种[1,3~5],而鸡胚盲肠上 皮细胞培养 尚未见报道。为此,我们在前期选择的最佳消化条件和培养条件的基础上,探究适宜的鸡胚盲肠上皮细胞纯化方法,以期为鸡盲肠上皮细胞的体外培养提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
15~18日龄SPF鸡胚,购自山西隆克尔生物制药有限公司。
1.1.2 主要试剂
嗜热菌蛋白酶(美国Sigma),粉末低糖型DMEM、液体低糖型DMEM 培养基(GIBCO,美国);羟乙基哌嗪乙硫磺酸HEPES、胰岛素、表皮生长因子、L-谷氨酰胺、丙酮酸钠、甘梨醇、肝素钠、台盼蓝均为Amresco公司产品;坚固蓝BB盐为Sigma公司产品;优级胎牛血清进口分装;青霉素及硫酸链霉素为华北制药股份有限公司;其余药品为国产分析纯。
1.2 方法
1.2.1 鸡胚盲肠上皮细胞的消化
18日龄的鸡胚无菌取出盲肠,除肠系膜,纵切开盲肠,置于小烧杯中,用加有双抗的组织分散液(pH 7.4,2%甘梨醇和5%胎牛血清的DMEM 培养基)冲洗到上清基本清亮,剪碎成小于1mm3的组织块,再用组织分散液洗,沉淀1min,去除上清液,重复该步骤至上清液清亮;将剪碎的盲肠组织转移到青霉素小瓶中,加入50mg·L-1的嗜热菌蛋白酶的HEPES消化液,37℃慢速振荡消化120 min,消化完后用吸管吹打5min,静置除去上清液,向沉淀中加少量组织分散液吹打混匀静置取上清,重复此过程3次,最后得到的上清1600r·min-1离心3min,收集沉淀细胞,制成细胞混悬液。用移液枪取收集到的细胞混悬液和0.4%台盼蓝染液按1∶1于载玻片上混匀,加盖玻片,1~2 min后于显微镜下计数100个细胞,于不同的视野计数3次。活细胞圆形透亮不着色,死细胞被染成淡蓝色。细胞活力计算公式如下:活细胞率=活细胞总数/(活细胞总数+死细胞总数)×100%。
1.2.2 鸡胚盲肠上皮细胞的纯化
(1)低速离心去除单细胞
将1.2.1制成的细胞悬液经400μm不锈钢滤网过滤后分不同的转速和时间离心,分别是:1000r·min-1离心3min、1000r·min-1离心5 min、1200r·min-1离心5min和1400r·min-1离心5min。离心后取一滴上清于显微镜下观察,以上清中单细胞多且无团块的转速和时间为最佳离心条件。
上清中单细胞判定标准如下:无单细胞为-;3个视野中平均单细胞<5个为+;3个视野中平均单细胞为5~10个为++;3个视野中平均单细胞为10~15个为+++;3个视野中平均单细胞为15个以上为++++。
上清中团块判定标准如下:3个视野中无团块为-;3个视野中平均团块数<1个为+;3个视野中平均团块数为1~2个为++;3个视野中平均团块数为2~3个为+++;3个视野中平均团块数为3个以上为++++
(2)差速贴壁去除成纤维细胞
将1.2.1制成的细胞悬液于玻璃细胞培养瓶培养1.5h再倒瓶培养,分别于倒瓶之前和之后取培养液进行涂片,布安氏液固定,H.E.染色,显微镜下计数单细胞和团块所占的比例。
(3)低速离心结合差速贴壁纯化上皮细胞
将过滤后的细胞悬液以1200r·min-1离心5 min沉淀细胞,最后收集的细胞先用含10%胎牛血清的细胞培养液(pH7.3低糖型DMEM10g·L-1+20μg·L-1表皮生长因子+0.1g·L-1肝素钠+110mg·L-1丙酮酸钠+2.5mg·L-1胰岛素+200mmol·L-1谷氨酰胺+100U·mL-1青霉素+100mg·L-1链霉素)悬浮,种植到玻璃细胞培养瓶中,1.5h后把培养液连同未贴壁的细胞转移到离心管中1500r·min-1离心5min,细胞沉淀重新加入含2.5%胎牛血清的细胞培养液悬浮,进行细胞计数,调整浓度为每毫升2×105个团块。将盖玻片切割成适当大小,放入48孔细胞培养板,接种IEC细胞悬液,每孔400μL,培养于38.5℃、5%CO2、饱和湿度的培养箱中。每天于倒置显微镜下观察细胞形态,取培养至第3、4、6、7、8、11天的爬片细胞,甲醛甲醇固定,碱性磷酸酶染色孵育液染色(1-萘酚-磷酸钠50mg,0.2mol·L-1的pH 9.0Tris-HCl缓冲液60mL,蒸馏水60 mL,坚固蓝BB盐80mg充分混合,过滤),苏木精轻度复染,脱水,透明,封片,光镜观察。阳性细胞胞浆被染成棕黑色~棕黄色;阴性细胞不着色。每张片观察3个视野,每个视野计数100个细胞,计算上皮细胞所占比例。
1.2.3 数据处理方法
用SPSS 12.0统计软件对试验结果中数据进行ANOVA方差分析,试验数据以平均值±标准差表示。
2 结果
2.1 消化后的细胞活力
嗜热菌蛋白酶消化后细胞活力为(97.33±0.21)%。这与嗜热菌蛋白酶作用于肠黏膜基底膜特定分子,对细胞损伤小有关,故培养出的肠上皮细胞具有活力强的特点。
2.2 低速离心去除单细胞
通过离心后检测上清发现1200r·min-1离心5min时上清中单细胞较多且几乎无团块,为分离鸡胚盲肠上皮细胞的最佳离心条件。各离心条件离心鸡胚盲肠上皮细胞结果详见表1。
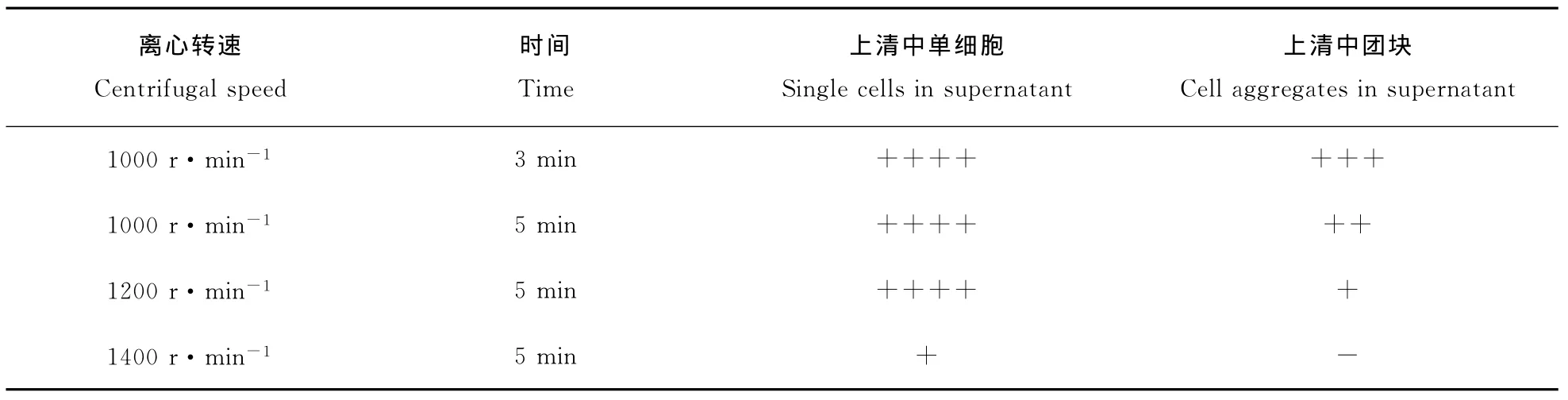
表1 离心法去除单细胞效果Table 1 Effects of eliminating single cells by centrifuging
2.3 差速贴壁去除成纤维细胞
贴壁1.5h倒瓶后团块比例(27.83±1.89)%大于贴壁前(22.23±1.62)%。由于成纤维细胞具有贴壁快的特点,1.5h基本全部贴壁,而IEC贴壁需12~24h或更长时间,这样倒瓶后的细胞就为比较纯的IEC。
2.4 低速离心结合差速贴壁纯化上皮细胞后的观察
2.4.1 形态学检查
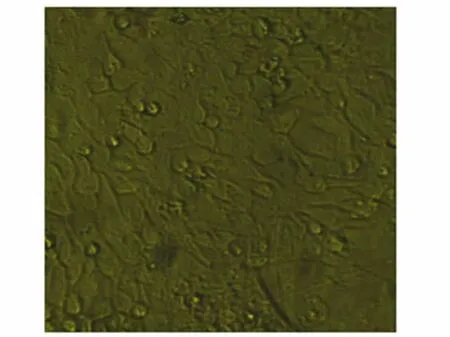
图1 鸡胚盲肠上皮细胞呈铺路石样生长×400Fig.1 Cobblestone-like cecum epithelial cells from chicken embryo×400
种植24h部分细胞贴壁,多呈圆形,部分细胞已伸展呈梭形和铺路石样;48h大部分细胞已贴壁并开始伸展,梭形和铺路石样的细胞均明显多于24h。细胞培养至第3天可见到未分散开的组织块,在组织块周围有游离的上皮样细胞及颗粒状物质,它们包围在组织块周围,呈晕状。以后细胞晕仍存在并变大,上皮样细胞排列紧密,成片生长,梭形的成纤维样细胞生长于细胞晕外围。有时可见铺路石样细胞排列紧密相互连接被一层膜包裹,形成上皮膜,以后生长时上皮膜整体移动,整个变大,铺路石样细胞逐渐呈优势生长,一直持续到第14天以上,见图1。
2.4.2 碱性磷酸酶染色
铺路石样细胞和散在的上皮细胞碱性磷酸酶染色呈阳性(图2)。所分离的细胞培养至第3、4、6、7、8、11天时,呈阳性反应的细胞比例均大于72%,见表2。提示本法培养的鸡胚盲肠上皮细胞的生长周期为11d以上,且纯度较高。
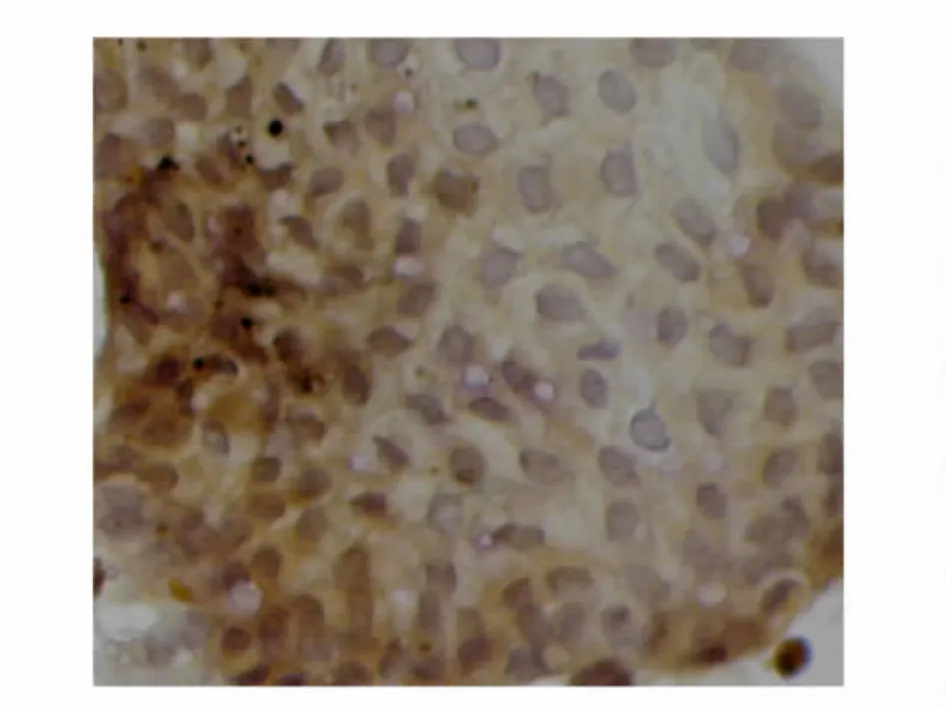
图2 铺路石样的上皮细胞碱性磷酸酶染色呈阳性×400Fig.2 Cobblestone-like epithelial cells are positive by AKP staining×400

表2 碱性磷酸酶染色阳性细胞比例Table 2 Percentage of positive epithelial cells by AKP staining
3 讨论与结论
常用的纯化上皮细胞的方法有机械刮除法、差速贴壁纯化法及消化排除法等。差速贴壁纯化上皮细胞的方法是根据成纤维细胞贴壁快的特点,90 min基本全部贴壁,而IEC贴壁需12~24h或更长时间,这样倒瓶后的细胞就是比较纯的IEC,其操作简单,对细胞影响小。张道杰等用嗜热菌蛋白酶进行人肠上皮细胞分离培养,采用差速贴壁纯化法获得的肠上皮细胞经免疫组化证实上皮细胞膜抗原阳性率几乎100%[6]。也有人利用IEC和成纤维细胞贴壁时间的差异并联合应用胶原酶消化的方法获得了高纯度的IEC细胞[7]。本试验应用嗜热菌蛋白酶获得大量的肠隐窝细胞团。要分离肠隐窝细胞团,所以在离心过程中,可根据单细胞和细胞团块的大小及比重不同,通过控制离心转速及时间把较大的团块离心下来,而小的单细胞仍在上清中,这样可以去除部分单细胞,在分离阶段对细胞进行初步纯化。通过离心后检测上清发现设置的4个离心条件中1200r·min-1离心5min上清中单细胞较多且几乎无团块,可确定为分离鸡胚盲肠上皮细胞的最佳离心条件。通过控制离心条件结合差速贴壁纯化可以去除大部分成纤维细胞,达到纯化上皮细胞的目的。除以上方法外,提高细胞接种密度也是一种简单、有效的纯化方法。接种密度低时,细胞团簇小且稀疏,细胞铺展速度慢,细胞团簇间空域很早就出现成纤维细胞或其他非目标细胞;接种密度高时,成纤维细胞不能形成优势生长。本实验前期筛选出的细胞种植密度为每毫升2×105个团块,也有助于上皮细胞纯化。
通过细胞的形态学观察发现,在接种后第3~14天铺路石样细胞逐渐呈优势生长,可认为细胞生长良好。但仅凭光学显微镜形态学观察不能完全鉴定为肠上皮细胞,也无法计算上皮细胞纯度。碱性磷酸酶是肠上皮细胞微绒毛上的标志性酶,可用于上皮细胞鉴定和纯度观察。碱性磷酸酶染色法包括钙钴法和偶氮偶联法,本实验所用的偶氮偶联法具有时间短,稳定,灵敏,不需要对照,不易弥散,图象清晰的特点[8]。一般认为上皮细胞纯度达到60%,可为体外进一步研究上皮细胞的功能提供较为理想的模型[9]。本研究培养的鸡胚盲肠上皮细胞纯度达72%以上,可为E.tenella体外培养研究提供依据。
[1]马玉龙,许梓荣,郭彤,等.鸡肠上皮细胞的分离及原代培养方法[J].中国兽医学报,2007,27(1):74-76.
[2]Walzer C,Benathan M,Frenk E.Thermolysin treatment:a new method for Dermo-epidermal separation[J].J Invest Dermatol,1989,92(1):78-81.
[3]Karam S M,Alexander G,Farook V,et al.Characterization of the rabbit gastric epithelial lineage progenitors in short term culture[J].Cell Tissue Res,2001,306(1):65-74.
[4]Moore K A,Lemischka I R.Stem cells and their niches[J].Science,2006,311(5769):1880-1885.
[5]Dekaney C M,Rodriguez J M,Graul MC,et al.Isolation and characterization of a putative intestinal stem cell fraction from mouse jejunum[J].Gastroenterology,2005,129(5):1567-1580.
[6]张道杰,蒋建新,陈永华,等.用嗜热菌蛋白酶进行人肠上皮细胞分离培养[J].第三军医大学学报,2004,26(11):1016-1018.
[7]张安平,刘宝华,张连阳,等.正常人结肠上皮细胞体外培养和鉴定[J].世界华人消化杂志,2004,12(8):1966-1968.
[8]杨文平,高峰,许辉,等.鸡肠上皮细胞体外原代培养研究 [J].江西农业学报,2007,19(5):113-115.
[9]杨宗保,邹小平,严洁.大鼠胃黏膜上皮细胞分离方法的实验研究[J].中医药学刊,2006,24(4):627-628.

