血清Ghrelin和瘦素水平与幽门螺杆菌感染的关系研究
郁海静,张 静,丁士刚,杨雪玲,刘琳娜,王晔
幽门螺杆菌 (Helicobacter pylori,Hp)于1982年由澳大利亚学者Warren和Marshall首先从慢性活动性胃炎患者的胃黏膜中分离出,多种细菌因子及毒力因子参与了Hp相关疾病的发生、发展,目前已经确认这种细菌和慢性胃炎、消化性溃疡、胃黏膜相关淋巴组织淋巴瘤和胃腺癌密切相关。Ghrelin是1999年由Kojima等[1]发现的由28个氨基酸组成的脑肠肽,主要来源于胃肠道,是生长激素促分泌激素受体的内源性配体,具有促进与调节生长激素分泌的作用,同时还具有增强食欲、减少脂肪利用、增加体质量、维持能量正平衡以及控制胃动力、促进胃酸分泌等多种生物学作用。瘦素是肥胖基因编码的蛋白质,主要在脂肪组织中生成和分泌,胃黏膜也有分泌[2]。瘦素通过抑制食欲、增加能量代谢而维持体质量[3]。Ghrelin与瘦素共同参与调节机体的能量代谢,两者作用相互补充又相互拮抗[4],两者在胃黏膜都有分泌。由Hp介导的炎症反应可损害胃黏膜细胞,包括分泌Ghrelin及瘦素的细胞[5]。目前关于Hp感染状况与血清Ghrelin及瘦素水平关系的研究结论尚有争议。本研究通过分析血清Ghrelin和瘦素水平与Hp感染的关系,进一步探讨Hp感染对血清Ghrelin和瘦素的影响,明确其临床意义。
1 对象与方法
1.1 研究对象 选取于2009年4—7月于北京大学第三医院进行胃镜检查的患者116例,其中男56例,女60例,年龄16~79岁,平均 (44.3±15.1)岁。所有患者除外肢端肥大症、骨质疏松、侏儒症、糖尿病以及合并严重感染等影响激素代谢的疾病及应激。记录患者的一般情况,包括性别、年龄、身高、体质量及体质指数 (BMI)。
1.2 血清Ghrelin和瘦素的检测方法 所有患者于胃镜检查前晨起7~10时空腹抽取静脉血2 ml,注入血清分离管中,室温1 000 g离心15 min,分离血清,置于-20℃的冰箱内备检。Ghrelin和瘦素检测采用ELISA法,应用商品化的试剂盒 (Human Ghrelin/Leptin ELISA Kit,美国Esblab公司),严格按照试剂盒说明进行操作。
1.3 Hp感染的判定方法 所有患者在进行胃镜检查的同时于胃窦和胃体至少分别钳取一块组织,固定于10%福尔马林溶液中,常规石蜡包埋,5μm连续切片,行Warthin-Starry(WS)染色,判定Hp感染状况。血清Hp抗体采用ELISA法测定,应用商品化的试剂盒 (抗Hp抗体检测试剂盒,北京贝尔生物工程有限公司),严格按照试剂盒说明进行操作。同一病例中胃窦和胃体黏膜中有任何一项WS染色阳性,同时血清Hp抗体阳性则判定为Hp感染。
1.4 统计学方法 采用SPSS 11.5统计软件进行统计学分析。正态分布的计量资料,两组间比较采用两独立样本均数的t检验;非正态分布的计量资料,两组间比较采用非参数检验(Mann-Whitney U检验)。计数资料采用χ2检验。相关分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同Hp感染情况下血清Ghrelin、瘦素水平的比较 Hp阳性患者血清Ghrelin水平低于Hp阴性患者,Hp阳性患者血清瘦素水平亦低于Hp阴性患者,但两组患者的血清Ghrelin、瘦素水平间差异均无统计学意义 (P>0.05,见表1)。

表1 不同Hp感染情况下血清Ghrelin、瘦素水平的比较Table1 Comparison of serum Ghrelin and leptin levels between different Hp status
2.2 不同性别患者血清Ghrelin、瘦素水平的比较 男性患者的血清Ghrelin水平低于女性患者,两组间差异有统计学意义(P=0.000);男性患者的血清瘦素水平低于女性患者,但两组间差异无统计学意义 (P=0.671,见表2)。

表2 不同性别患者血清Ghrelin、瘦素水平的比较Table2 Comparison of serum Ghrelin and leptin levels between males and females
2.3 不同性别患者Hp感染对血清Ghrelin、瘦素水平的影响所入选病例中Hp阳性患者75例,其中男39例,女36例;Hp阴性患者41例,其中男17例,女24例,Hp阳性组和Hp阴性组患者性别间差异无统计学意义 (χ2=1.179,P=0.278)。由表3、4可见,无论男性或者女性,不同Hp感染情况下血清Ghrelin、瘦素水平间差异均无统计学意义 (P>0.05),Hp感染与否对血清Ghrelin、瘦素水平均没有影响。
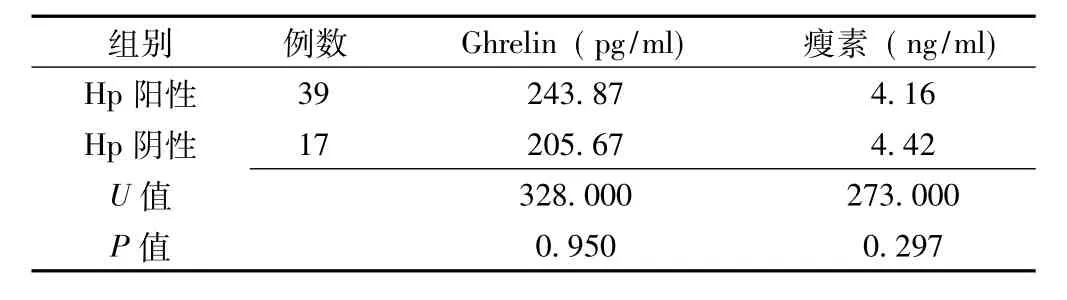
表3 男性患者不同Hp感染情况下血清Ghrelin、瘦素水平的比较Table3 Comparison of serum Ghrelin and leptin levels between different Hp status in males

表4 女性患者不同Hp感染情况下血清Ghrelin、瘦素水平的比较Table4 Comparison of serum Ghrelin and leptin levels between different Hp status in females
2.4 不同BMI患者血清Ghrelin、瘦素水平的比较 所入选病例中BMI<24.0 kg/m2的患者77例,BMI≥24.0 kg/m2的患者39例。BMI<24.0 kg/m2组的血清Ghrelin水平高于BMI≥24.0 kg/m2组,差异有统计学意义 (P=0.003);而BMI<24.0 kg/m2组的血清瘦素水平则低于BMI≥24.0 kg/m2组,差异有统计学意义 (P=0.000,见表5)。
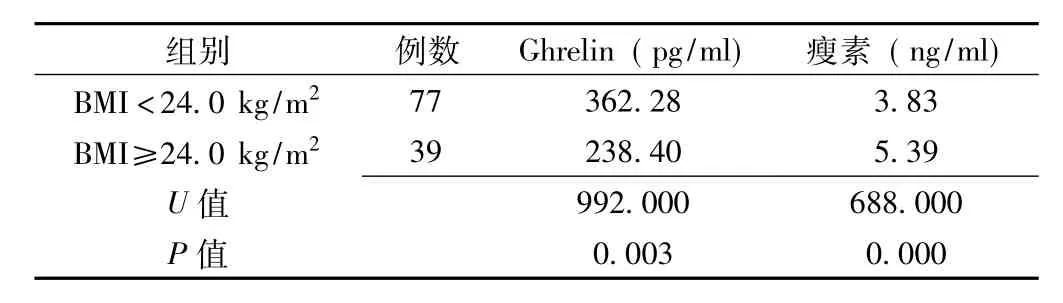
表5 不同BMI患者血清Ghrelin、瘦素水平的比较Table5 Comparsion of serum Ghrelin and leptin levels between different BMI
2.5 不同BMI患者Hp感染对血清Ghrelin、瘦素水平的影响Hp阳性患者75例,平均BMI为 (22.56±3.2)kg/m2;Hp阴性患者41例,平均BMI为 (23.47±3.8)kg/m2,Hp阳性组和Hp阴性组的BMI间差异无统计学意义 (t=1.310,P=0.194)。由表6、7可见,无论患者的BMI<24.0 kg/m2还是BMI≥24.0 kg/m2,不同Hp感染情况下血清Ghrelin、瘦素水平间差异均无统计学意义 (P>0.05),Hp感染与否对血清Ghrelin、瘦素水平均没有影响。
2.6 不同Hp感染情况下血清Ghrelin和瘦素的相关性 Hp阳性组血清Ghrelin和瘦素水平的Spearman相关系数为-0.088,P值为0.455;Hp阴性组血清Ghrelin和瘦素水平的Spearman相关系数为-0.217,P值为0.173。无论Hp感染与否,血清Ghrelin和瘦素水平之间均无相关性。

表6 BMI<24.0 kg/m2组患者在不同Hp感染情况下血清Ghrelin、瘦素水平的比较Table6 Comparison of serum Ghrelin and leptin levels between different Hp status in BMI<24.0 kg/m2 group

表7 BMI≥24.0 kg/m2组患者在不同Hp感染情况下血清Ghrelin、瘦素水平的比较Table7 Comparison of serum Ghrelin and leptin levels between different Hp status in BMI≥24.0 kg/m2 group
3 讨论
Ghrelin是由proghrelin分化成熟的一种28肽胃肠激素,同时在脑内神经系统表达,因此属于脑肠肽家族。Ghrelin主要来源于胃肠道,其次为十二指肠[6]。Ghrelin是生长激素促分泌激素受体的内源性配体,具有促进与调节生长激素分泌的作用,还具有增强食欲、减少脂肪利用、增加体质量、维持能量正平衡的调节能量代谢作用。近年来研究发现,Ghrelin也能影响胃肠动力及胃酸分泌,并有一定的黏膜保护作用。目前公认Hp为最常见的胃黏膜损害因子,与慢性胃炎、消化系溃疡、胃腺癌等多种疾病密切相关,并对胃酸分泌有一定的影响,根除Hp后可增加胃酸分泌。目前关于Hp感染与血清Ghrelin水平关系的研究结果仍未明确,可能与病例选择、检测手段、人群差异、营养状态和生活饮食习惯有关。本研究结果显示,Hp阳性患者血清Ghrelin水平低于Hp阴性患者,但两者间差异无统计学意义,提示Hp感染状态与血清Ghrelin水平无关。血清Ghrelin主要由胃黏膜泌酸细胞分泌[7],在Hp感染时,胃黏膜产生Ghrelin细胞减少,从而导致血清Ghrelin水平下降[8],根除 Hp后血清 Ghrelin水平明显上升[9],另有研究发现血清Ghrelin水平与Hp感染状况无关[10]。而Stec-Michalska等[11]研究发现,Hp感染增加胃黏膜 Ghrelin水平,CagA阴性菌株感染者血清Ghrelin水平有升高趋势,而CagA和VagA是Hp毒力的主要标志,由此推测血清Ghrelin水平可能与感染Hp的细菌毒力有关。而本研究仅限于判定是否存在Hp感染,并未对细菌毒力进行分析,可能影响研究结果。
瘦素是由脂肪细胞分泌的激素,胃黏膜细胞也可以产生,其分泌与机体脂肪含量呈负相关,血清瘦素水平可以反映机体脂肪储备情况。瘦素通过抑制食欲、减少摄食、增加能量代谢而维持体质量平衡[12],胃黏膜细胞分泌的瘦素对胃肠道具有重要作用。本研究未发现Hp的感染状况与血清瘦素水平相关。Roper等[10]的研究结果显示,Hp阳性患者血清瘦素水平明显低于Hp阴性患者,差异有统计学意义;Nishi等[2]的研究发现血清瘦素水平与Hp感染状况无关,而胃黏膜瘦素水平与Hp感染状况有关,Hp阳性患者明显高于Hp阴性患者,差异有统计学意义,由此推论胃黏膜细胞分泌的瘦素可能作用于胃黏膜局部,并不影响血清瘦素水平。为进一步明确胃黏膜细胞分泌瘦素的机制及与Hp感染状况的关系,需要进行胃液中瘦素水平检测及胃黏膜组织瘦素mRNA检测。
Ghrelin和瘦素共同作用于下丘脑弓状核神经肽Y神经元和agouti相关肽神经元,Ghrelin和瘦素的作用相互补充又相互拮抗,二者共同参与调节机体的能量代谢[13]。有研究表明,肥胖者血浆Ghrelin浓度低于体质量正常者,而血浆瘦素浓度增高,并且与 BMI相关[14]。本研究中发现,在 BMI<24.0 kg/m2和BMI≥24.0 kg/m2两组中血清Ghrelin和瘦素水平有明显差异,在BMI<24.0 kg/m2时,血清Ghrelin水平高,而瘦素水平低;当BMI≥24.0 kg/m2时,血清Ghrelin水平低,而瘦素水平高;在不同BMI情况下血清Ghrelin和瘦素水平与Hp感染状况无关。由此可见,血清Ghrelin和瘦素水平与BMI有关,这可能是血清Ghrelin和瘦素在调节机体能量代谢、维持能量平衡的一种适应性反应,而不受Hp感染状况的影响。
Ghrelin和瘦素在调节机体能量代谢中的作用是相反的,而本研究结果显示无论Hp感染与否,血清Ghrelin和瘦素水平间无相关性。Roper等[10]的研究发现,在Hp阳性患者中胃液Ghrelin和瘦素水平存在正相关,而在Hp阴性患者中胃液Ghrelin和瘦素水平无相关性,由此推测血清Ghrelin和瘦素水平关系可能受其他内分泌激素的影响,而Hp感染可能仅影响胃局部的Ghrelin和瘦素水平。
本研究结果显示,血清Ghrelin水平与性别有关,男性患者低于女性患者,但血清瘦素水平与性别无关,不同性别患者的血清Ghrelin和瘦素水平与Hp感染状况无关,与Chuang等[15]的研究结果一致,但与 Pacifico等[16]的研究结果相反。我们推测不同性别患者血清Ghrelin水平差异可能与男性、女性患者性激素水平差异、营养状况、脂肪分布、种族等多种因素有关,而不受Hp感染状况的影响,有待于进一步研究。
本研究结果显示,血清Ghrelin、瘦素水平与Hp感染状况无关,循环Ghrelin和瘦素水平受多种因素影响,可能不能真实反映在Hp感染的不同状况下胃黏膜Ghrelin和瘦素的表达情况,因此我们需要进一步检测胃黏膜组织中Ghrelin和瘦素的表达水平,同时还需要对Hp的细菌毒力进行分析,以进一步明确Hp的感染状况与Ghrelin和瘦素水平的关系。
1 Kojima M,Hosoda H,Date Y,et al.Ghrelin is a growth-hormonereleasing acylated peptide from stomach [J].Nature,1999,402:656-660.
2 Nishi Y,Isomoto H,Uotani S,et al.Enhanced production of leptin gastric fundic mucosa with Helicobacter pylori infection[J].World J Gastroenterol,2005,11:695 -699.
3 Cummings DE,Overduin J.Gastrointestinal regulation of food intake[J].J Clin Invest,2007,117:13 -23.
4 Beasley JM,Ange BA,Anderson CA,et al.Characteristics associated with fasting appetite hormones(obestatin,ghrelin,and leptin) [J].Obesity(Silver-Spring),2009,17(2):349-354.
5 Blaser MJ,Atherton JC.Helicobacter pylori persistence:biology and disease[J].J Clin Invest,2004,113:321-333.
6 Inui A,Asakawa A,Bowers CY,et al.Ghrelin,appetite,and gastric motility:the emerging role of the stomach as an endocrine organ [J].FASEB J,2004,18:439-456.
7 Takamori K,Mizuta Y,Takeshima F,et al.Relation among plasma ghrelin level,gastric emptying,and psychologic condition in patients with functional dyspepsia [J].J Clin Gastroenterol,2007,41:477 -483.
8 Osawa H,Nakazato M,Date Y,et al.Impaired production of gastric ghrelin in chronic gastritis associated with Helicobacter pylori[J].Journal of Clinical Endocrinology and Metabolism,2005,90:10-16.
9 Nwokolo CU,Freshwater DA,Ohare P,et al.Plasma ghrelin following care of Hp [J].Gut,2003,52:637.
10 Roper J,Francois F,Shue PL,et al.Leptin and ghrelin in relation to Helicobacter pylori status in adult males[J].JClin Endocrin Metab,2008,93:2007-2057.
11 Stec-Michalska K,Malicki S,Michalski B,et al.Gsatric ghrelin in relation to gender,stomach topography and Helicobacter pylori in dyspeptic patients [J].World J Gastroenterol,2009,15(43):5409-5417.
12 Cummings DE,Overduin J.Gastrointestinal regulation of food intake[J].JClin Invest,2007,117:13 -23.
13 Wu JT,Kral JG.Ghrelin:integrative neuroendocrine peptide in health and disease[J].Annals of Surgery,2004,239:464-474.
14 Monti V,Carlson JJ,Hunt SC,et al.Relationship of ghrelin and leptin hormones with body mass index and waist circumference in a random sample of adults[J].JAm Diet Assoc,2006,106:822 -828.
15 Chuang CH,Sheu BS,Yang HB,et al.Gender difference of circulating ghrelin ang leptin concentrations in chronic helicobater pylori infection [J].Helicobacter,2009,14:54-60.
16 Pacifico L,Anania C,Osborn JF,et al.Long-term effects of Helicobacter pylori eradication on circulating ghrelin and leptin concentrations and body composition in prepubertal children[J].European Journal of Endocrinology,2008,158:323 -332.

