HIV/HCV感染者合并脂肪肝的临床特征及独立预测因素研究
肖 江,李 鑫,万 钢,郜桂菊,杨 涤,韩 宁,张 伟,王 芳,范 颖,赵红心
肝脏脂肪变性是指以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征[1-2]。单纯性慢性丙型肝炎发展成脂肪肝由两种因素决定:一种是肥胖、糖尿病、高脂血症、大量饮酒等宿主代谢因素;另一种因素是丙型肝炎病毒 (HCV)。研究显示基因3型丙型肝炎病毒 (HCV-3)也可导致肝细胞脂肪变性[3]。此外,高效抗反转录病毒治疗 (highly actively antiretroviral therapy,HAART)是艾滋病患者发生肝脏脂肪变性的潜在预测因素。有些报道显示在HIV/HCV共同感染者中,HCV-3和体质指数 (MBI)的改变是脂肪肝的独立预测因素[4]。我国有关HIV/HCV共同感染者中肝脏脂肪变性临床特征的报道极少,故本研究通过对102例HIV/HCV共同感染者的临床特征进行回顾性分析,初步探讨HIV/HCV共同感染者中肝脏脂肪变性的发生率和独立危险因素。
1 资料与方法
1.1 一般资料 选取2008年10月—2011年5月在北京地坛医院住院的HIV/HCV共同感染者102例,其中男66例,女36例,平均年龄 (37.2±10.5)岁。入选患者均为经抗HIV的ELISA初筛和Western Blotting确证实验阳性,同时抗HCV的ELISA试验阳性,未进行干扰素抗HCV治疗;艾滋病诊断标准参照2006年中华医学会感染病学分会艾滋病学组制订的《艾滋病诊疗指南》[5],慢性丙型肝炎诊断标准依据中华医学会肝病分会制定的《丙型肝炎防治指南》[6]。
1.2 方法
1.2.1 收集临床资料 记录所有患者的性别、年龄、BMI、感染途径、血压、HAART方案和治疗持续时间,并通过Excel软件建立数据库。
1.2.2 实验室检查 检测所有患者的血脂[总胆固醇 (TC)、三酰甘油 (TG)、高密度脂蛋白 (HDL)、低密度脂蛋白(LDL)]、丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶(AST)、总胆红素 (T-BIL)、直接胆红素 (D-BIL)、尿素氮 (BUN)、肌酐 (Cr)、空腹血糖和HCV-RNA定量值,计算HCV-RNA阳性率,另外检测CD4+T淋巴细胞 (CD4细胞)计数,并通过Excel软件建立数据。
所有患者行腹部彩超检查,根据《非酒精性脂肪肝诊疗指南》[7],判断是否有肝脏脂肪变性、肝脾增大及胆囊结石。另外根据中国成人血脂防治指南制定联合委员会制定的《中国成人血脂防治指南》,判断是否存在代谢综合征及高血脂,即满足下列≥3项者可诊断为代谢综合征:BMI≥25 kg/m2;TG≥1.7 mmol/L;男性HDL≤0.91 mmol/L、女性HDL≤1.04 mmol/L;血压≥140/90 mm Hg(1 mm Hg=0.133 kPa);空腹血糖≥6.1 mmol/L或伴有糖尿病[8]。
1.3 统计学分析 采用SAS 10.0统计软件进行统计学分析。计量资料以 (±s)表示,采用t检验;计数资料采用χ2检验;以彩超提示的脂肪肝为因变量,性别、年龄、HIV/HCV感染途径、HAART方案和持续时间、TC、TG、HDL、LDL、ALT、AST、T-BIL、D-BIL、BUN、Cr和空腹血糖、CD4细胞计数水平、HCV-RNA定量值和HCV-RNA阳性率为自变量,进行Logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 HIV/HCV共同感染者的临床特征 102例HIV/HCV共同感染者抗HCV抗体均为阳性,其中HCV-RNA阳性73例(71.6%);67例 (65.7%)进行HAART,主要使用国内常见的一线治疗方案:齐多夫定 (AZT)/司坦夫定 (d4T) +拉米夫定 (3TC)+奈韦拉平 (NVP)/施多宁 (EFV),其中使用齐多夫定16例 (15.7%)、司坦夫定 48例 (47.1%)、奈韦拉平20例 (19.6%)、施多宁47例 (46.1%)、拉米夫定67例 (65.7%),另外有3例患者因齐多夫定/司坦夫定的副作用换用二线药物替诺福韦 (TDF);35例患者未进行HAART。HAART最长时间为122个月;平均CD4细胞计数为209 个/μl。
102 例HIV/HCV共同感染者的感染途径不同,可通过输血、有偿献血、异性、同性、静脉吸毒感染,其中输血感染者所占比例最大,为54.9%。血脂检查发现:19例患者TG边缘升高,22例TG升高;2例TC边缘升高,2例升高;6例LDL边缘升高,2例升高;75例HDL水平降低。肝功能检查提示37例ALT水平轻度异常,14例T-BIL水平异常。高血压者18例 (17.6%),代谢综合征25例 (24.5%),见表1。肾功能 (如BUN和Cr)均正常。
102 例患者行腹部彩超检查,21例 (20.6%)存在脂肪肝。彩超提示肝脏增大者9例 (8.8%),脾脏增大者45例(44.1%)。
2.2 HIV/HCV共同感染者中脂肪肝的相关因素分析 将102例HIV/HCV共同感染者分为脂肪肝组 (21例)和非脂肪肝组 (81例)。使用Logistic回归分析,首先进行单变量分析,与脂肪肝相关的变量包括:ALT(P=0.01)、TG(P=0.004)、HDL(P=0.02)和HAART持续时间 (P=0.007)。当前CD4细胞计数 (P=0.06)与脂肪肝的发生有潜在相关性,建议增加例数进一步观察。其他变量包括年龄、性别、HIV/HCV感染途径、BMI、T-BIL、BUN、Cr、TC、LDL、空腹血糖、HCV-RNA阳性率、HAART方案与脂肪肝的发生无相关性。
Logistic多变量分析的因素包括ALT、TG、HDL和HAART持续时间,结果显示高TG血症、低HDL血症和HAART持续时间与脂肪肝的发生相关 (P<0.05,见表2)。

表1 HIV/HCV共同感染者的临床特征Table1 Clinical characteristics of the studied HIV/HCV co-infected patients
3 讨论
本研究通过对102例HIV/HCV共同感染者进行分析,发现其中20.6%的患者存在脂肪肝。高燕等[9]对我国单纯性慢性丙型肝炎患者进行12~25年随访,发现7.4%的患者转变为脂肪肝;在进行HAART的艾滋病患者中,欧美人群脂肪肝的发生率为31%,非洲人群为13.3%;Mc Govern等[10]发现HIV/HCV共同感染者中,美国人群脂肪肝的发生率为69%;徐庆年等[11]研究显示,49例HIV/HCV共同感染者经HAART后,9例发生脂肪肝 (18.3%)。与本研究结果比较,欧美国家HIV/HCV共同感染者中脂肪肝的比例明显较高,除与不同人种遗传背景不同有关外,欧美人群常感染HCV-3,而HCV-3可导致肝脏脂肪变性。Gaslightwala等[12]报道HIV/HCV共同感染者脂肪肝的发生与高TG血症和低HDL血症有关,与本研究结论一致。
HCV直接促进肝细胞脂肪变性的发生和发展的机制还不甚明确。目前认为可能与HCV核心蛋白有关。在表达核心蛋白的转基因鼠模型及转染细胞中均发现进展性肝脂肪变性的存在。核心蛋白可能通过以下机制发挥作用:(1)核心蛋白能改变线粒体膜的脂质双层结构,从而破坏脂质的β氧化,导致脂质蓄积;(2)核心蛋白作用于微粒体的TG转运蛋白,使其活性下降,阻碍肝脏载脂蛋白B(apoB)分泌及极低密度脂蛋白 (VLDL)装配,致肝细胞脂肪变性。微粒体TG转运蛋白是1种限速酶,在VLDL的组装和分泌过程中具有重要作用,它的失活可能直接造成非分泌型TG的沉积,从而导致肝脂肪变性。
本研究发现HAART持续时间是HIV/HCV共同感染者脂肪肝发生的另外一个独立预测因素,而HAART药物及MBI与脂肪肝的发生无关。肝细胞脂质沉积是脂肪肝发病机制中的“第1次打击”,此后发生肝细胞的氧化应激,即“第2次打击”。肝细胞沉积脂质是脂质过氧化的底物,这可导致有害的氧自由基的形成,后者可直接损伤肝细胞;当氧自由基产生增加,而抗氧化产物如还原性谷胱甘肽减少,可导致氧化应激的发生。HIV感染者抑制了抗氧化产物的贮存,使得氧化应激的风险发生增加;当抗氧化产物耗竭,氧自由基可损伤线粒体DNA,同时使脂肪发生氧化,出现持续的脂质过氧化和肝细胞损伤。长期进行HAART尤其是使用核苷类反转录酶抑制剂可破坏线粒体DNA[13],增加肝损伤的易感性。因此,HAART持续时间是HIV/HCV共同感染者脂肪肝发生的一个独立预测因素。
在单变量回归分析中,ALT与脂肪肝的发生具有相关性,但多变量分析未发现这种相关性。Crum-Cianflone等[14]报道肝酶异常升高与艾滋病合并非酒精性脂肪肝相关;但Bedogni等[15]报道ALT及AST与美国艾滋病患者合并非酒精性脂肪肝也有相关性。本研究未发现ALT与HIV/HCV共同感染者脂肪肝的发生具有相关性。HIV感染者本身常出现肝酶异常升高[16],HAART药物如奈韦拉平可造成ALT升高;慢性丙型肝炎也可出现肝损害。因此,ALT水平升高在诊断脂肪肝时不具有特异性和敏感性,通过彩超或肝脏活检诊断脂肪肝更好。
另外,本研究并未发现HIV/HCV共同感染者的性别、HCV-RNA阳性比例、CD4细胞计数与脂肪肝的发生具有相关性。
综上所述,本组HIV/HCV共同感染者中脂肪肝的发生率为20.6%;高TG血症、低HDL血症和HAART治疗持续时间是脂肪肝发生的独立预测因素。
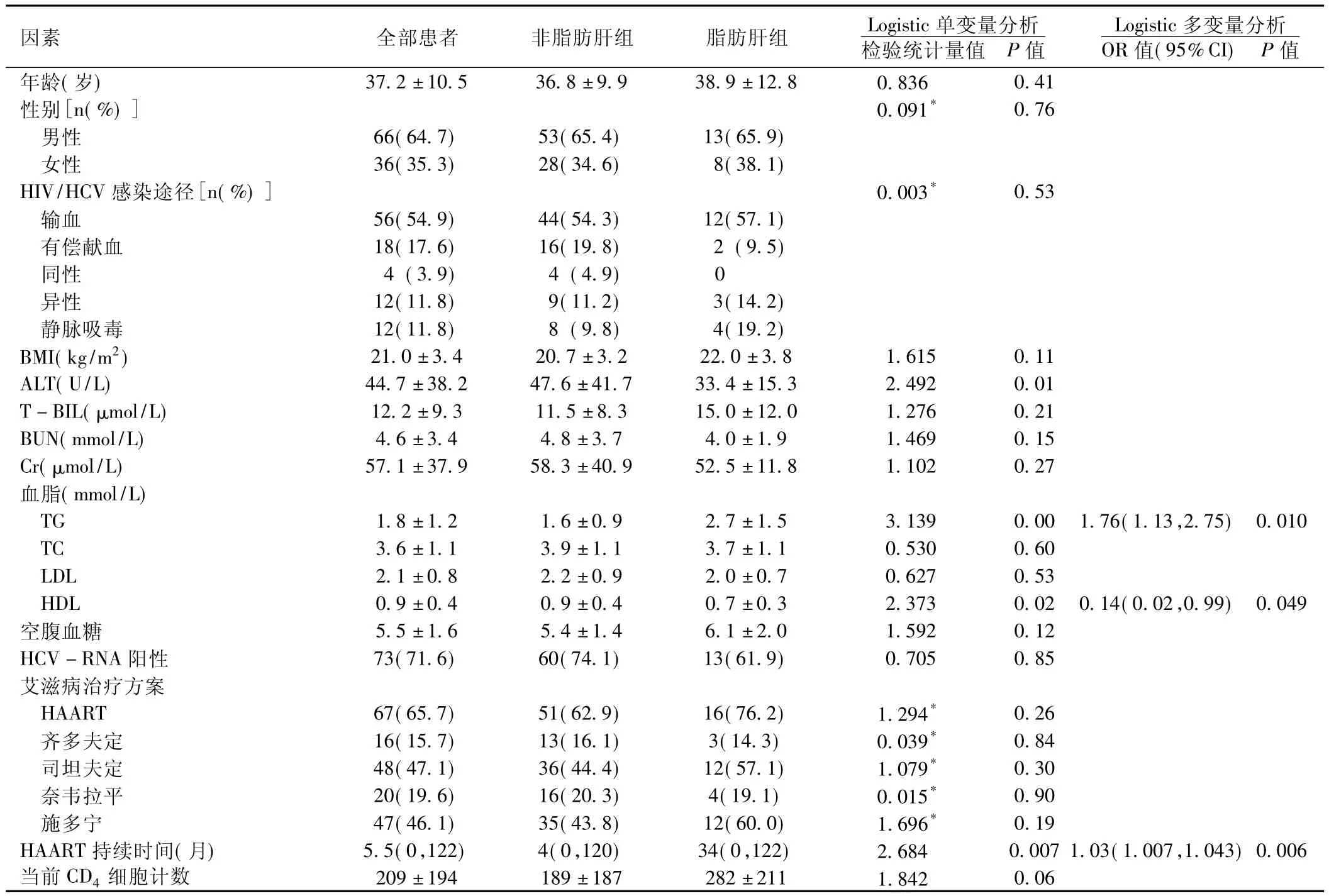
表2 HIV/HCV感染者中脂肪肝发生的独立危险因素分析Table2 Independent risk factors of hepatic steatosis in HIV/HCV co-infected patients
1 方大东,张德荣.通心络胶囊治疗脂肪肝64例临床观察[J].疑难病杂志,2007,6(5):272.
2 Sozio MS,Liangpunsakul S,Crabb D.The role of lipid metabolism in the pathogenesis of alcoholic and nonalcoholic hepatic steatosis[J].Semin Liver Dis,2010,30:378-390.
3 Halfon P,Pénaranda G,Carrat F,et al.Influence of insulin resistance on hepatic fibrosis and steatosis in hepatitis C virus(HCV)mono-infected compared with HIV-HCV co-infected patients[J].Aliment Pharmacol Ther,2009,30:61-70.
4 Sterling RK,Contos MJ,Smith PG,et al.Steatohepatitis:risk factors and impact on disease severity in human immunodeficiency virus/hepatitis C virus coinfection[J].Hepatology,2008,47:1118-1127.
5 中华医学会感染病学分会艾滋病学组.艾滋病诊疗指南[J].中华传染病杂志,2006,24(2):133-144.
6 中华医学会肝病学分会脂肪肝和酒精性肝病学组.丙型肝炎防治指南[J].中华肝脏病杂志,2004,12(4):194-198.
7 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161-163.
8 中国成人血脂防治指南制定联合委员会.中国成人血脂异常防治指南[J].中华心血管病杂志,2007,35(5):390-409.
9 高燕,田秀兰,王齐欣,等.283例慢性丙型肝炎患者感染者12至25年后肝脏超声检查变化的特点[J].中华实验和临床病毒学杂志,2004,18(1):31-34.
10 Mc Govern BH,Ditelberg JS,Taylor LE,et al.Hepatic steatosis is associated with fibrosis,nucleoside analogue use,and hepatitis C virus genotype 3 infection in HIV-seropositive patients[J].Clin Infect Dis,2006,43:365-372.
11 徐庆年,孙洪清,刘莉,等.高效联合抗反转录病毒治疗引起血脂异常和脂肪性肝病的临床研究[J].肝脏,2008,13(5):372-374.
12 Gaslightwala I,Bini EJ.Impact of human immunodeficiency virus infection on the prevalence and severity of steatosis in patients with chronic hepatitis C virus infection[J].J Hepatol,2006,44:1026-1032.
13 Lewis W,Day BJ,Copeland WC.Mitochondrial toxicity of NRTI antiviral drugs:an integrated cellular perspective[J].Nature Reviews,2003,2:812-822.
14 Crum-Cianflone N,Dilay A,Collins G,et al.Nonalcoholic fatty liver disease among HIV-infected persons[J].J Acquir Immune Defic Syndr,2009,50:464-473.
15 Bedogni G,Miglioli L,Masutti F,et al.Prevalence of and risk factors for nonalcoholic fatty liver disease:the Dionysos nutrition and liver study[J].Hepatology,2005,42:44-52.
16 Pol S,Lebray P,Vallet-Pichard A.HIV infection and hepatic enzyme abnormalities:intricacies of the pathogenic mechanisms[J].Clin Infect Dis,2004,38:S65-S72.

