金标记免疫共振散射光谱法测定牛初乳中免疫球蛋白G
刘梯楼,孙双姣
(邵阳医学高等专科学校,湖南 邵阳 422000)
牛初乳中免疫球蛋白G(immunoglobulin G,IgG)能够与病原微生物及毒素等抗原结合,形成抗体,同时促进哺乳动物新生幼仔自身免疫系统发育成熟,保护其免受病原侵袭。因此,IgG的含量是评价牛初乳制品品质的一个重要指标[1],它的测定在牛初乳产品检验中具有重要意义。牛初乳IgG含量主要检测方法有琼脂免疫单扩散法[2]、琼脂免疫双扩散法[3]、高效液相色谱法[4]、免疫比浊法[5],免疫共振散射法[6]等。其中,琼脂免疫单、双扩散法检测时间长、测定误差大、检测结果滞后;高效液相色谱仪器色谱要求较高;免疫比浊法灵敏度较低,检测限为70 μg/mL[5]。共振散射光谱分析具有灵敏度高和简便快速等特点[7-8],但由于免疫复合物具有一定的水溶性,共振散射强度较弱,直接利用免疫复合物微粒的共振散射来测定IgG,灵敏度只提高为1.1μg/mL[6]。 胶体金标记技术因具有简单、快速、准确、无污染等特点,已成为第四大免疫标记新技术[9]。已知金纳米微粒粒径较小时,共振散射强度较弱,当其粒径增大时,共振散射强度明显增大[10],但共振散射峰的位置不发生变化[11]。羊抗牛IgG与牛IgG的反应具有较高的选择性,生成的免疫复合物的共振散射较弱,直接来测定IgG的灵敏度较低。金溶胶的光散射与金颗粒的大小密切相关,一旦颗粒大小发生变化,光散射也随之发生变化[12]。在金标羊抗牛IgG体系中,羊抗牛IgG分子牢固地结合在金颗粒的表面,当牛IgG与羊抗牛IgG发生特异性反应后,适当粒径的金颗粒裸露出来,聚集形成了较大的金颗粒导致体系的共振散射增强。牛IgG在一定浓度范围内随着其浓度的增加,释放的金颗粒越多,金颗粒聚集的程度越强,共振散射强度线性增强,据此可建立IgG的免疫共振散射光谱分析法。本文将牛IgG抗体用金纳米标记后,在一定条件下IgG抗体与IgG发生免疫发应,导致金纳米发生聚集,通过测其580 nm处共振散射强度变化,可以间接地测定IgG的浓度,由于IgG的浓度是通过金纳米的共振散射间接表达出来的,所以极大地提高了检测的灵敏度。
1 材料与方法
1.1 材料
HAuCl4(国药集团化学试剂公司),牛IgG(上海午立生物技术公司),羊抗牛IgG(上海午立生物技术公司),Tris-HCl缓冲溶液,聚已二醇20000(PEG-20000),质量浓度分别为1.00%与10.00%的柠檬三钠和 KCl溶液,0.20 mol/L的K2CO3,0.10 mol/L的HCl,所用试剂均为分析纯,实验用水为二次蒸馏水。
RF-540型荧光分光光度计(日本岛津);79-1磁力加热搅拌器(江苏中大仪器厂);SK8200LH超声波反应器(上海科导超声仪器有限公司);H-600型透射电镜(日本电子株式会社)。
1.2 方法
1.2.1 胶体金标羊抗牛IgG的制备 (1)金溶胶的制备与鉴定。胶体金由柠檬酸钠改良法[13]制备,并用透射电镜进行表征。(2)羊抗牛IgG在标记前用透析袋放置在含0.005%NaCl的二次蒸馏水中透析30 h,以除去多余的电解质。(3)确定纳米金标记羊抗牛IgG的最佳pH值。利用共振散射方法试验了不同pH对于胶体金标记的影响:将胶体金调节至不同的pH值后各取1 mL加入25 μg羊抗牛IgG,混匀,放置5 min,加入0.1 mL 10%KCl,混匀后放置2 h,稀释至3 mL,测580 nm处的共振散射强度(仪器参数:低灵敏档,纵坐标为6)。(4)胶体金与待标羊抗牛IgG用量比的确定。分别取羊抗牛 IgG 5,10,15,20,25,30,35,40,45,50 μg 加到1 mL pH为8.5的胶体金溶液中,另取一管不加羊抗牛IgG为对照管,混匀,5 min后均加入0.1 mL10%KCl溶液,混匀后静置2 h,稀释至3 mL,取适量测定各管580 nm处的共振散射强度(仪器参数:低灵敏档,纵坐标为6)。(4)胶体金与待标羊抗牛IgG用量比的确定。分别取羊抗牛IgG 5,10,15,20,25,30,35,40,45,50 μg 加到 1 mL pH为8.5的胶体金溶液中,另取一管不加羊抗牛IgG为对照管,混匀,5 min后均加入0.1 mL 10%KCl溶液,混匀后静置2 h,稀释至3 mL,取适量测定各管580 nm处的共振散射强度(仪器参数:低灵敏档,纵坐标为6)。(5)金标记羊抗牛IgG的制备。用0.2 mol/L的K2CO3,0.1 mol/L的HCl和精密pH试纸将3.0 mg羊抗牛IgG溶液的pH值调至8.5;100 mL的胶体金溶液的pH值也调至8.5。在磁力搅拌下,将调好pH值的羊抗牛IgG溶液加入到100 mL的胶体金中,控制滴加时间为5 min,然后再加入1.75 mL 3%的PEG-20000作为稳定剂[12],搅拌15 min,放置4℃保存。
1.2.2 金标羊抗牛IgG免疫共振散射光谱法测定依次移取0.50 mL pH值为7.0的Tris-HCl缓冲溶液,0.3 mL的金标羊抗牛IgG溶液,一定量牛IgG溶液,0.50 mL 300 mg/mL PEG-20000于10 mL刻度试管中,用蒸馏水定容至3 mL,混匀,室温下在59KHZ超声波反应器中温浴25 min。取适量移入石英池中,置荧光分光光度计上,用低灵敏档,纵坐标为6,同步扫描激发波长λex和发射波长λem(λex=λem),得到体系的共振散射光谱,测定580 nm波长处的共振散射光强度IRS。不加牛IgG作空白,测其共振散射光强度(IRS)b,计算△I=IRS-(IRS)b。
1.2.3 样品及回收率的测定 设4个处理,处理1和处理2为牛初乳粉,处理3为牛初乳咀嚼片,处理4为牛初乳复合胶囊。准确称取各种牛初乳制品0.0100 g,用pH 7.0的 Tris-HCl缓冲液配制成0.100 mg/mL的样品溶液,摇匀。12000 r/min离心30 min,取上层清液,经0.45 μm微孔滤膜过滤后,取50 μL,按1.2.2方法进行样品测定。对4种含不同浓度的样品,分别加入IgG标准液后测定IgG的含量,并计算回收率。
2 结果与分析
2.1 胶体金标羊抗牛IgG的制备
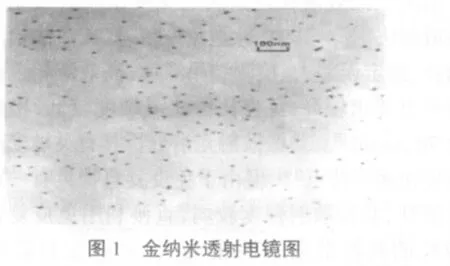
2.1.1 金溶胶的制备与鉴定 如图1所示,金纳米粒径均匀,平均大约为9 nm,且分散性好。
2.1.2 纳米金标记羊抗牛IgG的最佳pH值的确定 由表1可以看出,当pH值小于8.5时,所加的羊抗牛IgG不能稳定胶体金,加入KCl溶液后(因用柠檬酸纳改良法制备的胶体金加NaCl后不会发生聚集),金溶胶发生了聚集,共振散射强度较大;当pH值为8.5时,由于蛋白质包裹了胶体金。KCl溶液不能使被包裹的胶体金聚集,体系具有最小的共振散射强度。因此,实验选择将胶体金用0.2 mol/L的K2CO3,0.1 mol/L的HCl调节至pH值为8.5。

表1 不同pH值对于胶体金标记的影响
2.1.3 胶体金与待标羊抗牛IgG用量比的确定由表2可以看出,对照管和加入羊抗牛IgG的量为5~25 μg的各管共振散射强度较大,而加入羊抗牛IgG为30~50 μg的各管共振散射强度较小且维持稳定,因此,30 μg为稳定1 mL胶体金溶液的最低羊抗牛IgG用量,也就是金标记羊抗牛IgG的最低用量。选取30 μg为实际的羊抗牛IgG的用量,标记100 mL的金溶胶加入量为3.0 mg。
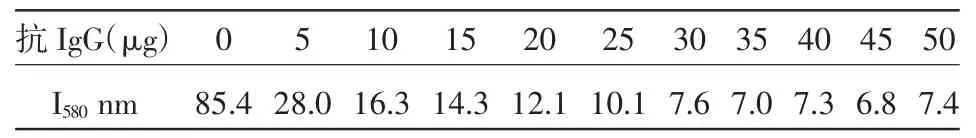
表2 不同羊抗牛IgG对于胶体金标记的影响
2.2 共振散射光谱
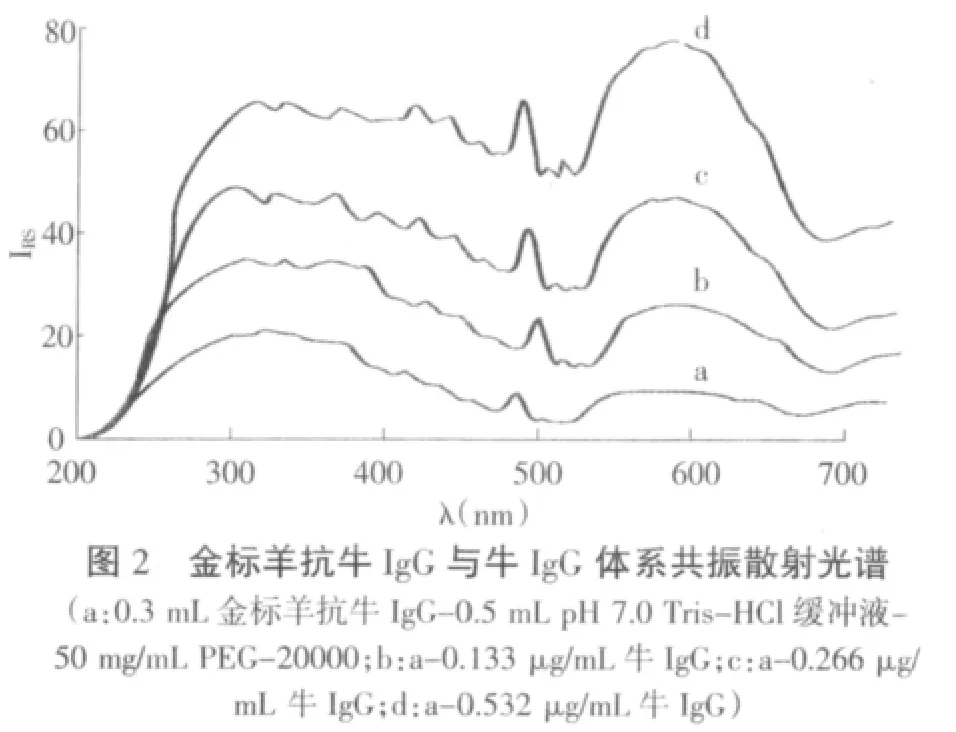
金标记羊抗牛IgG在340,470,580 nm处有3个共振散射峰(图2),但共振散射强度较弱,随着牛IgG的加入,共振散射强度逐渐加强,体系在580 nm处的共振散射峰增强尤为明显。实验选取波长为580 nm进行测定。
2.3 共振散射光谱法实验条件的优化
2.3.1 pH值、缓冲溶液种类及用量的选择 实验考察了体系pH(6~8.5)对△IRS的影响。研究表明,随着体系pH的增加,IRS、(IRS)b都增强。当pH值为7.0时,△IRS相对较大。实验选取pH值为7.0。用3种不同pH值为7.0的缓冲溶液(Tris-HCl,Na2HPO4-NaH2PO4,巴比妥钠-HCl)进行实验,结果表明,Tris-HCl缓冲溶液的灵敏度最高,Na2HPO4-NaH2PO4缓冲溶液的效果最差。本实验选取的缓冲溶液为Tris-HCl缓冲溶液。研究表明,当Tris-HCl缓冲溶液的用量为0.5 mL时,△IRS有最大值。本实验选取缓冲溶液的用量为0.5 mL。
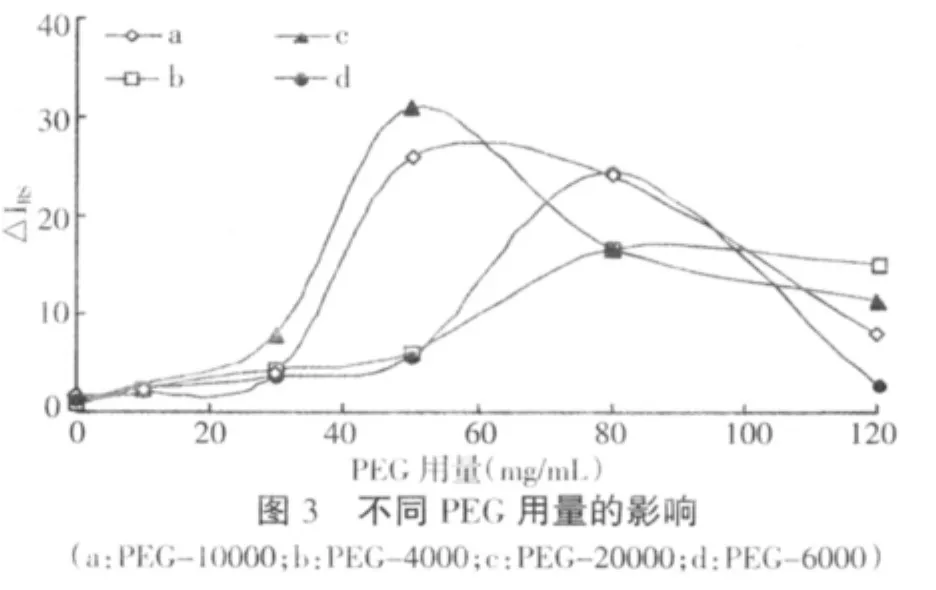
2.3.2 不同分子量聚乙二醇浓度的影响 聚乙二醇(PEG)用于免疫复合物的测定[14]。当胶体金的浓度较低时,较高浓度的PEG可以促使胶体金聚集,使胶体金的共振散射特征峰强度明显增强。研究了PEG-4000、PEG-6000、PEG-10000、PEG-20000 用量对于△IRS的影响,如图3所示(0.3 mL金标羊抗牛IgG-0.5 mLpH 7.0 Tris-HCl缓冲液-0.266 μg/mL牛IgG-PEG),几种PEG在一定程度上对△IRS具有增敏作用,其中PEG-20000的为50 mg/mL时,其△IRS具有最大值,故实验选取50 mg/mL的PEG-20000。
2.3.3 金标羊抗牛IgG用量的影响 考察了金标羊抗牛IgG用量对△IRS的影响,结果(图4)表明,当金标羊抗牛IgG用量为0.3 mL时,体系的△IRS最大,本文选取的金标羊抗牛IgG用量为0.3 mL。
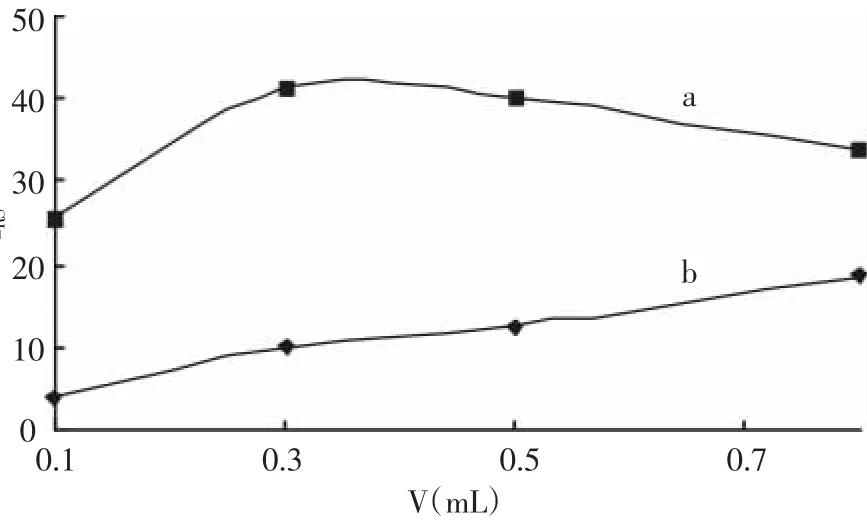
图4 金标羊抗牛IgG体积用量的影响
2.3.4 温度与时间的影响 在37℃水浴条件下,反应能较快地进行,明显地缩短反应时间,结果比较稳定。在室温(25℃)条件下,反应时间相对较长,且温度易受气候的影响,结果不太稳定。本实验选择了在37℃水浴条件下进行,考察了反应时间(0~60 min)对△IRS的影响。结果表明,当反应时间为25 min时,反应已进行完全,△IRS值趋于稳定,本实验选择反应时间为25 min.。
2.4 线性关系
在最佳实验条件下,分别取不同浓度牛IgG标准液,按1.2.2方法进行测定,并以其共振散射强度△IRS与牛IgG浓度ρ作图。牛IgG浓度在0.0133~1.33 μg/mL范围内与△IRS之间存在良好的线性关系。回归方程为△IRS=117.54 ρ+1.2293,相关系数为 0.9968,检出限为 0.00795 μg/mL。
2.5 共存物质的影响
免疫反应具有特异性,干扰其测定的物质较少。按1.2.2方法考察了一些蛋白质对测定0.266μg/mL牛IgG的影响。结果表明,当相对误差在5%的范围之内,200 μg/mL的人免疫球蛋白,500 μg/mL 的人血清白蛋白,200 μg/mL 的鼠 IgG,1200 μg/mL的牛血清白蛋白不干扰测定,由此可见,本法具有较高的选择性。
2.6 样品及回收率的测定
如表4所示,分别测定了4个样品中牛IgG的浓度,连续做5个平行样,样品溶液浓度的RSD的范围为:1.37%~2.30%,测定的重复性良好。
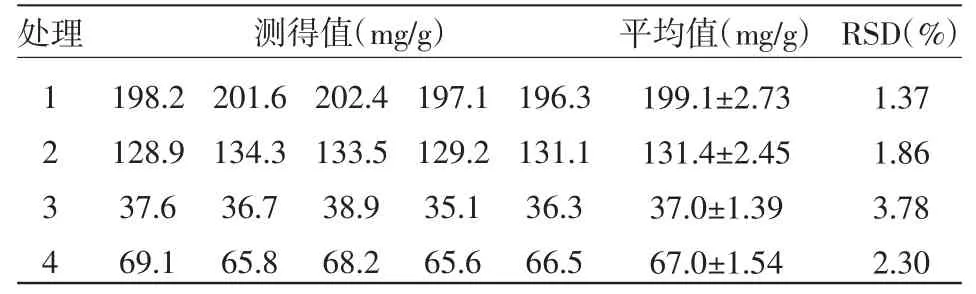
表4 样品分析
由表5可知,该方法测定IgG的回收率为98.03%~103.28%。
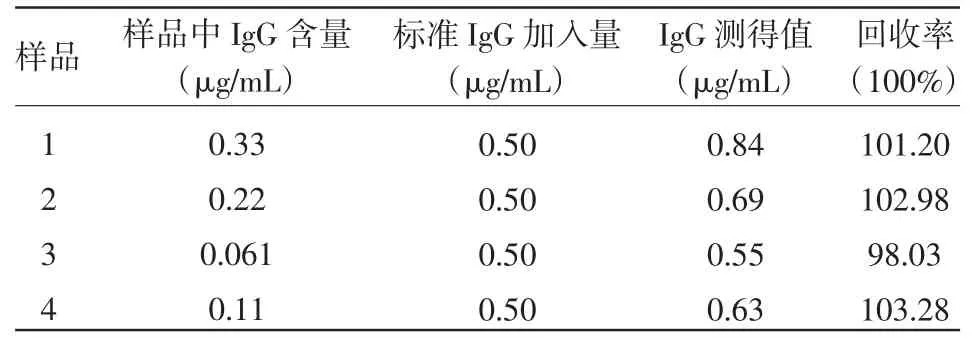
表5 回收率的测定
3 讨论与结论
液相金纳米微粒具有一系列特殊的物理化学性质,在生物探针、光谱分析和电化学分析中得到了应用。本研究将液相金纳米微粒的共振散射效应与免疫反应有机地结合起来,建立了一个测定牛初乳IgG的免疫共振散射光谱分析新方法。通过对4个样品的测定,方法的重现性好,回收率收率为98.03%~103.28%,由此可见,该法具有较高的灵敏度和选择性,可应用于试样分析。
[1]Korhonen H,Marnila P,Gill H S.Milk immunoglobulins and complementfactors[J].BrJNutr,2000,84(Suppl10):875-880.
[2]吴继尧,刘鹏龙,张丹风,等.琼脂双向免疫扩散法测定牛初乳中 IgG[J].新疆农业科学,2001,38(5):252-254.
[3]保健食品检验与评价技术规范[S].北京:中华人民共和国卫生部,2003.
[4]Bauer D R,Hudson B,Pecora R.Resonance enhance depolarizedrayleigh scattering from diphenylpolyenes[J].J Chem Phys,1975,63:588-591.
[5]姜瞻梅,吴 刚,王 静,等.免疫透射比浊法检测牛初乳Ig G的研究[J].食品科学,2008,29(3):298-300.
[6]唐 磊,王慎娇,史 莹,等.免疫共振散射法测定奶粉中牛IgG[J].现代预防医学,2009,26(16):3102-3103.
[7]Francois P,Bento M.,Vaudaux P,et al.Comparison of fluorescence and resonance light scattering for highly sensitive microarray detection of bacterial pathogend[J].J Microbio Meth,2003,55:755-762.
[8]Bao P,Frutos A G.,Greef C,et al.High-sensitivity detection of DNA hybridization on microarrays using resonance light scattering[J].Anal Chem,2002,74:1792-1797.
[9]袭著革.环境卫生纳米应用技术[M].北京:化学工业出版社,2004.
[10]Jiang Z L,Pan H C,Yuan W E.Change color effect and spectral properties of gold nanoparticle-cationic surfactants system[J].Chemical Research in Chinese Universities,2004,20 (5):523-528.
[11]蒋治良,冯忠伟,李廷盛,李 芳,等.金纳米粒子的共振散射技术[C].中国科学 B 辑,2001,31(2):183-188.
[12]Zhiliang J,Hongcheng P,Weien Y.Change color effect and spectral properties of gold nanoparticle-cationic surfactants system[J].Chemical Research in Chinese Universities,2004,20(5):523-527.
[13]沈 霞,李 稻.临床免疫学与免疫学检测新技术 [M].北京:人民军医出版社,2002.
[14]武建国.适用临床免疫学检验 [M].南京:江苏科学技术出版社,1990.

