一个产氢产乙酸菌互营共培养体的培养基优化
李建政,高晨晨,2,张立国,刘 崇,金 羽,张 岩
(1.哈尔滨工业大学市政环境工程学院城市水资源与水环境国家重点实验室,150090哈尔滨,ljz6677@163.com;2.国家城市给水排水工程技术研究中心,300074天津)
传统理论认为,产甲烷阶段是厌氧消化的限制步骤[1].然而,有研究表明,产氢产乙酸菌群的产氢产乙酸代谢对厌氧消化过程的限制作用要大于产甲烷菌群的产甲烷代谢[2-3],产氢产乙酸菌代谢活性的增强,有望使厌氧生物处理系统的效能得到显著提高[4-5].向厌氧生物处理系统中投加产氢产乙酸菌或产氢产乙酸互营共培养体则是达到这一目的的有效手段之一.产氢产乙酸菌对生长条件有较严格的要求,其纯培养物很难得到[6-7].比较而言,产氢产乙酸菌互营共培养体的筛选和培养则相对容易.然而,目前关于产氢产乙酸菌互营共培养体的研究报道还十分匮乏[8-11],如何有效地筛选和培养产氢产乙酸菌互营共培养体是需要解决的首要问题.在前期研究中[12],以处理高质量浓度有机废水的厌氧折流板反应器(ABR)中的活性污泥为样品,分离得到一种产氢产乙酸共培养体7-m-2a.本文从产氢产乙酸菌的生理生态习性入手,研究了7-m-2a在不同碳源、氮源及不同质量浓度泛酸、钙、铁、镁离子条件下的生长代谢状况,优化了培养基,为其扩大培养并从中分纯产氢产乙酸菌株奠定基础.
1 实验
1.1 菌种及其来源
研究采用的产乙酸互营共培养体7-m-2a,是以丙酸为底物的选择性培养基,从本实验室运行的ABR厌氧活性污泥中分离得到,对丙酸具有较强的降解和转化能力.该共培养体含有氧化丙酸的专性互营质子还原菌Desulfotomaculum sp.Iso-W2,其伴生菌是能利用甲酸盐和H2/CO2的Uncultured bacterium 054E12-B-DI-P58 和Sedimentibacter sp.JN18-A14-H.
1.2 培养基
其中,微量元素液(1 L):MnSO4·7H2O 0.01 g,ZnSO4·0.2 g,AlK(SO4)20.01 g;维生素液(1 L):钴氨素0.01 g,抗坏血酸 0.025 g,核黄素 0.025 g,柠檬酸0.02 g,吡多醛 0.05 g,叶酸 0.01 g,对氨基苯甲酸 0.01 g,肌酸 0.025 g,刃天青(0.2%)0.2 mL,半胱氨酸 1 g,pH 7.0.
丙酸质量浓度梯度培养基:基础培养基中的丙酸钠质量浓度为 2.5、5、10、15、20、25 g/L,其他成分不变.
酵母膏培养基:将基础培养基中的胰蛋白胨和NH4Cl去除,其他成分不变.胰蛋白胨培养基:将基础培养基中的酵母膏和NH4Cl去除,其他成分不变.胰蛋白胨-酵母膏培养基:将基础培养基中的酵母膏和胰蛋白胨质量浓度都调节为0.5 g/L,同时去除NH4Cl,其他成分不变.氯化铵培养基:去除基础培养基中的酵母膏和胰蛋白胨,其他成分不变.复合氮源培养基:将基础培养基中的胰蛋白胨、酵母膏和 NH4Cl用量均调节为0.33 g/L,其他成分不变.
铁离子培养基:向基础培养基中投加一定量的FeC12配制而成.培养基中的Fe2+质量浓度,根据研究需要分别调节为 44、66、88、110和132 mg/L.无钙培养基:将基础培养基中的CaCl2去除,其他成分不变.镁离子培养基:向基础培养基中投加一定量的MgCl2配制而成,培养基中的Mg2+质量浓度,根据研究需要分别调节为13、25、38、50和63 mg/L.泛酸培养基:向基础培养基中投加一定量的泛酸,根据研究需要,将其质量浓度分别调节为10、20、30、40 和 50 mg/L.
1.3 静态实验方法
取容积为25 mL的厌氧管,注入10 mL的液体培养基,充氮脱氧,封盖,灭菌;在超净工作台(SW-CJ-1G,苏州净化设备有限公司)上,用无菌注射器取7-m-2a菌悬液(OD600nm为0.8左右)3 mL接种;置于恒温培养箱(PYX-DHS,上海博讯实业有限公司医疗设备厂)中38℃培养30 d.每个培养条件均采用3只厌氧管进行平行试验.
1.4 分析项目与方法
pH采用PHS-25型酸度计测定.发酵气产量采用注射器释放并剂量,液相末端产物和发酵气成分采用气相色谱仪检测[4].菌悬液细胞密度采用UV2300型分光光度计(上海天美科学仪器有限公司),以未接种的培养液作为空白对照,于波长600 nm处测定吸光度(OD).反应混合液的OD值用于反映菌体的增殖情况.
1.5 数据处理方法
生长代谢指标乙酸产量、氢气产量、丙酸降解速率以及OD600nm均取3个平行测试的平均值,其标准偏差采用excel软件中的STDEV函数计算.
其中,乙酸产量、氢气产量和OD600nm均为培养30 d后的检测值减去初始时刻的检测值,而丙酸降解速率则以丙酸累积消耗量除以培养时间30 d而获得.
2 结果与讨论
2.1 丙酸质量浓度对7-m-2a菌群生长代谢的影响
调节基础培养基中的丙酸钠质量浓度为2.5、5、10、15、20、25 g/L,分别对产氢产乙酸菌互营共培养体7-m-2a进行30 d的培养.结果(表1)显示,培养基中丙酸的质量浓度对7-m-2a的生长代谢有比较明显的影响.在丙酸钠质量浓度小于10 g/L时,7-m-2a菌群的生长代谢水平随着丙酸钠质量浓度的升高而呈现上升趋势,并在丙酸钠质量浓度为10 g/L时达到最高,其丙酸降解率和OD值分别为786 mg/(L·d)和1.6,乙酸和氢气产量分别为2 749 mg/L和249 mL/L.当丙酸钠质量浓度增加到10 g/L以上的水平时,7-m-2a菌群的生长代谢则呈现下降趋势.因此,对于菌群7-m-2a的培养,采用10 g/L的丙酸钠质量浓度是比较适宜的.
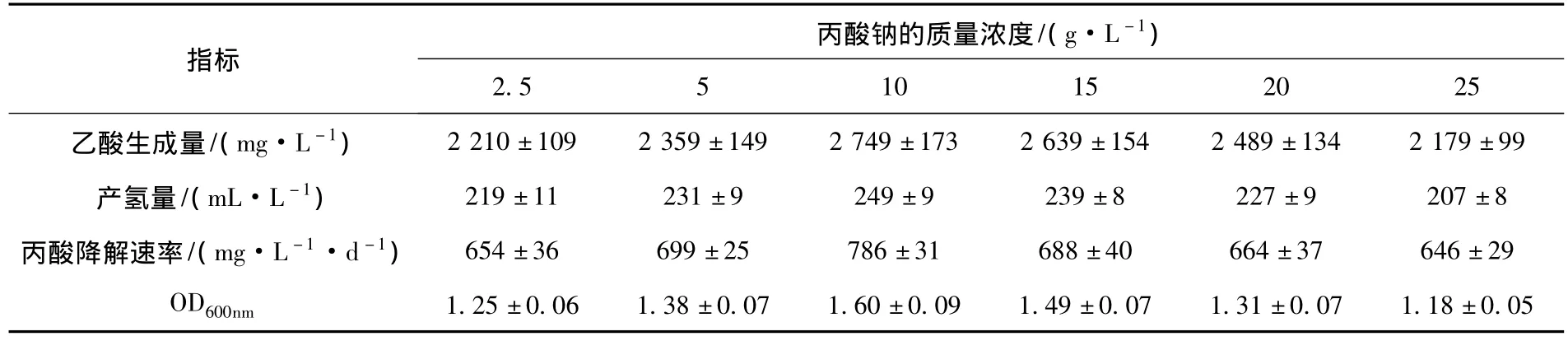
表1 丙酸质量浓度对7-m-2a生长代谢的影响
2.2 氮源对7-m-2a菌群生长代谢的影响
氮是细菌生长代谢所必须的大量元素.对于特定的微生物,其对不同氮源的利用效率存在显著差异.为寻求培养7-m-2a菌群的最佳氮源,在基础培养基的基础上,分别探讨了氯化铵、酵母膏、胰蛋白胨、胰蛋白胨-酵母膏、胰蛋白胨-氯化铵、胰蛋白胨-酵母膏-氯化铵等单一氮源和复合氮源对7-m-2a菌群生长代谢的影响,结果如表2所示.研究表明,以胰蛋白胨、酵母膏和氯化铵调配成的混合氮源对7-m-2a菌群的生长代谢最为有利,经过30 d的培养,丙酸降解速率、菌群增殖量(OD600nm)、乙酸和氢气产量分别达到 870 mg/(L·d)、1.21、3 802 mg/L 和245 mL/L.而以酵母膏为唯一氮源时,7-m-2a的生长代谢最不理想,培养结束时,其丙酸降解率、OD600nm、乙酸和氢气产量分别为862 mg/(L·d)、0.83、3 504 mg/L 和 230 mL/L.
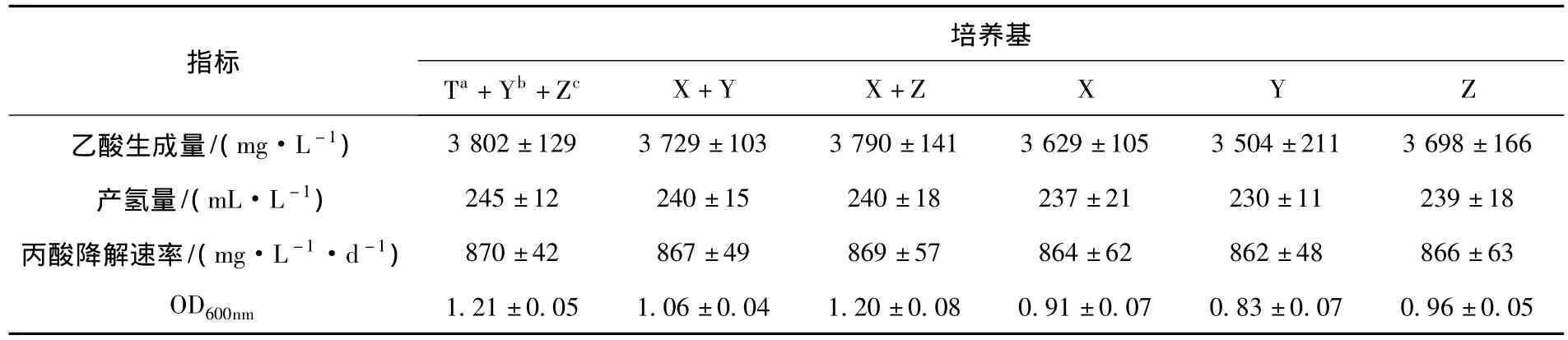
表2 氮源对7-m-2a菌群生长代谢的影响
2.3 Fe2+对7-m-2a菌群生长代谢的影响
许多氧化还原酶中都有铁离子,它们作为酶的辅因子起着电子传递的功能.采用向基础培养基中加入不同质量浓度 FeCl2的方式,探讨了Fe2+对7-m-2a菌群生长代谢的影响.
结果(表3)表明,Fe2+对7-m-2a菌群的生长代谢具有显著影响.培养基中Fe2+质量浓度在44~88 mg/L时,菌群7-m-2a的生长状况和产氢产乙酸能力随着Fe2+质量浓度的增加而呈现上升趋势,并在Fe2+质量浓度为88 mg/L时表现出最佳的生长代谢能力,在此条件下经30 d的培养,其丙酸降解速率、OD600nm、乙酸和氢气产量分别达1 019 mg/(L·d)、2.2、3 909 mg/L 和 266 mL/L.而当培养基中的Fe2+质量浓度继续增加时,7-m-2a的生长代谢则表现出了下降趋势,说明过量的Fe2+会对菌群的生长产生抑制作用.分析认为,Fe2+促进7-m-2a菌群生长代谢的主要原因可能在于其参与了铁氧还原蛋白的合成,而铁氧还原蛋白是微生物产氢代谢的重要辅酶.Fe2+可以形成Fe-S原子簇为产氢反应提供电子,并激活氢酶,Fe2+的缺少可导致细菌甲酸裂解酶合成不足,进而抑制了产氢产乙酸代谢[13].
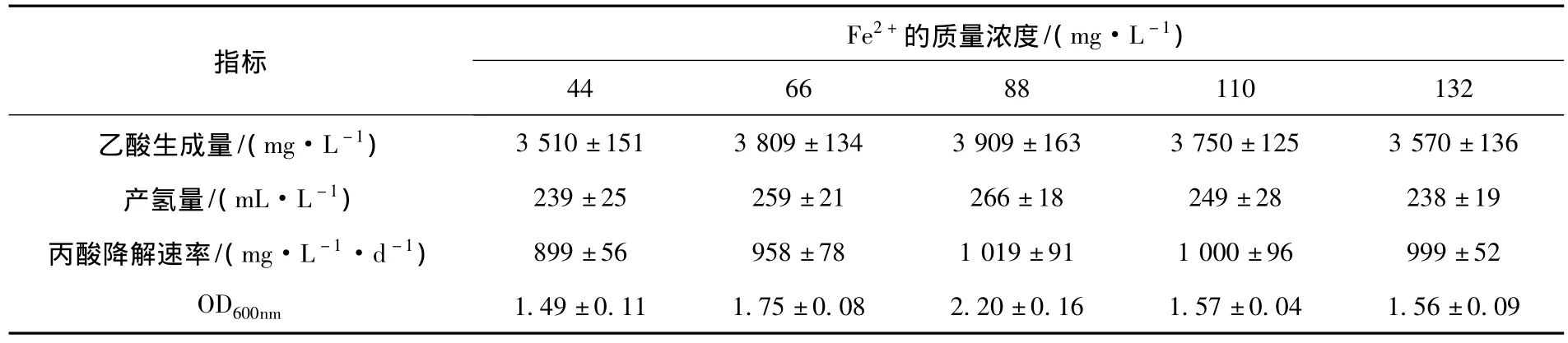
表3 Fe2+对7-m-2a菌群生长代谢的影响
2.4 Ca2+对7-m-2a菌群生长代谢的影响
如表4所示,培养基中Ca2+的有无对7-m-2a菌群的增殖影响并不显著,但在添加1 g/L CaCl2的培养基中,7-m-2a菌群的产氢产乙酸代谢能力明显高于不含Ca2+的培养基.在含Ca2+培养基中经30 d的培养,其乙酸生成量和产氢量分别为3 391 mg/L和259 mL/L,丙酸的平均降解速率为889 mg/(L·d);而在无Ca2+的培养基中,其乙酸生成量和产氢量分别为3 110 mg/L和243 mL/L,丙酸的平均降解速率为858 mg/(L·d).显微镜观察发现,CaCl2在液体培养基中大多以结晶颗粒的形式存在,绝大多数菌体则聚集在这些颗粒表面,以游离状态存在的菌体数量很少.对于这一现象需要给予辩证分析:培养基中添加适量的Ca2+,对于产氢产乙酸菌互营共培养体的培养是有利的,而要从中分离和纯化产氢产乙酸菌,Ca2+的添加则是一个不利因素.

表4 Ca2+对7-m-2a菌群生长代谢的影响
2.5 Mg2+对7-m-2a菌群生长代谢的影响
Mg2+是微生物生长的必要物质,是许多酶的激活剂,因而添加适量的Mg2+可能会对产氢产乙酸菌活性的提高具有重要作用[14].通过向基础培养基中添加不同剂量的MgC12,考察了Mg2+质量浓度对7-m-2a菌群生长代谢的影响.
结果(表5)表明,较低的Mg2+质量浓度对7-m-2a菌群的生长和产氢产乙酸代谢具有刺激作用,而Mg2+质量浓度较高时则表现为一定程度的限制作用.在13~63 mg/L的质量浓度范围内,7-m-2a菌群在 Mg2+质量浓度为38 mg/L时表现出了较高的生长和代谢活性,在培养30 d后,其丙酸降解速率、OD600nm、乙酸和氢气产量分别为 908 mg/(L·d)、1.58、2 939 mg/L和 291 mL/L.

表5 Mg2+对7-m-2a菌群生长代谢的影响
2.6 泛酸对7-m-2a菌群生长代谢的影响
泛酸在微生物体内主要以辅酶(CoA)的形式参与糖、脂类、蛋白质的代谢,CoA有转移酰基的重要作用,泛酸缺乏时,过氧化物酶系的脂肪酸β-氧化就会受到抑制,从而进一步影响到产氢产乙酸菌的生长代谢.因而,在培养基中适量添加泛酸,将有助于提高产氢产乙酸菌的代谢活性.实验结果(表6)表明,低剂量的泛酸对7-m-2a菌群的生长代谢具有刺激作用.在质量浓度为10~50 mg/L的范围内,7-m-2a菌群在泛酸质量浓度为30 mg/L时所表现出的生长代谢活性最高,经过30 d的培养,其丙酸降解速率、OD、乙酸和氢气产量分别为910 mg/(L·d)、1.99、3 779 mg/L和250 mL/L.而当泛酸质量浓度大于或小于30 mg/L时,7-m-2a菌群生长代谢水平均有不同程度的降低.
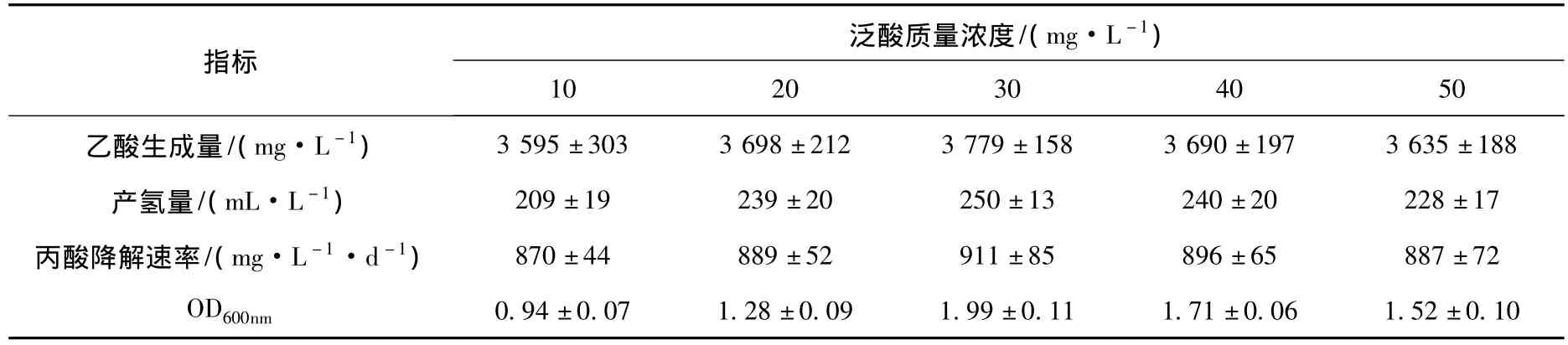
表6 泛酸对7-m-2a菌群生长代谢的影响
2.7 各项最优指标对7-m-2a菌群的综合影响
根据2.1至2.6的实验结果,对产氢产乙酸菌互营共培养体7-m-2a的基础培养基进行优化,即将其中的丙酸钠、Fe2+和Mg2+的质量浓度分别调整为10、88和38 mg/L,以胰蛋白胨、酵母膏和氯化铵为混合氮源(分别为0.33 g/L),同时添加30 mg/L的泛酸,调节培养基pH为7.采用优化后的培养基,在38℃下培养30 d,7-m-2a菌群对丙酸的降解速率为998 mg/(L·d),乙酸生成量达3 947 mg/L,产氢量为295 mL/L,反应混合液的OD600nm达2.96.与各单因子的实验结果(表1~6)比较可见,在优化条件下,7-m-2a菌群对丙酸的降解速率、乙酸生成量、产氢量以及菌体增殖量(OD600nm)要优于丙酸质量浓度、氮源、Mg2+和泛酸等单因子条件下的培养结果.以Fe2+为单影响因素的培养实验中(表3),获得了1 019 mg/(L·d)的丙酸降解速率,这一结果高于优化条件下的998 mg/(L·d),但诸如乙酸生成量、氢气生成量以及菌体增殖情况等均不如在优化条件下的培养效果好.总体而言,经优化后的培养基比较适宜7-m-2a菌群的生长代谢.
3 结论
1)对于产氢产乙酸菌互营共培养体7-m-2a的培养,培养基中适量添加 Fe2+、Mg2+、Ca2+和泛酸可有效提高菌群的代谢活性.优化后培养基成分为,酵母膏 0.33 g,胰蛋白胨 0.33 g,微量元素液 10 mL,维生素液10 mL(添加泛酸 30 mg/L),1 000 mL,pH 7.0,培养温度采用38℃.
2)在优化培养基中38℃培养30 d,产氢产乙酸菌互营共培养体7-m-2a对丙酸的降解速率可达 998mg/(L·d),乙酸生成量为3 947 mg/L,产氢量为295 mL/L,反应混合液的OD600nm达 2.96.
[1]TABATABAEI M,RAHIM R A,ABDULLAH N.Importance of the methanogenic archaea populations in anaerobic wastewater treatments[J].Process Biochemistry,2010,45(8):1214 -1225.
[2]NIE Y Q,LIU H.Acetate production by a coupled syntrophic acetogenesis with homoacetogenesisprocess:effect of sludge inoculum concentration[J].Environmental Technology,2009,30(2):141-150.
[3]LANGE M,AHRING B K.A comprehensive study into themolecularmethodologyand molecularbiologyof methanogenic Archaea[J].FEMS Microbiolgy Reviews,2001,5(12):553 -571.
[4]ZHU G F,LI J Z,WU P,et al.The performance and phase separated characteristics of an anaerobic baffled reactor treating soybean protein processing wastewater[J].Bioresource Technology,2008,99:8027 -8033.
[5]鲍立新,李建政,昌盛,等.ABR处理大豆蛋白废水的效能及微生物群落动态分[J].环境科学,2008,29(8):2206-2213.
[6]李艳娜,许科伟,陈坚,等.厌氧生镜体系中产氢产乙酸细菌的FISH定量解析[J].微生物学报,2007,47(6):1038-1043.
[7]ELSHAHED M S,MCINERNEY M J.Benzoate fermentation by the anaerobic bacterium syntrophus aciditrophicus in the absence of hydrogen—using microorganisms[J].Applied and Environmental Microbiology,2001,67(12):5520-5525.
[8]LI J Z,ZHENG G C,HE J G,et al.Hydrogen—producing capability of anaerobic activated sludge in three types of fermentations in a continuous stirred-tank reactor[J].Biotechnology Advances,2009,27(1):573-577.
[9]赵宇华,钱泽澍.硬脂酸降解菌与嗜氢产甲烷杆菌共培养物的研究[J].浙江农业大学报,1991,17(1):75-79.
[10]SIEBER J R,SIMS D R,HAN C,et al.The genome of Syntrophomonas wolfei:new insights into syntrophic metabolism and biohydrogen production[J].Environmental Microbiology,2010,12(8):2289 -2301.
[11]SOUSA D Z,SMIDT H,ALVES M M,et al.Ecophysiology of syntrophic communities that degrade saturated and unsaturated long - chain fatty acids[J].Fems Microbiology Ecology,2009,68(3):257 -272.
[12]李建政,孙倩,刘枫,等.一株产氢产乙酸菌互营共培养体的筛选及其群落结构解析[J].科技导报,2009,27(16):78-82.
[13]闵航.厌氧微生物[M].浙江:浙江大学出版社,1992:104-106.
[14]林明,任南琪,王爱杰,等.几种金属离子对高效产氢细菌产氢能力的促进作用[J].哈尔滨工业大学学报,2003,35(2):147-150.
——水溶性维生素泛酸篇

