旱伞草与粉绿狐尾藻立体复合的抑藻效能
秦松岩,吴 波,闫颖怡,周金喜,周启星
(1.天津理工大学环境科学与安全工程学院,300384 天津,qinsongyan@yahoo.com.cn;2.南开大学环境科学与工程学院,300191 天津;3.西门子(天津)水技术工程有限公司,300191 天津)
旱伞草与粉绿狐尾藻立体复合的抑藻效能
秦松岩1,2,吴 波3,闫颖怡1,周金喜1,周启星2
(1.天津理工大学环境科学与安全工程学院,300384 天津,qinsongyan@yahoo.com.cn;2.南开大学环境科学与工程学院,300191 天津;3.西门子(天津)水技术工程有限公司,300191 天津)
为考察植物间组合的化感抑藻效能,将旱伞草、粉绿狐尾藻、旱伞草+粉绿狐尾藻在自然水体水样中对比种植,对藻密度、叶绿素a、群落变化及有机物组成进行监测.结果表明:旱伞草+粉绿狐尾藻水样中,藻类建群过程的延迟期最短,在第13天达到峰值2.4×107/L,而对照、旱伞草、粉绿狐尾藻水样为4.48、1.15、2.03×108/L;旱伞草+粉绿狐尾藻水样中群落的演替速度最快,有机物种类最少为75种,而对照、旱伞草、粉绿狐尾藻水样有机物种类数量为131、90及121种.旱伞草+羽毛组合水样中新生成丙酮氰醇、磷酸三乙酯、莰烯及4-甲基苯酚这4种物质,可能为潜在的化感物质.
旱伞草;粉绿狐尾藻;化感物质;抑藻效能
利用水生植物简单、高效、低代价的特点对富营养化水体进行修复已被国内外广为共识[1].水生植物净化水体时主要形成漂浮、挺水及沉水3大植物系统[2].挺水植物可高效吸收水体中氮磷类营养物质;飘浮植物可遮蔽水体中的光透过率,通过影响藻类的光合作用来抑制藻类生长;沉水植物则可向水体中分泌抑藻化感物质[3-6].目前,对3大植物系统单独应用于富营养化水体的修复已有广泛研究,如孙瑞莲等[7]比较了8种挺水植物对污染水体的脱氮除磷效果;田琦等[8]研究了5种沉水植物对富营养化水体的净化力;李修岭等[9]利用漂浮水生植物对超富营养化湖水的总氮总磷去除能力及抑藻效果进行研究.对3大植物系统应用于富营养化水体的修复研究多着重于从某一植物系统中选择最适合特定水体的模式植物,而将漂浮、挺水及沉水植物进行交叉形成空间立体层次的植物组合并应用于富营养化水体的修复却鲜有研究.
旱伞草(Cyperus alternifolius)是较为常见的水生观赏植物,近年来在园林水景工程中应用广泛,适应性强,性喜温暖,在南方无霜期地区可栽植[10].粉绿狐尾藻(Myriophyllum aquaticum)是多年生沉水草本植物,适应生境能力强,其生长发育过程可去除多种污染物且观赏效果较好,是水体富营养化植物修复或水华生物控制工程中的有效物种,近年来被广泛应用于污染水体的生态修复[11].这两种植物已被单独应用于富营养化水体的修复,尤其是粉绿狐尾藻被证实具有强烈的化感抑藻(铜绿微囊藻)效果,但关于这两种植物共同栽植对富营养化水体的作用效应还未见报导.旱伞草-粉绿狐尾藻的立体组合充分利用了水体空间,且旱伞草的伞状茎叶保障了粉绿狐尾藻对水中光的需求.本文研究了旱伞草-粉绿狐尾藻的立体组合生态效应,即该立体组合是否对富营养化水体中的藻类数量、种类及群落结构产生影响;同时通过研究水中有机物组成变化,确定该组合是否能促进水体中有机物的降解和吸收,及能否产生潜在的化感抑藻物质.以期为南方富营养化淡水生态系统的恢复提供新的植物联合应用途径.
1 实验
1.1 实验材料
旱伞草及粉绿狐尾藻取自合肥环城公园,实验开始前24 h将受试植物浸于清水中,清除植物上残存的藻类,并摘掉植物上枯萎的茎叶.水样取自合肥环城水系,将受试植物与含藻水共培于2 000 mL大烧杯中.取一杯无植物作为对照组,模拟植物遮光量,按其他植物加入量投入塑料植物.粉绿狐尾藻按平均5 g/L,旱伞草按平均12.5~15 g/L,共同种植入水样中并置于光照培养箱内,恒温培养,温度为(25士1)℃,12 h光照(光强度为2 500 1x).实验共4组,为对照、旱伞草、粉绿狐尾藻、粉绿狐尾藻+旱伞草藻植共生组.为防止水分蒸发造成的水位降低,定期用再生水(合肥环城水系补水)补足烧杯内因蒸发而失去的水分,使试验用水体积保持在2 L.
1.2 藻类鉴定与计数
取水样之前,先将受试植物取出,然后用玻璃棒将水样搅拌,使藻类在水中分布均匀,迅速取出100 mL水样用于藻类鉴定、计数及叶绿素的测定.
藻种鉴定参考文献[12],分类法鉴定到种或属;并按种类计数,计算出藻类的相对丰度、藻细胞密度与多样性指数.
1.3 有机物组成分析
将对照、旱伞草、粉绿狐尾藻及粉绿狐尾藻+旱伞草的种植水样1 L用H2SO4调节pH=2,分别用50 mL二氯甲烷萃取两次,用旋转蒸发仪将100 mL二氯甲烷浓缩到大约5 mL,然后用氮吹浓缩到0.1 mL.
GC-MS分析仪采用安捷伦6890GC-5973MSD,色谱柱采用HP-5MS毛细柱(30 m*0.25 mm*0.25 μm),进样温度280 ℃,接口温度280℃,采取程序升温的方法,45℃(3 min)由10℃/min升至200℃(10 min),再由25℃/min升至 310℃(10 min),载气为 He,恒定流速1 mL/min,采用电子轰击源(EI),离子源温度230℃,四极杆温度150℃,离子化能量70 eV,质量扫描范围:全扫描,扫描m/z范围15~750.
2 结果与讨论
2.1 浮游藻类生物量变化
各种植水样中浮游藻类的叶绿素a和藻类密度的变化见图1.
图1(a)为对照组的叶绿素a和藻类生物量变化图;在培养初期,因无外来因素干扰,生物量稳定增长,所用的时间为9 d.接着进入指数生长阶段,生物量在一段时间内快速增加,在建群的第13天左右,生物量达到第一个峰值,BP(peak biomass)=2.14×108/L,其中生物量达到峰值所需的时间(time to peak biomass,tPB)是13 d.群落在经过短暂的成熟稳定期(第13~17天)后,群落未迅速衰退,而后进入了二次生长期,最终藻密度达到4.48×108/L.
图1(b)显示了旱伞草种植水样中叶绿素a和藻类生物量的变化.与对照组相比,建群延迟期较短,为5 d左右;之后进入指数生长期,并在第13天出现峰值,BP=1.15×108/L.峰值之后,藻类迅速衰退,生物量呈下降趋势.在17 d后,藻类群落进入二次生长期,但最终藻密度降至6.12×107/L.
从图1(c)可见,粉绿狐尾藻种植水样中,经历短暂的藻类群落建群延迟期后,生物量迅速增加,但生物量达到峰值时间较长,为17 d,BP=2.03×108/L,指数生长期后直接进入衰亡期,群落逐渐衰退,生物量减少,藻类密度也随之下降.
而粉绿狐尾藻+旱伞草种植水样中藻类建群延迟期很短,几乎直接进入指数生长期,生物量增长较快,但数值均小于其他水样中的藻类密度值,可见这两种植物复合对藻类有良好的抑制作用.其中BP=2.4 ×107/L,tPB=13 d.峰值之后,在13~17 d时,水样中的藻类群落进入衰亡期,生物量呈下降的趋势.在17 d后,藻类群落略有增长,但最终藻密度值仅为2.65×107/L(见图1(d)).
藻类生物量与叶绿素之间具有较好的相关性,藻类生物量变化的趋势与叶绿素a质量浓度变化基本一致.对照水样及粉绿狐尾藻种植水样中,叶绿素质量浓度最终达1 200 mg/L左右,而粉绿狐尾藻+旱伞草种植水样中叶绿素质量浓度仅为230 mg/L.
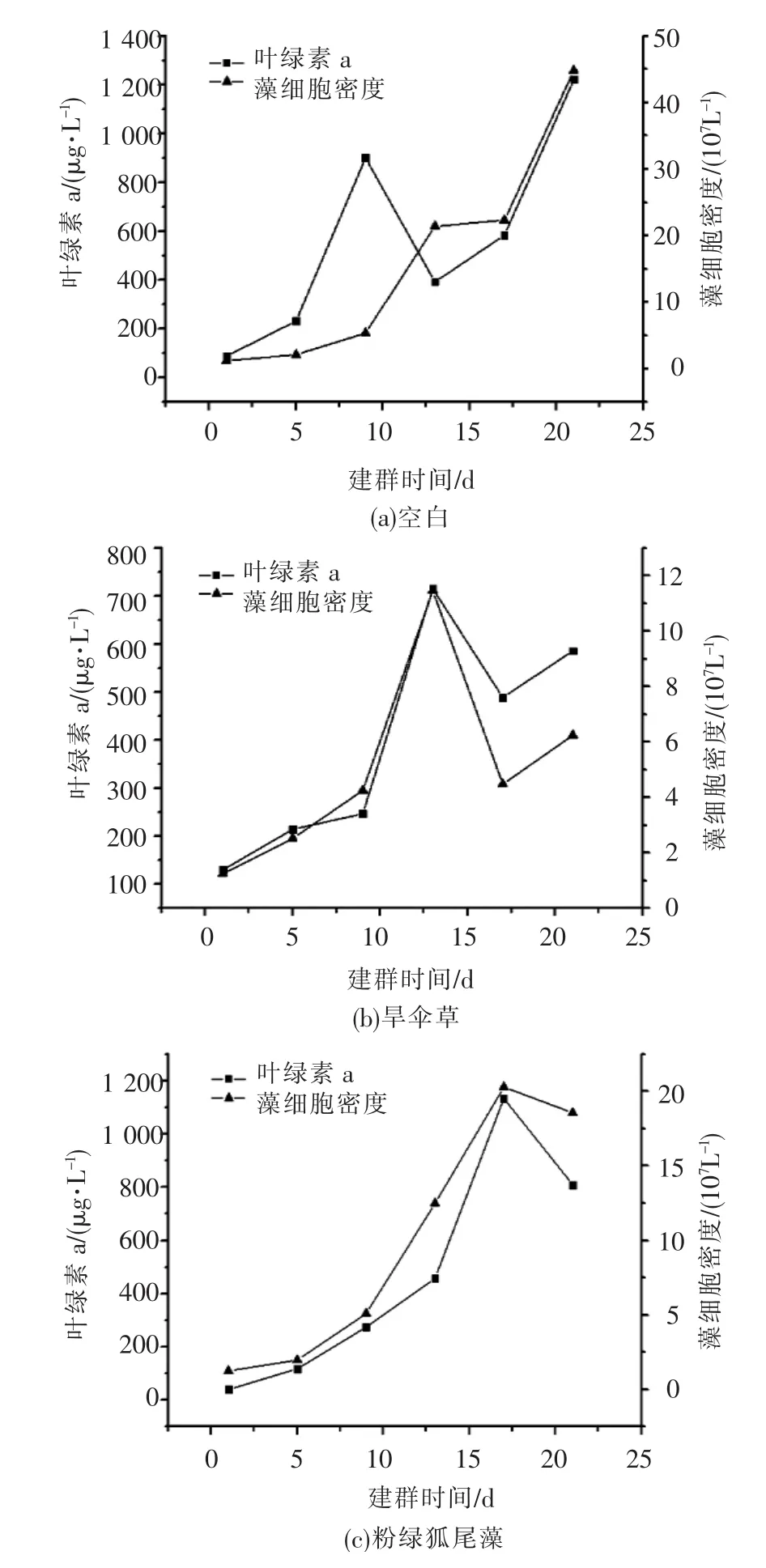

图1 各种植水样中浮游藻类的叶绿素a和藻类密度的变化
2.2 浮游藻类群落的组成变化
本实验开始前,对合肥环城水系水体中浮游藻类的鉴定及定量分析发现了多种浮游藻类,如绿藻门 的Scenedesmusdenticulatus、S.quadricauda(Scenedesmus quadricauda)、Pediastrum boryanum、G.paucispina(Golenkinia paucispina)、Chlorella和丝状的Ulothrix implexa Ktltz;硅藻门的Navicula,均为建群早期的先锋种类.
经植物种植作用后,浮游藻类群落发生变化,G.paucispina一直保持优势地位,S.quadricauda逐渐成为各水样中的优势种,但相对丰度差别较大(见图2).
在无植物作用的对照水样中,建群初期共20种浮游藻类,随着群落的发展,G.paucispina作为先锋藻类的相对丰富度逐渐降低,S.quadricauda逐渐演化成为优势种并在第13天达到峰值,相对丰富度高达46.5%,且在4个水样中,这两种藻类生物量最高(见图2(a)).相比之下,旱伞草作用的水样中,S.quadricauda和G.paucispina从17种藻类中缓慢演化成优势种并在第13天生物量达到峰值,相对丰富度分别为17.32%及61.17%(见图2(b)).而在粉绿狐尾藻 种 植 水 样,G.paucispina、Navicula和S.quadricauda这3种藻密度呈上升的趋势,逐渐成为该实验组中的优势种,S.quadricauda与Navicula的藻密度持续缓慢增长(见图2(c)).在旱伞草+粉绿狐尾藻作用水样的建群初期,浮游藻类即减少到12种,由于旱伞草+粉绿狐尾藻复合分泌出的化感物质的积累,G.paucispina的生物量在建群早期短时间的升高之后迅速衰退,S.quadricauda的藻密度虽持续增加,但却比其他3个水样少一个数量级;而4个实验组中,只有该实验组藻密度增长与藻类相对丰度的变化趋势相一致,说明该组藻类生物量增长较少,且其他藻类所占比例较小(见图2(d)).
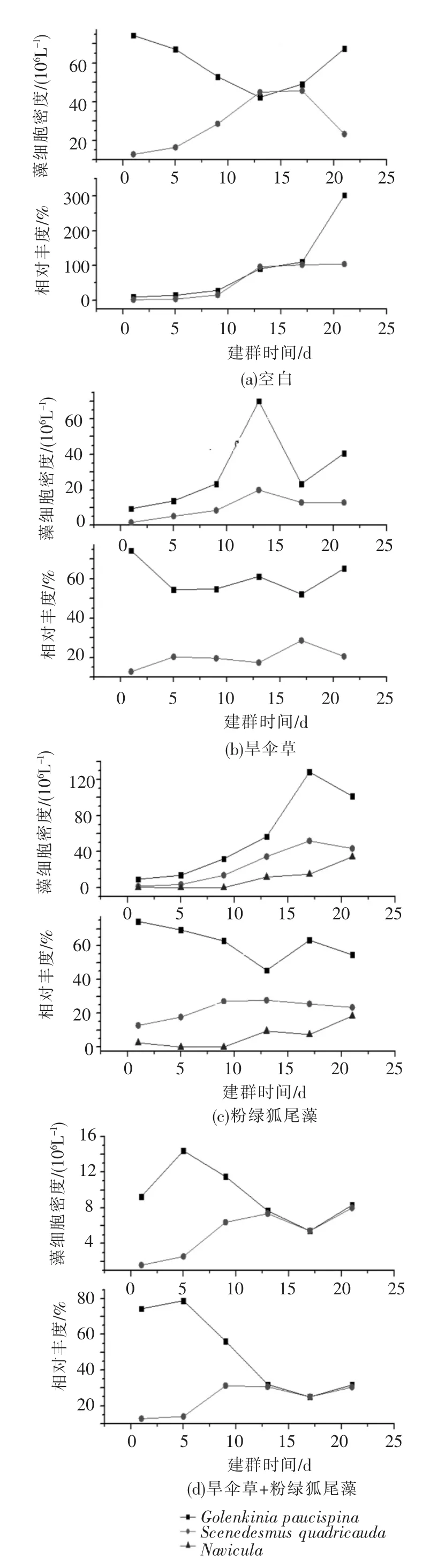
图2 各种植水样中优势藻种及相对丰度的变化
2.3 植藻共培水样中有机物组成分析
经过23 d的培养,对4个实验组的藻植共培水样中所含有机物进行了分析,总离子流图见图3.无植物的水样中化合物种类最多为131种,且各物质丰度值较高(见图3(a));在粉绿狐尾藻的单独种植水体中,有机物种类减少至121种,且各物质丰度值均比无植物水样中丰度略有减小(见图3(b));在旱伞草的单独种植水体中,有机物质种类减少至90种,与粉绿狐尾藻水样相比,各物质丰度更低(见图3(c));在旱伞草+粉绿狐尾藻组合种植水样中,化学物质的种类减少至75种,且各物质丰度值为4种水样中最小(见图3(d)),空白水样中烷类19种、苯类24种、胺类11种、酮类11种、嘧啶类3种、酯类8种、醇类14种、烯类6种、酚类6种、醛类1种、萘类7种及其他种类化合物21种.与空白水样比较,在旱伞草+粉绿狐尾藻水样中嘧啶及醛类未检出,烷类消失了11种,苯类消失了14种,烯及酚消失了4种,说明旱伞草+粉绿狐尾藻对上述物质进行了有效的吸收.与空白水样比较,在旱伞草+粉绿狐尾藻水样中出现的化合物为:1-(2-羟苯基)乙烷、十五烷、二十烷、4-甲基-癸烷、1-乙烷基-2,4-二甲基苯、9-乙烷基-9氢咔唑-3-胺、丙酮合氰化氢、磷酸三乙酯、己二酸,双(2-乙基己基)酯、莰烯、4-甲基苯酚、1,5-二甲基萘、二氢化茚、甲基丙烯酸酐等共15种.通过与粉绿狐尾藻及旱伞草单独水样中化合物的比较,只存在于旱伞草+粉绿狐尾藻水样中的化合物有4种,分别为丙酮合氰醇、磷酸三乙酯、莰烯及4-甲基苯酚.
丙酮氰醇有毒性且为制杀虫剂的中间体;磷酸三乙酯可用于制备农药,也可用于植物生长调节剂[13];莰烯属双环单萜烯类化合物且效应为具有吸引性味觉或气味,也可用于合成农药及毒杀芬等物质;4-甲基苯酚有腐蚀性和毒性.目前初步认为:丙酮氰醇、磷酸三乙酯、莰烯及对甲基苯酚很可能为潜在的抑藻化感物质,但有待于进一步研究.
3 结论
1)通过旱伞草、粉绿狐尾藻、旱伞草+粉绿狐尾藻在自然水体水样中的种植对比发现,旱伞草+粉绿狐尾藻的组合种植水样中,藻类建群过程的延迟期最短,发展为成熟期的时间也最短,生物量的峰值最低,群落的演替速度较快.
2)旱伞草+粉绿狐尾藻的组合种植可控制水体中叶绿素质量浓度,并大幅降低藻类生物量.
3)旱伞草+粉绿狐尾藻的组合种植可有效降低水体中有机物的种类及质量浓度.在其组合水样中新生成的丙酮合氰醇、磷酸三乙酯、莰烯及4-甲基苯酚这4种物质,为后续的化感物质分离及化感抑藻作用提供了重要参考.
[1]张宇,王圣瑞,李重祥,等.沉水植物对富营养化水体的修复作用及其研究展望[J].内蒙古草业,2009,21(4):17-21.
[2]栾晓丽,王晓,时应征,等.两种挺水植物的脱氮除磷效果及其影响因素研究[J].安徽农业科学,2008,36(4):1576-1577,1654.
[3]NAKAI S,INOUE Y,HOSOMI M,et al.Myrophyllum spicatum released allelopathic polyphenoles inhibiting growth of blue-green algae Chlorella pyrenoidosa[J].Water Research,2000,34(11):3026 -3032.
[4]NAKAI S,INOUE Y,HOSOMI M,et al.Growth inhibition of blue-green algae by allelopathic effects of macrophytes [J].Water Science and Technology,1999,(8):47 -53.
[5]KOEMER S,NICKLISCH A.Allelopathic growth inhibition of selected phytoplankton species by submerged macrophytes[J].Journal of Phycology,2002,38(5):862-871.
[6]JASSER I.Influence of Ceratophyllum deumersum on Phyto-plankton community in experimental conditions[J].Internat Verein Limnol,1994,25:2291 -2295.
[7]孙瑞莲,张建,王文兴.8种挺水植物对污染水体的净化效果比较[J].山东大学学报,2009,44(1):12-16.
[8]田琦,王沛芳,欧阳萍等.5种沉水植物对富营养化水体的净化能力研究[J].水资源保护,2009,25(1):14-17.
[9]李修岭,李伟,李夜光,等.几种植物去除高度富营养化湖水中氮磷及抑藻效果的初步研究[J].武汉植物学报,2005,23(1):53-57.
[10]朱兴娜,施雪良.旱伞草的生产栽培与园林应用[J].北方园艺,2008(5):163.
[11]吴程,常学秀,董红娟.粉绿狐尾藻(Myriophyllum aquaticum)对铜绿微囊藻(Microcystis aeruginosa)的化感抑制效应及其生理机制[J].生态学报,2005,6:23-26.
[12]韩茂森,束蕴芳.中国淡水生物图谱[M].北京:海洋出版社,1995:10.
[13]洪仲苓.化工有机原料深加工[M].北京:化学工业出版社,1997:155-156.
Allelopathic effects ofCyperus alternifoliusandMyriophyllum aquaticumon phytoplankton
QIN Song-yan1,2,WU Bo3,YAN Ying-yi1,ZHOU Jin-xi1,ZHOU Qi-xing2
(1.School of Environmental Science and safty Engineering,Tianjin University of Technology,300384 Tianjin,China,qinsongyan@yahoo.com.cn;2.School of Environmental Science and Engineering,Nankai University,300191 Tianjin,China;3.Siemens Water Technologies and Engineering(Tianjin)Co.,Ltd,300191 Tianjin,China)
Allelopathic effects ofC.alternifolius(Cyperus alternifolius),M.aquaticum(Myriophyllum aquaticum),C.alternifoliusandM.aquaticumwere investigated in coexistance experiments,and the algae biomass,chlorophyll a,community change and organic matters of the coexistance samples were monitored and analyzed.Cell numbers and Chl- a were significantly inhibited byC.alternifoliusandM.aquaticum.The peak biomass of algae is 2.4 ×107/L,while that of the control,C.alternifolius,M.aquaticumis 4.48,1.15,2.03×108/L respectively.The organic matters analysis show that only 75 kinds of organic matter exist in theC.alternifoliusandM.aquaticumcoexistance samples while 131 kinds of organic matter exist in the control sample.Acetone cyanohydrin,Triethyl phosphate,Camphene and 4 - methyl-4 -Phenol were new produced matters byC.alternifoliusandM.aquaticumwhich maybe the potential allelopathic matters.
Cyperus alternifolius;Myriophyllum aquaticum;allelopathic matters;algae inhibitation
Q948.12
A
0367-6234(2011)10-0134-05
2010-08-15.
秦松岩(1978—),女,副教授;
周启星(1963—),男,教授,博士生导师.
(编辑 刘 彤)

