一株分解纤维素放线菌的诱变选育及其固态发酵条件
倪 林, 李春葆, 李世艳, 胡士明, 叶 明
(1.合肥工业大学 生物与食品工程学院,安徽 合肥 230009;2.恰恰食品股份有限公司,安徽 合肥 230031;3.安徽九牛饲料有限公司,安徽 合肥 230031)
纤维素是地球上最丰富的自然资源,也是一种可再生的能源物质,利用生物转化技术可将其转化成多种低分子物质。为了更好地利用纤维素,国内外学者很早就开始关注纤维素酶的研究与应用[1]。然而,目前用于纤维素酶生产的菌株所产纤维素酶的酶活均不高,不能满足生产实践的需要,如芽孢杆菌的CMCase酶活最高达14.59μmol/min[2]。因此,筛选高效纤维素分解菌,确立相应的纤维素酶发酵工艺条件显得尤为重要。本研究在广泛搜集实验材料的基础上,希望能分离筛选一株出高产纤维素酶菌株,再对其进行微波-硫酸二乙酯复合诱变,并运用正交试验法对突变菌株进行固态发酵条件研究,以期为纤维素酶的开发应用提供理论依据。
1 材料和方法
1.1 菌种来源
分离自合肥工业大学南区排污口土壤。
1.2 培养基
初筛平板培养基和CMC-Na复筛培养基[3-4]。其营养盐固态发酵培养基为:不同发酵底物(稻草粉、稻壳粉、麸皮和滤纸粉)15g,加入营养盐溶液的组成为:(NH4)2SO410g/L、KH2PO43g/L、CaCl20.5g/L、MgSO40.5g/L。
1.3 方法
1.3.1 菌种的分离筛选
以初筛分离培养基进行初筛,CMC-Na培养基和刚果红染色复筛。
1.3.2 菌株的鉴定
依据《常见细菌系统鉴定手册》及《细菌和放线菌的鉴定》进行初步鉴定。
1.3.3 诱变选育
(1)微波-硫酸二乙酯复合诱变。参见文献[5]所述方法制备菌悬液,调微波炉功率为700W,脉冲频率为450MHz。按0、10、20、30、40、50、60s不同的处理时间,对孢子悬液进行处理,然后取出1mL进行适当稀释,得到不同稀释度的菌悬液。稀释后吸取0.1mL菌悬液涂布于均匀涂有硫酸二乙酯的CMC-Na培养基上,28℃下培养4d。挑取诱变后长势较好的突变菌落,分别接种到CMC-Na培养基上,28℃恒温培养4d,进行菌落计数,根据对照平板上的菌落数,计算不同处理时间的致死率为:

通过测定透明圈与菌落直径大小进行复筛,从中挑选高产菌株。
(2)菌株复筛。挑取初筛得到的产酶菌株斜面培养物接种于种子培养基上,用无菌玻璃棒压碎与培养基搅匀,28℃恒温培养3d后进行酶活测定,突变株与对照菌株比较,相对酶活≤90%的为负突变株,相对酶活≥110%的为正突变株,相对酶活在90%~110%的为等性突变株,计算正突变率。
1.3.4 产酶条件优化
在单因素试验的基础上,确定本次正交试验的因素和水平。以L16(45)正交表来设计试验,不考虑各因素间的交互作用,因素水平见表1所列。

表1 正交试验因素水平
按固体取干重的10倍加入蒸馏水搅拌,于40 ℃ 水浴中保温 45min。4000r/min 离心20min,上清液即为粗酶液,测定其CMC酶活、天然纤维素酶活和FPA酶活。
1.3.5 纤维素酶活力测定
(1)CMC酶活的测定。于25mL具塞试管中加入质量分数为1%、pH值为4.8的CMCNa-醋酸缓冲液1.8mL,加入0.2mL酶液,50℃保温30min后,加入3.0mL DNS试剂,水浴煮沸5min,冷却后用蒸馏水定容,摇匀,于540nm处测定吸光度值[2]。
(2)天然纤维素酶活的测定。于25mL具塞试管中加入pH值为4.8的醋酸缓冲液1.8mL、天然纤维素50.0mg以及酶液0.2mL,50℃保温24h后,其他的同CMC酶活的测定[6]。
(3)FPA酶活的测定。于25mL具塞试管中加入pH值为4.8的醋酸缓冲液1.8mL、50.0 mg新华滤纸以及酶液0.2mL,50℃保温60min后,其他的同CMC酶活的测定[7]。
2 结果与分析
2.1 菌株鉴定
XWC8菌株的菌落呈圆环形生长,放射状,中间稍隆起,颜色正反面不一致,正面为白色,反面为棕黄色,有土腥味。菌丝有基内菌丝和气生菌丝的分化,气生菌丝较细 (直径为0.8~1.0μm),无分隔多分枝,革兰氏染色阳性;孢子丝螺旋形,孢子球形(直径为0.7μm),无孢囊,形成孢子后覆盖菌落表层呈粉状,雪白色单个孢子球形,无鞭毛。气生菌丝体白色,丝绒状,在菌落边缘生长成同心圆,在以纤维素为基质的培养基上生长良好。根据细菌和放线菌的鉴定手册初步确定菌株XWC8属于放线菌属(Actinomyces)。
2.2 微波-硫酸二乙酯复合诱变
取0.1mL诱变后的菌悬液,涂布于均匀涂有硫酸二乙酯的CMC-Na培养基上,28℃下培养4d,诱变致死率曲线如图1所示。
从图1可看出,当诱变剂量一定时,随着处理时间的增加,孢子的死亡率逐渐升高,微波处理50s,致死率达98.1%,处理60s时孢子致死率高达99.2%。这说明XWC8的孢子对微波-硫酸二乙酯较敏感。
2.3 纤维素酶高产菌株的筛选
测定CMC-Na复筛平板上透明圈与菌落直径大小,并计算相对酶活,结果见表2所列。
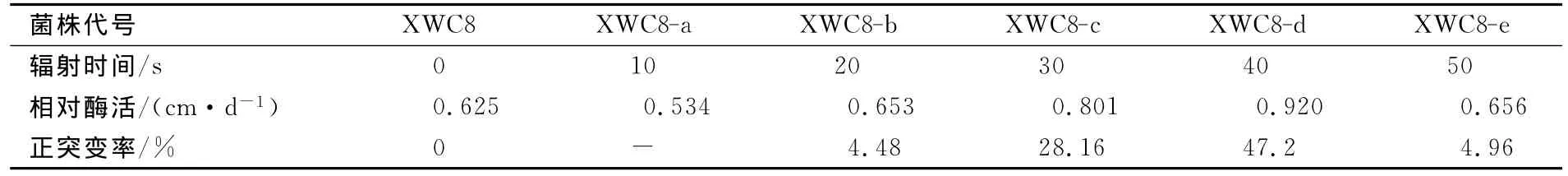
表2 突变菌株的CMC-Na相对酶活
随着微波辐射时间的延长,正突变率突变株也随之增加。当辐射时间为40s时正突变率最高,达47.2%。这可能是由于被微波辐射极性分子在电磁场中快速转向产生相互摩擦,引起胞子悬浮液温度迅速升高;辐射超过50s,孢子的致死率高达98.1%,且正突变率迅速下降。XWC8-d的CMC-Na相对酶活为0.920cm/d,较原始菌株XWC8提高了47.2%,因此以XWC8-d作为下一步产酶优化的出发菌株。
2.4 菌株产酶条件优化
2.4.1 正交试验结果
由于试验结果为多种酶活,而实际应用中各酶活重要性相当,所以采用综合评分法对实验数据进行分析,计算各评价指标的隶属度,继而相加得到综合分,将多指标转化为单指标进行直观分析,结果见表3所列。
根据极差R值及Ki可得最优组合为A3B1C1D1E1,且诱变菌株XWC8-d产纤维素酶的最显著影响因素为碳源,其次为培养温度,含水量、培养时间及氮源影响依次减小。最佳固态发酵底物为麸皮,培养温度为25℃时产酶酶活最高,产酶最佳固液比为1∶2.3,最佳培养时间为96h,氮源硝酸铵对产酶也有促进作用,当以硝酸铵为氮源时,产酶酶活达到最大,且硝酸铵为无机氮源较为经济。
而由表3可看出,最优处理组合为A3B2C4D3E1,这与综合评分法所得的结果不一致,故需进行验证性试验。

表3 XWC8-d菌株正交试验结果

续表
2.4.2 验证试验
对2组合方案A3B2C4D3E1和A3B1C1D1E1进行验证试验,结果见表4所列。

表4 验证实验结果 μmol/min
由表4可知,组合方案A3B1C1D1E1总体上优于A3B2C4D3E1,故得到菌株XWC8-d的最佳产酶条件如下:麦麸为单一碳源,NH4NO3为氮源,固液比为1∶2.3,28℃下培养96h。比较突变菌株XWC8-d在该条件下和出发菌株XWC8在秸秆为单一碳源,硫酸铵作氮源[8],固液比为1∶2.3,28℃下培养96h条件下的FPA酶活、天然纤维素酶活和CMC酶活,结果见表5所列。

表5 XWC8-d与XWC8在优化条件下的酶活 μmol/min
由表5可知,在优化条件下突变株XWC8-d的FPA酶活较原始菌株XWC8提高96.8%,CMC酶活提高102%,天然纤维素酶活提高189%。
3 结束语
目前,在国内关于放线菌分解纤维素的报道不多,本研究对筛选出的一株可分解纤维素的放线菌XWC8,首次进行了微波-硫酸二乙酯复合诱变,获得突变株XWC8-d,并运用正交试验法对XWC8-d进行固态发酵条件研究,确定了菌株XWC8-d的最优产酶条件如下:碳源麦麸(15g),氮源为NH4NO3(0.3g),固液比为1∶2.3,25℃下培养96h。结果表明,XWC8-d生长的最适碳源为小麦加工的副产品麦麸。此外,该菌株还能够很好地利用稻草和稻壳等秸秆纤维素,并将其降解为多种低分子物质,故该菌株具有良好的应用前景。
[1]王 亮,尚会建,杨立彦,等.纤维素酶的应用研究进展[J].河北工业科技,2010,27(6):441-443,461.
[2]顿宝庆,吴 薇,王旭静,等.一株高纤维素酶活力纤维素分解菌的分离与鉴定[J].中国农业科技报道,2008,10(1):113-117.
[3]魏亚琴,邵建宁,麻和平,等.纤维素酶高产菌分解菌的筛选和鉴定[J].食品与机械,2010,26(5):19-22.
[4]叶 明,叶崇军,胡士明,等.纤维素酶益生菌的选育及产酶条件[J].合肥工业大学学报:自然科学版,2009,31(11):1730-1734.
[5]黄 娟,陈正杰,冯 军,等.紫外和微波结合诱变选育lipstatin产生菌[J].中国医药工业杂志,2006,37(1):12-14.
[6]Zhou X H,Chen H Z,Li Z H.CMCase activity assay as a method for cellulase adsorption analysis[J].Enzyme and Microbial Technology,2004,35(5):455-459.
[7]Castellanos O F,Sinitsyn A P,Vlasenko E Y.Evaluation of hydrolysis conditions of cellulosic materials by penicilliumcellulase[J].Bioresource Technology,1995,52(2):109-117.
[8]宋 波,羊 键.一株降解纤维素的放线菌的筛选及其产酶条件的研究[J].微生物学杂志,2005,25(5):36-39.

