罗格列酮对HUVECs受损的保护作用及对TNF-a和IL-6水平的影响
李 倩, 焦 燕, 彭 海
Gokkusu等研究表明同型半胱氨酸(homocysteine,Hcy)可以促炎症介质释放增加,导致内皮细胞损伤[1~3],而后者是动脉粥样硬化的始动因素[4]。PPARs属于Ⅱ型核受体配体依赖转录因子超家族成员。近年的研究显示,在特定配体激活下,PPARs可以抑制炎性因子表达和炎症反应[5~7]。罗格列酮(Rosiglitazone,Ros)是PPARγ高亲和力的配体,有调节炎症反应的作用。本研究旨在观察罗格列酮是否对Hcy诱导的人脐静脉内皮细胞(HUVECs)的损伤有保护作用以及对TNF-a和IL-6水平的影响。
1 材料与方法
1.1 主要试剂 Hcy(Sigma公司);罗格列酮(浙江万马公司);兔抗人Bax抗体、兔抗人Bcl-2抗体及兔抗人Caspase-3抗体(武汉博士德);兔抗人PPARγ抗体(Cell Signing Technology);兔抗人β-actin和辣根酶标记鼠抗兔二抗(武汉博士德);TNF-α和IL-6试剂盒(武汉博士德)。
1.2 细胞培养 脐带取自华中科技大学附属协和医院产科健康产妇。PBS冲洗静脉腔,0.25%胰蛋白酶(trypsin)灌注消化(37℃,10min),血清灭活,离心收集细胞团,转移至铺有0.2%明胶的T25培养瓶中,置于37℃,含5%体积分数CO2培养箱中培养。HUVECs培养液为含20%胎牛血清的DMEM培养基,细胞融合90%以上时用0.25g/L胰酶消化传代,第2~3代用做实验。
1.3 细胞分组及处理 HUVECs分为对照组(A组,DMEM培养基);实验组(B组,Hcy 100μmol/L);干预组(C组,Ros),再根据不同浓度分为(C1:Hcy 100μmol/L+Ros10nmol/L),(C2组:Hcy 100μmol/L+Ros 20nmol/L)(C3 组:Hcy 100μmol/L+Ros 30nmol/L),各培养24h和48h。
1.4 MTT实验 HUVECs按每孔2×103个/ml的密度接种于96孔板中,每组5个复孔,试验重复3次。细胞贴壁后按实验分组加入试剂,48h后每孔避光加入5mg/ml MTT 50u L,混合均匀后置于37℃,含5%体积分数CO2,培养箱孵育4h后吸取上清液,每孔加入 DMSO 200μl,振荡10min。采用酶标仪测定各孔吸光度值(波长570nm处)。
1.5 免疫细胞化学法检测Bax、Bcl-2、Caspase-3蛋白表达 取对数生长期HUVECs,按1×106/ml的密度接种于含有盖玻片的6孔板内进行爬片,待细胞长至盖玻片50%的时候,改换成用无血清的培养基继续培养24h,细胞饥饿24h,使细胞同步化于G0期。然后每组分别加入相应的试剂,继续培养分别至24及48h,用4%多聚甲醛固定,行Bax、Bcl-2、Caspase-3的免疫细胞化学染色,染色步骤严格按SABC、DAB试剂盒说明书操作。
1.6 ELISA法检测上清液TNF-α和IL-6水平
分别采用TNF-α和IL-6 ELISA试剂盒测定,严格按试剂盒和酶标仪说明操作。在酶标仪上测定λ=450nm的TNF-α和IL-6的吸光度值,根据标准品的不同浓度绘制标准曲线,计算细胞培养上清液的TNF-α和IL-6水平。
1.7 Western-blot检测 PPARγ蛋白表达 取各组细胞约1×106/L,加入电泳裂解缓冲液,取20μg变性裂解蛋白进行SDS-PAGE膜电泳,然后电转移至PVDF膜,脱脂牛奶封闭后,将膜置2ml稀释好的抗PPARγ一抗体液(1∶200),4℃ 孵育过夜,TBST液摇洗4次,每次5min。然后将膜置10ml含辣根过氧化酶HRP标记的羊抗兔二抗(1∶2000)室温下孵育2h,再用ECL试剂盒进行发光、显影、定影,Alpha软件处理系统分析目标带的光密度。
1.8 统计学处理 采用SPSS16.0统计软件,计量资料均采用±s,资料采用t检验或LSD法进行组间两两均数比较,以P<0.05为显著性差异标准。
2 结果
2.1 检测细胞存活率 罗格列酮对100μmol/L Hcy所致的细胞损伤具有明显的保护作用。随罗格列酮浓度增加和作用时间延长,细胞存活率增加(P <0.05,见表1)。
2.2 免疫细胞化学分析 与Hcy组相比,罗格列酮组Caspase-3,Bax蛋白表达明显下降,Bcl-2表达明显增高,呈浓度和时间依赖性(P<0.05,见表2)。
2.3 炎症介质TNF-α和IL-6水平变化 Hcy使HUVECs产生炎症介质,随着Hcy作用时间延长,TNF-α和IL-6水平增高。罗格列酮明显降低TNF-α和IL-6水平,且具有时间及浓度依赖性(P<0.05,见表3)。
2.4 PPARγ蛋白表达检测 与Hcy组比较,Ros干预组(C组)PPARγ表达明显上调,呈浓度和时间依赖性(P <0.05,见图1)。
表1 罗格列酮对HUVECs存活的影响±s)
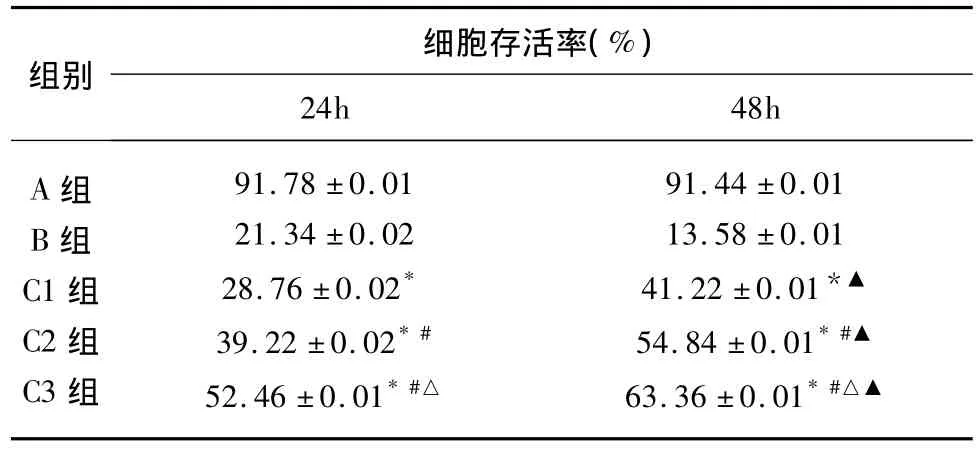
表1 罗格列酮对HUVECs存活的影响±s)
与B组相比*P<0.05;与C1相比 #P<0.05;与C2相比△P<0.05;与24h相比▲P <0.05
组别细胞存活率(%)24h 48h A组B组C1组C2组C3组91.78 ±0.0121.34 ±0.0228.76 ±0.02*39.22 ±0.02*#52.46 ±0.01*#△91.44 ±0.0113.58 ±0.0141.22 ±0.01*▲54.84 ±0.01*#▲63.36 ±0.01*#△▲
表2 罗格列酮对Bax、Bcl-2、Caspas-3蛋白表达的影响(%±s)

表2 罗格列酮对Bax、Bcl-2、Caspas-3蛋白表达的影响(%±s)
与B组24h相比*P<0.05;与B组48h相比#P<0.05;与24h相比△P<0.05
组别Caspase Bax Bcl-2 24h 48h 24h 48h 24h 48h B C1 C3 34.63 ±1.bl_4.34 ±0.22*22.45 ±1.04*46.39 ±3.33△23.73 ±1.01#△17.97 ±0.40#△54.23 ±2.0547.09 ±1.74*41.59 ±1.11*78.58 ±3.71△45.17 ±1.35#△43.12 ±1.58#△46.004 ±1.5150.16 ±1.45*52.10 ±4.17*44.76 ±0.62△63.67 ±2.69#△76.26 ±7.39#△
表3 罗格列酮对IL-6和TNF-a表达的影响(pg/ml±s)

表3 罗格列酮对IL-6和TNF-a表达的影响(pg/ml±s)
与A 组相比*P <0.05;与 B 组相比#P <0.05;与24h相比△P <0.05
IL-6 TNF-a 24h 48h 24h 48h ABC 1 C2 C3 163.67 ±3.le475.00 ±5.29*227.33 ±2.52#217.00 ±5.57#200.00 ±3.61#165.00 ±4.00276.67 ±6.11*△223.67 ± 4.51#△188.00 ± 2.65#△174.00 ± 2.65#△1.35 ±0.012.62 ±0.01*2.22 ±0.01#2.09 ±0.04#1.93 ±0.08#1.35 ±0.013.58 ±0.02*△2.17 ±0.01#△1.71 ±0.01#△1.56 ±0.02#△
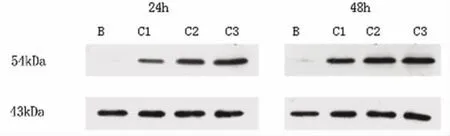
图1 ROS不同浓度及时间对PPARγ蛋白表达的影响
3 讨论
1999年Ross提出动脉粥样硬化(AS)是动脉壁的一种慢性炎症反应过程,细胞因子在涉及AS各阶段的炎症反应事件中发挥重要的调节作用。Tomlinson等[8]研究发现,Hcy是一种炎症刺激物,它可以刺激内皮细胞产生多种炎性因子如TNF-α和IL-6损伤内皮细胞,导致血管炎性损伤。TNF-α是一种致炎性细胞因子,生物活性广泛而强烈,不仅参与炎症反应过程,而且还与其它炎性因子组成复杂的网络系统,通过相互诱生而互相影响生物学效应,使机体出现多种病理损害。TNF-α还可作为配体作用于内皮细胞表面的死亡受体(如TNFR1),进而传递信息进入细胞内引发凋亡[9,10]。IL-6又称B细胞刺激因子2,动脉粥样硬化病灶的主要细胞如内皮细胞、血管平滑肌细胞等都能分泌[11]。IL-6也是有广泛生物活性的细胞因子,是炎症反应的敏感标记物,也是机体复杂的细胞因子网络中重要成员之一,参与多种疾病的炎症病理过程,通过细胞信号转导激活核转录因子-кB(NF-кB),使炎症介质和细胞因子的基因转录增强,进一步促使中膜的平滑肌细胞向内膜下迁移、增殖并发生表型转化,还导致更多的炎症介质释放,促使更多的单核细胞聚集、浸润,导致动脉粥样硬化病变的发生发展。本研究发现,相对于对照组,Hcy组细胞培养液中TNF-α和IL-6水平明显增高,并且细胞存活率下降,促凋亡的蛋白表达增加,抗凋亡蛋白表达下降,证实Hcy是炎症反应的刺激物,可以诱导HUVECs合成和分泌TNF-α和IL-6,致使HUVECs受损。
PPARs属于Ⅱ型核受体配体依赖转录因子超家族成员,其亚型PPARγ在参与动脉粥样硬化斑块形成和演变过程中的内皮细胞、平滑肌细胞等及动脉粥样硬化病灶组织中均有较为广泛表达。最近的研究表明,PPAR也可能参与炎症调控,如抑制TNF-α,IL-6等表达。大多数研究表明PPARγ激活剂有抗炎作用[12,13]。罗格列酮是一种 PPARγ的人工合成配体激动剂噻唑烷二酮类(TZD)降糖药。Zhou等在基因敲除小鼠实验中发现罗格列酮可通过调控血管内皮炎症,在增强动脉粥样硬化斑块稳定性等方面发挥抗 AS作用[14]。本实验建立 Hcy诱导的 HUVECs损伤模型,用不同浓度罗格列酮进行干预。结果显示与Hcy组相比,罗格列酮可提高细胞的存活率;降低TNF-α和IL-6水平,呈浓度和时间依赖性;还可下调Bax和Caspase-3蛋白表达,上调Bcl-2和PPARγ蛋白表达。说明罗格列酮对Hcy诱导HUVECs产生的TNF-α和IL-6均有抑制作用。
实验结果显示罗格列酮可保护Hcy损伤的HUVECs,其作用可能是通过降低炎症细胞因子TNF-a和IL-6的水平,调节Bax和Bcl-2蛋白水平而实现。研究为罗格列酮降低炎性因子TNF-α和IL-6的水平,防治动脉粥样硬化及相关疾病提供了实验依据。
[1] Gokkusu C,Tulubas F,Unlucerci Y,et al.Homocysteine and pro-inflammatory cytokine concentrations in acute heart disease[J].Cytokine,2010,50(1):15 -18.
[2] McCully KS.Chemical pathology of homocysteine.IV.Excitotoxicity,oxidative stress,endothelial dysfunction,and inflammation[J].Ann Clin Lab Sci,2009,39(3):219 -232.
[3] Pate M,Damarla V,Chi DS,et al.Endothelial cell biology:role in the inflammatory response[J].Adv Clin Chem,2010,52:109 - 130.
[4] Dworzanski T,Celinski K,Korolczuk A,et al.Influence of the peroxisome proliferator-activated receptor gamma(PPAR-γ)agonist,rosiglitazone and antagonist,biphenol-A-diglicydyl ether(BADGE)on the course of inflammation in the experimental model of colitis in rats[J].JPhysiol Pharmacol,2010,61(6):683 -693.
[5] Rigamonti E,Chinetti-Gbaguidi G,Staels B.Regulation of macrophage functions by PPAR-alpha,PPAR-gamma,and LXRs in mice and men[J].Arterioscler Thromb Vasc Biol,2008,28(6):1050 -1059.
[6] Szeles L,Torocsik D,Nagy L.PPAR-gamma in immunity and inflammation:cell types and diseases[J].Biochim Biophys Acta,2007,1771(8):1014-1030.
[7] Hyong A,Jadhav V,Lee S,et al.Rosiglitazone,a PPAR gamma agonist,attenuates inflammation after surgical brain injury in rodents[J].Brain Res,2008,1215:218 -224.
[8] Tomlinson DR,Lang D,Lewis MJ.Homocysteine,B vitamins,and cardiovascular disease[J].N Engl JMed,2006,355(2):209 -211.
[9] Kawano S,Kubota T,Monden Y,et al.Blockade of NF-kappaB improves cardiac function and survival after myocardial infarction[J].Am JPhysiol Heart Circ Physiol,2006,291(3):H1337 - H1344.
[10] Dyugovskaya L,Lavie P,Hirsh M,et al.Activated CD8+T-lymphocytes in obstructive sleep apnoea[J].Eur Respir J,2005,25(5):820-828.
[11] Rus HG,Vlaicu R,Niculescu F.Interleukin-6 and interleukin-8 protein and gene expression in human arterial atherosclerotic wall[J].Atherosclerosis,1996,127(2):263 -271.
[12] Fan Y,Wang Y,Tang Z,et al.Suppression of pro-inflammatory adhesion molecules by PPAR-delta in human vascular endothelial cells[J].Arterioscler Thromb Vasc Biol,2008,28(2):315 -321.
[13] Kuusisto J,Andrulionyte L,Laakso M.Atherosclerosis and cardiovascular risk reduction with PPAR agonists[J].Curr Atheroscler Rep,2007,9(4):274 -280.
[14] Zhou M,Xu H,Pan L,et al.Rosiglitazone promotes atherosclerotic plaque stability in fat-fed Apo E-knockout mice[J].Eur J Pharmacol,2008,590(1 -3):297 -302.

