犬瘟热病毒核衣壳蛋白基因在昆虫细胞中的表达及其抗原性分析
毕振威 ,王永山,范红结
(1.江苏省农业科学院兽医研究所 农业部动物疫病诊断与免疫重点开放实验室 国家兽用生物制品工程技术研究中心,南京 210014;2.南京农业大学动物医学院,南京 210095)
犬瘟热(canine distemper, CD)是由犬瘟热病毒(Canine distemper virus, CDV)感染犬、貂、浣熊和狐等食肉动物引起发病的一种致死性传染病。CDV弱毒疫苗的使用曾有效地防控了此病,但在过去的20年,犬瘟热疫情重新爆发和大规模流行,而且已跨越物种限制,感染海豹、海狮等水生动物和灵长类动物[1]。2008年中国大陆出现了人工饲养恒河猴感染并死于犬瘟热的病例[2]。
CDV属于副粘病毒科麻疹病毒属,病毒颗粒主要由核衣壳蛋白(nucleocapsid protein, N)、融合蛋白(fusion protein, F)、血凝或附着蛋白(heamagg lutinin protein, H)、基质膜蛋白(matrix protein, M)、大蛋白(large protein, L)和磷蛋白(phosphoprotein, P)构成[3]。N蛋白是具有免疫原性的主要结构蛋白,病毒感染早期,即可强烈刺激机体产生大量的特异性抗体[4]。在动物免疫功能低下,H蛋白和F蛋白的特异性抗体低于检测水平时,N蛋白的特异性抗体仍能被检测到[5]。因此,进行CDV血清学诊断时,尤其在CDV早期感染阶段,与病毒其它结构蛋白相比N蛋白是免疫学检测中理想的靶抗原。
CDV只有一个血清型,但存在CDV毒株之间因基因突变导致的抗原性差异[6-10]。本实验前期对引起免疫犬非典型临床症状的CDV NJ01的N基因进行了序列分析,并在大肠杆菌中表达[10]。由于犬血清中自然存在着大肠杆菌抗体,因此,用大肠杆菌表达的重组N蛋白用于CDV抗体ELISA检测时,需要进行严格的纯化,其推广应用有较大的局限性。鉴于此,本实验选用杆状病毒表达系统,将CDV NJ01的N基因在昆虫细胞中表达,探索该重组N蛋白抗原在CDV抗体检测中的应用前景。
1 材料与方法
1.1 质粒、细胞、菌种和病毒含有6×His标签的杆状病毒表达系统供体质粒pFastBacHTA、含有Bacmid和Helper plasmid的E.coliDH10Bac以及Sf9昆虫细胞均购自Invitrogen公司;pMD18-T simple Vector购自TaKaRa公司;E.coliDH5α由本实验室保存;CDV NJ01毒株系由本实验室从表现为非典型犬瘟热临床症状病犬的肺与肝脏组织中分离鉴定,能在vero细胞上稳定增殖和传代[10]。
1.2 主要试剂MiniBEST质粒纯化试剂盒、DNA凝胶回收试剂盒、X-gal、IPTG均购自TaKaRa公司;BAC/PAC DNA分离试剂盒购自Omega公司;Lipofectamine2000转染试剂购自Invitrogen公司;胎牛血清、Grace’s昆虫细胞培养基购自Gibco公司;FITC标记的羊抗兔IgG抗体、DAB显色液购自武汉博士德生物工程有限公司;Ni-NTA His-Bind Resin亲和层析柱购自Novagen公司;兔抗犬IgG抗体和HRP标记的兔抗犬IgG抗体为本实验室制备;犬CDV阳性血清由犬瘟热、腺病毒2型、细小病毒病、副流感四联活疫苗-犬冠状病毒病灭活疫苗(美国富道动物保健公司产品)5次免疫犬获得;5份CDV疫苗免疫犬血清和3份犬CDV阴性血清由公安部南京警犬研究所惠赠;5份临床感染CDV犬血清取自南京农业大学博研宠物医院。
1.3 N基因的RT-PCR扩增和克隆根据GenBank已发表CDV的N基因编码区和供体质粒pFastBacHTA阅读框的多克隆位点设计引物,分别在上游引物和下游引物加入EcoR I和Hind III酶切位点,6×His标签位于重组N蛋白的N端。上游引物F:5′-CCGGAATTCATGGCTAGCCTTC TCAAGAGCCTC-3′(下划线为EcoR I位点);下游引物R:5′-CCCAAGCTTTTAATTGAGTAG CTCTCTATC-3′(下划线为HindIII位点)。
重组杆状病毒表达质粒鉴定引物:M13F(17):5′-GTTTTCCCAGTCACGAC-3′;M13R(17):5′-CAGGAAACAGCTATGAC-3′。以上引物由Invitrogen公司合成。
将CDV接种vero细胞,病变后反复冻融3次取 裂 解 液, 按 TRIZOL®Reagent (InvitrogenTMLife technologies)试剂使用方法提取RNA。用RT-PCR方法扩增CDV的N基因。回收N基因的PCR扩增产物,将其与pMD18-T simple Vector连接,转化E.coliDH5α感受态细胞。用1.5%琼脂LB平板(含氨苄青霉素100 mg/L)进行蓝白斑筛选,挑白色单菌落扩大培养,提取质粒,用EcoR I和Hind III双酶切,经琼脂糖凝胶电泳鉴定,获得阳性克隆质粒pMD-N,测序由Invitrogen公司完成。
1.4 N基因重组供体质粒的构建将pMD-N和pFastBacHTA分别用EcoRI与HindIII双酶切,琼脂糖凝胶电泳后分别回收N基因和载体片段,DNA凝胶回收试剂盒纯化,T4DNA 连接酶连接并转化E.coliDH5α感受态细胞,用1.5%琼脂LB平板(含氨苄青霉素100 mg/L)筛选转化菌,挑单菌落扩大培养,用MiniBEST质粒纯化试剂盒提取质粒,EcoR I与Hind III双酶切鉴定,获得重组供体质粒pFastBac-N。
1.5 N基因重组Bacmid DNA的获得用重组供体质粒pFastBac-N转化感受态细胞E.coliDH10Bac,在LB培养基中37℃、220 r/min振摇4 h,涂布在LB琼脂平板(含有卡那霉素50 mg/L、庆大霉素7 mg/L、四环素10 mg/L以及X-gal 100 mg/L和IPTG 40 mg/L),37℃培养24 h。挑白色单菌落接种于含有上述三种抗生素的LB中,37℃振摇培养24 h,用BAC/PAC DNA 分离试剂盒提取重组Bacmid DNA。同步提取E.coliDH10Bac中的Bacmid DNA作为空白对照。分别用N基因上游引物F和M13R(17)以及M13F(17)和M13R(17)两种引物组合,PCR鉴定重组Bacmid DNA,获得含N基因的重组Bacmid DNA,命名为rBacmid-N。
1.6 N基因重组杆状病毒的获得在转染前1 d,用对数生长期的Sf9昆虫细胞在6孔细胞培养板中制备单层细胞。将rBacmid-N按Lipofectamine2000使用说明书转染Sf9细胞。转染时弃去旧培养液,用无血清无抗生素的Grace’s液洗涤细胞。然后用孵育好的rBacmid-N和Lipofectamine2000混合物转染Sf9细胞单层,在27℃作用5 h后弃去转染混合物,每孔加入含10%血清及抗生素的Grace’s完全培养液,置27℃继续培养。每天观察病变,直到细胞病变达90%时,收集细胞及上清液,在Sf9昆虫细胞上继续传代2次后进行鉴定,获得第3代(P3代)重组杆状病毒vBacmid-N。同步用未插入外源基因的Bacmid质粒和单用转染试剂转染的Sf9细胞作为对照。
1.7 Western blot分析将P3代vBacmid-N感染的Sf9细胞、Bacmid转染产生的野生杆状病毒感染的Sf9细胞和正常的Sf9细胞用0.01 mol/L PBS(pH7.2)离心洗涤2次后,用PBS重悬加入5×SDS-Loading Buffer,按常规方法进行SDSPAGE电泳分析,并将其转印到硝酸纤维素膜(NC膜)上,用5%脱脂奶粉4℃封闭过夜,洗涤后加犬CDV高免血清室温作用1 h,然后在洗涤的NC膜中加入HRP标记的兔抗犬IgG抗体,作用1 h后洗涤,DAB底物显色。
1.8 间接免疫荧光试验(indirect immunof l uorescent assay, IFA) 检测实验在24孔细胞培养板中进行。将P3代重组杆状病毒vBacmid-N接种到Sf9细胞,培养72 h后用0.01 mol/L PBS(pH7.2)洗涤2次;加入-20℃预冷的无水乙醇(1 mL/孔),4℃固定30 min,用PBS洗涤3次,拍干;加入100倍稀释的犬抗CDV高免血清(200 μL/孔),37℃孵育1 h,PBS洗涤5次,拍干;加入兔抗犬IgG抗体(200 μL/孔),37℃孵育1 h,PBS洗涤5次,拍干;加入50倍稀释的FITC标记的羊抗兔IgG抗体工作液(200 μL/孔),37℃孵育1 h,PBS洗涤5次,置于荧光显微镜下观察。同步设立野生杆状病毒感染Sf9细胞和正常Sf9细胞为对照。
1.9 间接 ELISA按 Ni-NTA His-Bind Resin 亲和层析柱使用说明纯化N蛋白。以纯化的重组N蛋白为包被抗原,采用方阵试验方法优化抗原包被浓度、被检血清稀释和HRP标记的兔抗犬IgG,建立CDV抗体间接ELISA检测方法。对5份CDV疫苗免疫犬血清、5份临床感染CDV犬血清和3份犬CDV阴性血清进行检测,重复3次,检验重组N蛋白的特异性与稳定性。
2 结果
2.1 N基因的扩增与克隆从感染CDV的vero细胞冻融物中提取RNA,RT-PCR方法扩增出约1600 bp的片段,与CDV的N基因理论值(1572 bp)相符。将N基因与pMD18-T simple Vector连接构建成重组克隆质粒pMD-N,用EcoRI与HindIII双酶切,可得到约1600 bp的N基因片段和3000 bp的克隆载体片段(图1)。测序结果(已录入GeneBank中,序列号为JF965338)在GenBank中比对分析,显示为CDV的N基因。
2.2 N基因重组供体质粒的构建将N基因与pFastBacHTA载体片段连接,获得含N基因的重组供体质粒pFastBac-N,经EcoRI和Hind III双酶切,用1%琼脂糖凝胶电泳可见2条长度分别约1600 bp和5000 bp的条带,与N基因和pFastBacHTA片段的理论值相符合(图1)。

图1 CDV N基因重组质粒的酶切鉴定Fig.1 Identification of the recombinant plasmid pMD-N and pFastBac-N
2.3 N基因重组Bacmid DNA的获得用pFastBac-N转化DH10Bac感受态细胞,经蓝白斑和三种抗性筛选,挑白色菌落扩大培养,提取含N基因的重组Bacmid DNA。分别用N基因F、M13R(17)引物组合和M13F(17)、M13R(17)引物组合进行PCR扩增鉴定,得到了2189 bp和3959 bp的预期大小片段。对照质粒Bacmid由于缺少目的基因,无法与N基因F特异结合而无条带出现,而用M13F(17)和M13R(17)只扩增出307bp的片段(图2),表明成功获得含N基因的重组Bacmid DNA(简称:rBacmid-N)。
2.4 N基因重组杆状病毒的获得将鉴定好的rBacmid-N用脂质体法转染Sf9细胞,5 d后转染孔可见部分细胞变圆变大,d6细胞病变达90%以上。收集病变细胞及上清,1500 r/min离心10 min,上清液即为含N基因的重组杆状病毒vBacmid-N原液(P1代),继续传代2次,获得高效价的P3代重组杆状病毒。
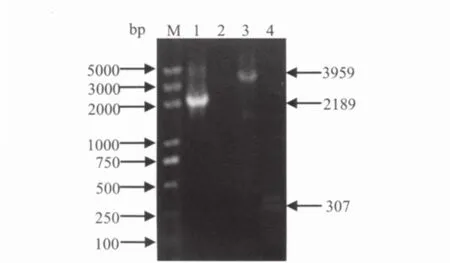
图2 CDV N 基因重组Bacmid DNA(rBacmid-N)的PCR鉴定Fig.2 Analysis of recombinant Bacmid DNA (rBacmid-N)by PCR
2.5 Western blot分析对P3代vBacmid-N感染的Sf9细胞培养物进行SDS-PAGE,用Western blot分析,在62 kDa处可见一条特异蛋白带,与重组N蛋白的理论值相符合,表明重组N蛋白在昆虫细胞中表达,并具有CDV抗原反应性。正常Sf9细胞和野生杆状病毒感染的Sf9细胞均无特异的蛋白带(图3)。
2.6 IFA检测在IFA试验中,vBacmid-N感染的Sf9细胞呈现较强的荧光,而正常Sf9细胞和Baculovirus感染的sf9细胞均没有荧光(图4)。
2.7 间接ELISA将纯化的重组N蛋白进行SDSPAGE,用凝胶图像分析软件BandScan5.0分析,纯度达80%(图3)。以纯化的重组N蛋白为包被抗原,采用方阵试验方法确定的抗原包被浓度为1 mg /L,被检血清的稀释度为1:200。检测5份CDV疫苗免疫犬血清和5份临床感染CDV犬血清检测,其A450值均大于0.4,其中有6份高于0.8;而3份犬CDV阴性血清的A450值均小于0.05,显示出了良好的抗原特异性和稳定性。

图3 vBacmid-N感染Sf 9细胞SDS-PAGE和Western blot分析结果Fig.3 Analysis of vBacmid-N infected sf9 cells by SDS-PAGE and Western blot

图4 vBacmid-N感染的Sf9昆虫细胞IFA检测结果Fig.4 IFA detection result of Sf9 cells infected with vBacmid-N by IFA
3 讨论
目前,免疫接种是防控CD的有效方法,但免疫效果并非总是有效,世界许多国家均有免疫犬爆发CD疫情或发病的报道[11],其临床症状也呈现多样化。我们曾在临床病例中发现了免疫犬感染CDV,表现为CD的非典型临床症状。尽管免疫失败与疫苗质量、母源抗体干扰、动物免疫状态和应激等因素相关,但是CDV毒株基因变异导致其抗原性和致病性与疫苗株存在差异可能也是一个重要因素[6]。CDV的N蛋白是病毒的主要结构蛋白,又是免疫原性较强的蛋白,许多CDV分离毒株的N基因发生变异已被证实[9-13]。本实验室对引起免疫犬表现非典型CD临床症状的CDV NJ01病毒N基因进行了序列分析,该非典型CDV具有强毒株的分子特征[10]。
ELISA方法是检测CDV血清抗体的一种快速、敏感和特异方法,传统的CDV抗体ELISA检测方法,通常用全病毒作为包被抗原,但CDV在Vero细胞培养中的病毒滴度较低,并且需要采用超速离心等复杂的纯化技术,而且病毒蛋白不稳定[14],限制了该方法的广泛应用。姜骞等[15]和Latha等[16]原核表达N蛋白,建立间接ELSIA血清学诊断方法。Messling[14]等利用杆状病毒重组表达的CDV野生分离株(2544/Han95)的N蛋白建立捕获夹心ELISA,用于检测犬血清中的IgM和IgG。
为了制备便于检测试剂标准化的非典型CDV抗体检测抗原,本实验室曾将非典型CDV NJ01的N基因在大肠杆菌中进行了高效表达,由于表达产物主要以包涵体的形式存在,重组N蛋白的纯化与复性比较繁琐。此外,用大肠杆菌表达的蛋白作抗原检测动物体内的抗体,常因纯化的抗原中存在大肠杆菌成份污染而导致出现假阳性。杆状病毒/昆虫细胞表达系统具有与高等细胞类似的翻译后修饰系统,其表达外源蛋白的生物学活性与天然产物极其相似,能够保持较好的抗原性和免疫原性[17]。自然状态下,犬体内不存在昆虫细胞抗体,因此,本研究选用杆状病毒/昆虫细胞表达系统表达N蛋白作为CDV抗体检测抗原,以期改善检测方法的特异性与稳定性。
本实验结果表明,在昆虫细胞Sf9中表达的重组N蛋白,经Western blot、IFA和间接ELSIA三种方法分析,均显示了良好的抗原特异性,用该重组蛋白作为抗原建立的CDV血清抗体间接ELISA方法具有良好的特异性和稳定性,优于大肠杆菌表达的重组N蛋白。此外,用分离株CDV NJ01的N基因表达产物作为抗原,可能更适于本地区CDV血清抗体的检测。该抗体检测试剂盒的标准化工作也在进行之中。
[1] Takayama I, Kubo M, Takenaka A,et al.Pathological and phylogenetic features of prevalent canine distemper viruses in wild masked palm civets in Japan[J].Comp Immunol Microbiol Infect Dis, 2009, 32(6): 539-549.
[2] Sun Z, Li A, Ye H,et al.Natural infection with canine distemper virus in hand-feeding Rhesus monkeys in China[J].Vet Microbiol, 2010, 141(3-4): 374-378.
[3] Chan K W, Hsieh H H, Wang H C,et al.Identification,expression and antigenic analysis of recombinant hemagglutinin proteins of canine distemper virus[J].J Virol Methods, 2009, 155(1): 18-24.
[4] Latha D, Geetha M, Ramadass P,et al.Development of recombinant nucleocapsid protein based IgM-ELISA for the early detection of distemper infection in dogs[J].Vet Immunol Immunopathol, 2007, 119(3-4): 278-286.
[5] Krakowka S, Olsen R, Confer A,et al.Serologic response to canine distemper viral antigens in gnotobiotic dogs infected with canine distemper virus[J].J Infect Dis, 1975,132(4): 384-392.
[6] Simon-Martínez J, Ulloa-Arvizu R, Soriano V E,et al.Identification of a genetic variant of canine distemper virus from clinical cases in two vaccinated dogs in Mexico[J].Vet J, 2008, 175(3): 423-426.
[7] Iwatsuki K, Tokiyoshi S, Hirayama N,et al.Antigenic differences in the H proteins of canine distemper viruses[J].Vet Microbiol, 2000, 71 (3-4): 281-286.
[8] Lan N T, Yamaguchi R, Inomata A,et al.Comparative analyses of canine distemper viral isolates from clinical cases of canine distemper in vaccinated dogs[J].Vet Microbiol, 2006, 115(1-3): 32-42.
[9] Keawcharoen J, Theamboonlers A, Jantaradsamee P,et al.Nucleotide sequence analysis of nucleocapsid protein gene of canine distemper virus isolates in Thailand[J].Vet Microbiol, 2005, 105(2): 137-142.
[10] 毕振威, 王永山, 范红结, 等.非典型犬瘟热病毒核衣壳蛋白基因序列分析及其在大肠杆菌中的表达[J].中国预防兽医学报, 2011, 33(8): 625-629.
[11] Demeter Z, Palade E A, Hornyák A,et al.Controversial results of the genetic analysis of a canine distemper vaccine strain[J].Vet Microbiol, 2010, 142(3-4): 420-426.
[12] Masuda M, Sato H, Kamata H,et al.Characterization of monoclonal antibodies directed against the canine distemper virus nucleocapsid protein[J].Comp Immunol Microbiol Infect Dis, 2006, 29(2-3): 157-165.
[13] Yoshida E, Shin Y S, Iwatsuki K,et al.Epitopes and nuclear localization analyses of canine distemper virus nucleocapsid protein by expression of its deletion mutants[J].Vet Microbiol, 1999, 66(4): 313-320.
[14] von Messling V, Harder T C, Moennig V,et a1.Rapid and sensitive detection of immunoglobulin M(IgM)and IgG antibodies against canine distemper virus by a new recombinant nucleocapsid protein-based enzyme linked immunosorbent assay[J].J Clin Microbio1, 1999, 37(4):1049-1056.
[15] 姜骞,周洁,刘家森,等.犬瘟热重组N蛋白抗原间接ELISA方法的建立及应用[J].中国预防兽医学报, 2008,30(3): 225-232.
[16] Latha D, Geetha M, Ramadass P,et al.Evaluation of ELISA based on the conserved and functional middle region of nucleocapsid protein to detect distemper infection in dogs[J].Vet Microbiol, 2007, 120(3-4): 251-260.
[17] 欧阳伟,王永山,周宇,等.传染性法氏囊病毒AH1株vp2基因在昆虫细胞中的表达与应用[J].生物工程学报,2010, 26(5): 595-603.

