戈舍瑞林联合内分泌药物治疗绝经前晚期乳腺癌的临床研究
吴三纲 何振宇 郭君 李凤岩 林勤 管迅行
1.华南肿瘤学国家重点实验室,广东 广州 510060;2.中山大学肿瘤防治中心放疗科,广东 广州 510060;3.厦门大学附属第一医院放疗科,福建 厦门 361000
乳腺癌是女性最常见的恶性肿瘤,随着乳腺癌综合治疗的研究进展,死亡率呈下降趋势。但是仍有部分患者在综合治疗后出现局部复发或者远处转移,严重影响患者的生活质量,并且成为影响总体生存的重要危险因素。由于我国女性乳腺癌的发病年龄较西方女性早,因此亟需寻找适合我国女性尤其是年轻女性发病特点的乳腺癌治疗模式。本研究主要探讨绝经前激素受体阳性的晚期乳腺癌患者采用卵巢去势药物(戈舍瑞林)联合内分泌药物治疗的疗效。
1 资料和方法
收集2002年4月—2008年3月期间于中山大学肿瘤防治中心接受根治术的治疗后出现局部复发或远处转移的绝经前晚期乳腺癌患者60例。按以下入组标准,30例为治疗组(应用戈舍瑞林联合内分泌治疗),根据年龄、性别、受体情况及UICC2002分期等指标,进行个体匹配。选取同期30例术后局部复发或远处转移绝经前患者为对照组(内分泌治疗组未应用戈舍瑞林治疗)。
1.1 入组和剔除标准
入组标准:⑴女性,确诊为单侧乳腺癌,行根治术或改良根治术,术后资料完整,并至少完成4个周期辅助化疗;⑵经病理证实为局部区域复发或两种以上影像学诊断为远处转移;⑶雌激素(estrogen receptor,ER)和(或)孕激素(progesterone receptor,PR)受体阳性;⑷入组时检测雌二醇、促卵泡刺激素及促黄体生成素水平,均处于绝经前水平;⑸按期使用戈舍瑞林≥6个月。
剔除标准:⑴初治已有远处转移的乳腺癌患者;⑵疾病进展前使用过戈舍瑞林;⑶第二原发癌;⑷临床资料不完整者。
1.2 临床资料
本研究共入组60例患者,年龄为27~50岁,治疗组中位年龄39岁(27~50岁),对照组中位年龄39岁(27~48岁)。22例为局部区域复发,治疗组和对照组均为11例,中位复发时间分别为25个月(6~141个月)和23个月(6~91个月);38例为远处转移+/-局部区域复发,治疗组和对照组均为19例,中位转移时间分别为28个月(8~78个月)和27个月(5~83个月,表1)。
1.3 疾病进展后的治疗
手术治疗:22例单纯局部区域复发,20例局部区域复发同时发现远处转移。全身化疗:全组59例患者(治疗组29例,对照组30例)接受4~8个疗程化疗,化疗药物有去甲基长春花碱、卡培他滨、紫杉醇类、铂类及蒽环类等。放射治疗:22例无远处转移的局部区域复发患者均行胸壁和(或)锁骨上区姑息放射治疗,剂量为(50~60)Gy/(25~30)f。骨转移患者接受局部骨转移灶姑息性放射治疗,剂量为(30~40)Gy/(10~20)f。内分泌治疗:全组患者59例完成化疗及放疗后,治疗组接受戈舍瑞林治疗(3.6 mg腹壁皮下注射,28~30 d重复),同时口服他莫昔芬(tamoxifen,TAM),每月定期检测激素水平,当稳定在绝经水平后,全部患者改服芳香化酶抑制剂(aromatase inhibitors,AI),并每3~6个月复查激素水平1次;对照组30例患者采用口服TAM治疗。
1.4 随访方法及内容
所有患者通过门诊随诊或电话随访,以疾病再次进展(指复发或转移后经治疗3个月后出现新的复发或转移病灶)为随访终点,每1~3个月随访1次,随访内容包括戈舍瑞林治疗反应情况、疾病再次进展的时间、生存时间及目前的生存情况等。患者的无疾病再次进展时间 (progression-free survival,PFS)及总生存时间(overall survival,OS)均自诊断复发或转移开始计算。中位随访时间38.5个月(5.7~105.4个月),3例失访,随访率为95.0%。
1.5 统计学处理
统计分析采用SPSS 16.0软件包。生存率的计算采用Kaplan-Meier方法,并用log-rank进行差异的显著性检验, P<0.05为差异有统计学意义;其余用χ2检验。

表1 60例疾病进展后患者的临床资料Tab.1 The clinical characteristic of 60 patients with progressive disease n
2 结 果
2.1 疗效比较
2.1.1 疾病再次进展
治疗组18例(60.0%)出现疾病再次进展,1、2和3年无疾病再次进展生存率分别为86.7%、73.0%和62.6%,中位PFS为47.9个月;对照组19例(63.3%)出现疾病再次进展,1、2和3年无疾病再次进展生存率分别为58.9%、43.1%和38.3%(χ2=4.257,P=0.039),中位PFS为16.7个月(图1)。治疗组11例(36.7%)死亡,1、2和3年总生存率分别为100%、82.9%和79.1%,未达到中位生存时间;对照组17例(56.7%)死亡,1、2和3年总生存率分别为83.3%、57.5%及48.9%(χ2=6.671,P=0.010),中位生存时间31.9个月(图2)。
2.1.2 年龄与预后关系
年龄<40岁的患者,治疗组的PFS较对照组显著延长,中位PFS:45.5个月vs16.7个月(χ2=4.893,P=0.027),OS亦存在显著提高,治疗组未达中位生存时间,对照组中位生存时间为23.4个月(χ2=7.227,P=0.007)。对于年龄≥40岁的患者,治疗组与对照组PFS及OS的差异虽无统计学意义,但是治疗组PFS及OS均较对照组延长,中位PFS为50.4个月vs18.1个月(χ2=0.523,P=0.470),中位OS为73.4个月vs31.9个月(χ2=0.800,P=0.371,表2)。对于治疗组,年龄<40和≥40岁患者无疾病再次进展生存率(χ2=0.036,P=0.849)以及总生存率(χ2=0.968,P=0.325)的差异均无统计学意义。

图1 戈舍瑞林对无疾病再次进展生存的影响Fig.1 Impact of goserelin on progression-free survival
2.2 疾病再次进展后继续使用戈舍瑞林与疗效关系
治疗组疾病再次进展18例,其中2例局部区域复发进展为远处转移,1例疾病进展后继续用药;16例远处转移患者疾病再次进展,6例疾病进展后继续用药。疾病再次进展后继续用药的OS差异无统计学意义,但有潜在受益(χ2=3.280,P=0.070),中位生存时间亦有延长(28.2个月vs 7.0个月)。
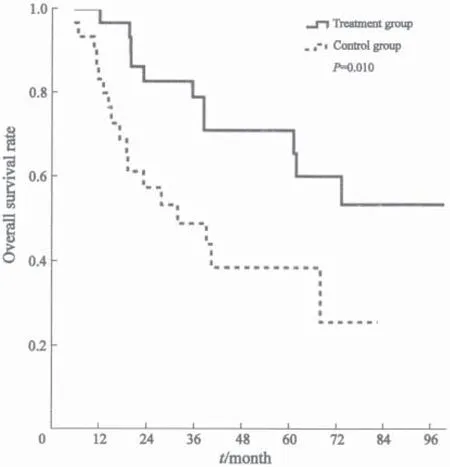
图2 戈舍瑞林对总生存的影响Fig.2 Impact of goserelin on overall survival
2.3 治疗反应情况及对月经的影响
治疗组使用戈舍瑞林持续时间为6~86个月,中位用药时间为31个月,至随访结束,仍有15例患者继续用药。绝大多数患者(28例)激素水平在用药1~2个月内达到绝经水平,2例患者在用药3~4个月内达到绝经水平。患者用药后出现的不良反应主要为潮热(18例)、骨关节不适感(20例)、焦虑易怒(7例)和失眠(2例)。
在随访期内,治疗组因疾病进展或达治疗时间停药者共15例,其中12例(80.0%)恢复月经,3例(20.0%)闭经。对照组年龄<40岁患者中13例(76.5%)仍有月经,4例(23.5%)闭经;≥40岁患者2例(15.4%)仍有月经,11例(84.6%)闭经。
3 讨 论
晚期乳腺癌的治疗目的是改善症状,延缓疾病进展,提高患者的生活质量以及延长生存期[1]。卵巢去势药物通过抑制垂体分泌促卵泡刺激素、促黄体生成素及抑制雌激素的生成而起作用,Boccardo等[2]研究指出对于ER阳性的转移性乳腺癌,使用去势药物+TAM可以取得和手术或放疗去势一样的益处,客观反应率分别为45%和46%,而且其对卵巢功能的抑制作用是可逆的,因此更易于患者接受。对于出现疾病进展的激素受体阳性的绝经前晚期乳腺癌,若单行内分泌治疗,雌二醇水平会明显上升,而加用卵巢去势药物之后可以使激素水平稳定于绝经水平[3],因此理论上可认为两者具有协同作用。Klijn等[4]的研究提示对于ER阳性的绝经前晚期乳腺癌,使用去势药物的临床反应率可达33%,联合TAM临床反应率提高到42%。Meta分析显示,对于绝经前晚期乳腺癌患者,戈舍瑞林联合TAM优于单药戈舍瑞林,总有效率(39% vs 30%)、中位PFS(8.7个月vs5.4个月)、中位OS(2.9年vs2.5年)[5]。本研究中,在全身化疗的基础上加上戈舍瑞林联合内分泌治疗可显著提高PFS(P=0.039)及OS(P=0.010),提示对于激素受体阳性的绝经前晚期乳腺癌,通过阻断雌激素对肿瘤的作用,抑制肿瘤的生长,可使患者生存受益。
年龄是影响乳腺癌疾病进展的一个重要因素[6-7],由于乳腺癌的激素依赖特性,对于年轻患者,阻断激素分泌的最有效方式是使绝经前患者处于“人工绝经”的状态。研究指出通过术后化疗可使80%以上的≥40岁的患者出现绝经;而年龄<40岁的患者,约50%化疗后出现绝经;<35岁的患者,出现绝经状态的则只有1/3[8-9]。因此,对于年龄<40岁的患者,化疗后大部分的患者卵巢功能仍然旺盛,可能导致雌激素刺激肿瘤再次生长,从而出现局部复发或远处转移;而≥40岁的患者由于化疗后大部分出现闭经,因此通过卵巢抑制所带来的获益可能有限。两个大型随机试验结果证实<40岁的患者使用卵巢去势在局部复发及远处转移的获益明显优于≥40岁的患者[10-11]。本研究中,关于年龄因素对卵巢去势疗效的影响与辅助化疗的结果相同,98.3%的患者在出现疾病进展后使用全身化疗,对于年龄<40岁的患者,使用戈舍瑞林与否PFS及OS均显著获益,而年龄≥40岁的患者,PFS及OS的差异则无统计学意义。本研究结果提示对于绝经前乳腺癌,年龄仍是一个影响卵巢去势疗效的重要因素,目前未见关于年龄对在绝经前晚期乳腺癌患者中使用卵巢药物去势疗效影响的文献报道。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)乳腺癌治疗实践指南关于激素受体阳性的晚期乳腺癌推荐使用卵巢去势联合内分泌治疗,但是未提及最适宜年龄范围。根据本研究结果,对于绝经前激素受体阳性的晚期乳腺癌,年龄<40岁者可能是最适宜使用卵巢去势的群体,由于本研究样本量偏少,需要积累更多的资料进一步研究。
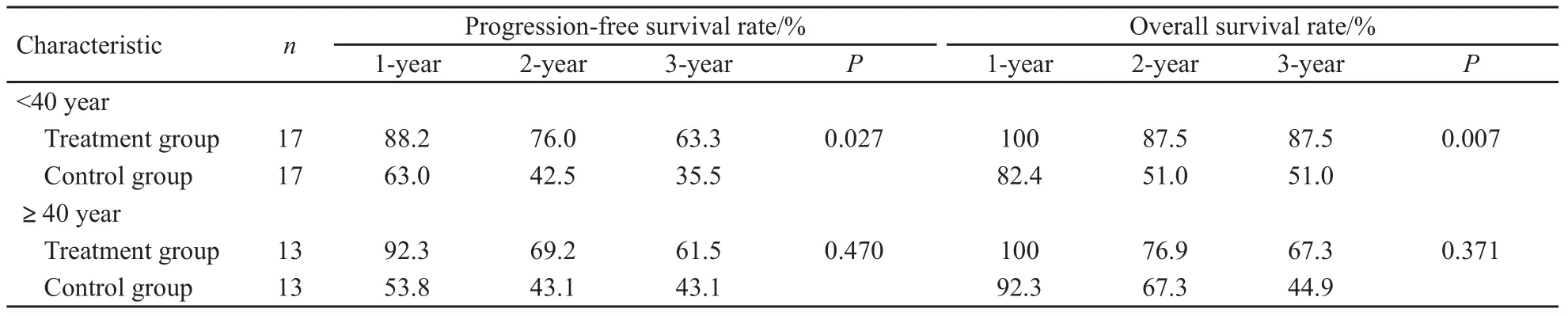
表2 年龄因素对戈舍瑞林疗效的影响Tab.2 Impact of age on the effect of goserelin
由于使用药物去势可使患者处于绝经期状态,因此为芳香化酶抑制剂的应用创造条件,戈舍瑞林联合阿那曲唑比和戈舍瑞林联合TAM能获得更长的中位临床获益期(12.1个月vs8.3个月,P=0.050 6)及中位生存时间(18.9个月vs14.3个月,P=0.000 1)[12]。姚舒洋等[13]的研究提示,戈舍瑞林联合阿那曲唑的临床获益率可以达到68.8%。Carlson等[14]的研究亦提示临床获益率达到71.9%,与本研究结果相似,这与阿那曲唑能进一步降低雌激素水平以及逆转戈舍瑞林联合TAM导致的卵泡刺激素下降有关[15]。本研究患者使用戈舍瑞林联合AI类的主要不良反应为潮热、骨关节不适和焦虑易怒等更年期综合征,提示戈舍瑞林联合AI类药物是安全的。本研究结果亦发现,对于使用戈舍瑞林联合内分泌治疗后出现疾病再次进展的患者,继续使用戈舍瑞林,相对于停药患者,虽然总生存时间差异无统计学意义(P=0.070),但有潜在受益(中位生存时间28.2个月vs7.0个月)。目前关于戈舍瑞林联合AI类治疗失败后继续用药的文献少见。Forward等[15]的研究指出在戈舍瑞林联合TAM治疗失败后,使用戈舍瑞林联合阿那曲唑6个月后的临床获益率可达到65%,中位治疗反应时间为17个月,但是获益程度较初次进展治疗低。结合本研究结果,提示在疾病再次进展后通过持续性抑制卵巢功能仍能使患者获益。
综上所述,基于本研究结果,建议戈舍瑞林联合内分泌药物治疗可作为年龄<40岁的绝经前晚期乳腺癌的标准内分泌治疗方法,对于出现疾病再次进展的患者,建议继续使用卵巢去势治疗,有助延长生存时间。
[1] CLEATOR S J, AHAMED E, COOMBES R C, et al. A 2009 update on the treatment of patients with hormone receptorpositive breast cancer[J]. Clin Breast Cancer, 2009,9(Suppl 1): 6-17.
[2] BOCCARDO F, RUBAGOTTI A, PERROTTA A, et al.Ovarian ablation versus goserelin with or without tamoxifen in pre-/perimenopausal patients with advanced breast cancer:results of a multicentric Italian study[J]. Ann Oncol, 1994,5(4): 337-342.
[3] KLIJN J G, BEEX L V, MAURIAC L, et al. Combined treatment with buserelin and tamoxifen in premenopausal metastatic breast cancer: a randomized study[J]. J Natl Cancer Inst, 2000, 92(11): 903-911.
[4] KLIJN J G, BLAMEY R W, BOCCARDO F, et al. Combined tamoxifen and luteinizing hormone-releasing hormone(LHRH) agonist versus LHRH agonist alone in premenopausal advanced breast cancer: a meta-analysis of four randomized trials[J]. J Clin Oncol, 2001, 19(2): 343-353.
[5] ROBERTSON J F, BLAMEY R W. The use of gonadotrophinreleasing hormone (GnRH) agonists in early and advanced breast cancer in pre- and perimenopausal women [J]. Eur J Cancer, 2003, 39(7): 861-869.
[6] EL SAGHIR N S, SEOUD M, KHALIL M K, et al. Effects of young age at presentation on survival in breast cancer [J].BMC Cancer, 2006, 6: 194.
[7] FOO C S, SU D, CHONG C K, et al. Breast cancer in young Asian women: study on survival[J]. ANZ J Surg, 2005,75(7): 566-572.
[8] GOLDHIRSCH A, GELBER R D, CASTIGLIONE M. The magnitude of endocrine effect of adjuvant chemotherapy for premenopausal breast cancer patients[J]. Ann Oncol, 1990,1(3): 183-188.
[9] TANCINI G, VALAGUSSA P, BAJETTA E, et al. Preliminary 3-year results of 12 versus 6 cycles of surgical adjuvant CMF in premenopausal breast cancer[J]. Cancer Clin Trials,1979, 2(4): 285-292.
[10] BERNHARD J, ZAHRIEH D, CASTIGLIONE-GERTSCH M,et al. Adjuvant chemotherapy followed by goserelin compared with either modality alone: the impact on amenorrhea, hot flashes, and quality of life in premenopausal patients-the International Breast Cancer Study Group Trial Ⅷ[J]. J Clin Oncol, 2007, 25(3): 263-270.
[11] The Adjuvant Breast Cancer Trials Collaborative Group.Ovarian ablation or suppression in premenopausal early breast cancer: results from the international adjuvant breast cancer ovarian ablation or suppression randomized trial[J]. J Natl Cancer Inst, 2007, 99(7): 516-525.
[12] MILLA-SANTOS A, MILLA L, PORTELLA J, et al. A randomized trial of goserelin + tamoxifen versus goserelin+ anastrozole in pre/perimenopausal patients with hormone dependent advanced breast cancer[J].Breast Cancer Res Treat, 2002, 76(supple1): 32.
[13] 姚舒洋, 徐兵河, 李青, 等. 戈舍瑞林联合阿那曲唑治疗晚期绝经前乳腺癌的临床观察[J].中华医学杂志, 2010,90(8): 526-528.
[14] CARLSON R W, THERIAULT R, SCHURMAN C M, et al.Phase Ⅱ trial of anastrozole plus goserelin in the treatment of hormone receptor-positive, metastatic carcinoma of the breast in premenopausal women[J]. J Clin Oncol, 2010, 28(25):3917-3921.
[15] FORWARD D P, CHEUNG K L, JACKSON L, et al. Clinical and endocrine data for goserelin plus anastrozole as secondline endocrine therapy for premenopausal advanced breast cancer[J]. Br J Cancer, 2004, 90(3): 590-594.

