原发性输卵管癌22例诊断分析
黄建琴 王莉 朱芝玲
复旦大学附属妇产科医院中西医结合科,上海 200090
原发性输卵管癌是少见的妇科恶性生殖道肿瘤,约占女性生殖道恶性肿瘤的0.3%~1.8%[1-4],至今英文文献报道较少,且该病症状极不典型,是最难确诊的恶性肿瘤之一[5]。2009年1月1日—2010年12月31日复旦大学附属妇产科医院收治原发性输卵管癌患者共33例,其中仅11例术前诊断为输卵管肿瘤,本研究即对术前未诊断的原发性输卵管癌22例进行分析总结,以提高临床诊断率。
1 资料和方法
1.1 一般资料
22例患者年龄43~76岁,中位年龄60岁。绝经后15例。4例患者合并有子宫内膜癌,经病理证实为双原发灶。22例患者均曾妊娠,21例患者曾生育,1例患者曾妊娠未生育,6例患者产次2次,3例患者产次3次,1例患者产次4次,平均产次1.7次。既往史中1例患者曾行2次双输卵管整形通液术,3例患者行双输卵管结扎术。
1.2 临床表现
22例患者中,12例有腹水(腹水量约50~6 500 mL,淡黄色4例,血性3例,5例未描述颜色),腹水及腹冲液送检,1例血性腹水中找到少量恶性细胞,1例淡黄色腹水中找到少量可疑细胞(表1)。输卵管癌三联征(阴道排液、腹痛和附件包块)仅1例,输卵管癌二联征(附件包块合并阴道排液)2例,另1例阴道排液者术前未提示盆腔包块,所有阴道排液和阴道流血患者均未取阴道排出液体行细胞学检查。
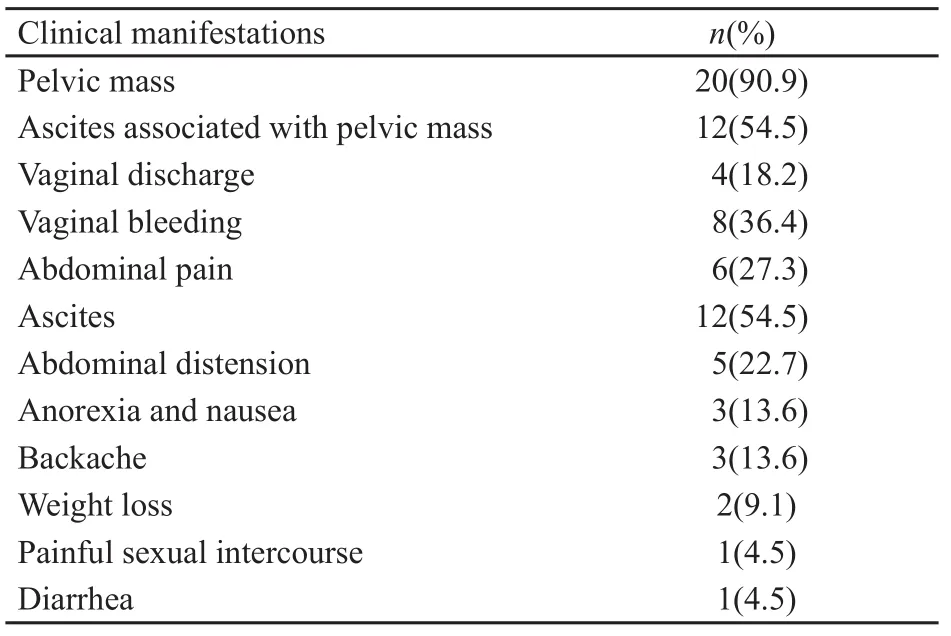
表1 22例原发性输卵管癌患者的临床表现Tab.1 Clinical manifestations of the 22 patients
1.3 术前诊断方法
术前未诊断的22例原发性输卵管癌患者中,治疗前18例患者行CA125检测, 1例患者行CEA检查,1例患者行铁蛋白检测。 所有患者均行B超检查。5例患者术前行CT、MRI和PET影像学检查,同时对所有患者行术后病理检查。
1.4 治疗
22例患者均行手术治疗,2例患者术前TP方案化疗2次后再手术。22例患者中2例行全子宫+双附件切除;5例行全子宫+双附件+大网膜(或加阑尾)切除;1例行全子宫+双附件+盆腔淋巴结清扫;13例行全子宫+双附件+大网膜(或加阑尾)切除+盆腔淋巴结清扫;1例行全子宫+双附件+大网膜+阑尾切除+盆腔淋巴结清扫+腹主动脉旁淋巴结清扫术。腹腔镜手术6例。除2例患者术后拒绝化疗签字后出院外,余20例患者均行TP方案(紫杉醇+铂类)化疗,1例患者曾用恩度腹腔用药。
2 结 果
2.1 术前诊断结果
对术前22例患者主要根据临床表现并结合B超等影像学及肿瘤标志物等进行诊断,诊断结果见表2。

表2 术前诊断结果Tab.2 Diagnosis of the patients before operation
2.2 术前肿瘤标志物及影像学检查
在18例行血清CA125检测的患者中,CA125>1 000 U/mL 2例,>35~1 000 U/mL 12例,正常4例。Ⅰ期CA125升高者2/3(1例治疗前未查CA125),Ⅱ期CA125升高者3/6(1例治疗前未查CA125),Ⅲ期CA125升高者9/9(2例治疗前未查CA125)。检查CA199的患者中仅2例异常(70.00 U/mL和65.18 U/mL)。检查CEA的患者中仅1例异常(37.44 ng/mL)。治疗前仅1例患者行铁蛋白检测,指标升高(879.4 μg/L,正常参考值为11.0~306.8 μg/L),而该患者术前诊断为子宫肌瘤,术中输卵管形态正常,冰冻病理提示输卵管癌。
B超检查提示20例有盆腔包块,最大直径约10 cm,最小直径约1 cm,彩色多普勒探及肿块见有丰富的血流3例。2例患者术前诊断为子宫肌瘤,未提示附件区包块,术中输卵管形态正常,1例冰冻病理提示输卵管癌,1例冰冻病理提示卵巢腺癌,术后病理诊断为输卵管癌。5例患者术前行CT、MRI和PET影像学检查,均未提示输卵管肿瘤可能。
2.3 临床表现及术后病理
本组患者盆腔包块占90.9%,腹水占54.5%,盆腔包块伴发腹水占54.5%,出血占36.4%,腹痛占27.3%,腹胀占22.7%,纳差恶心占13.6%,阴道排液占18.2%,腰酸占13.6%,体质量下降占9.1%,性交痛占4.5%,腹泻占4.5%(表1)。输卵管癌三联征发生仅1例(4.5%),输卵管癌三联征发生2例(9.1%)。
术后病理证实输卵管肿瘤双侧发病者7例,单侧15例。术后病理Ⅰ期4例,Ⅱ期7例,Ⅲ期11例。术后病理类型腺癌21例(其中浆液性腺癌17例,1例部分嗜酸性细胞腺癌,3例未具体细分),1例左输卵管癌肉瘤(癌成分为低分化浆液性腺癌、内膜样腺癌、鳞状细胞癌),其右输卵管局灶浆液性腺癌。分化程度低分化16例,中分化5例,1例左输卵管癌肉瘤低分化,右输卵管局灶浆液性腺癌高分化。
3 讨 论
由于医疗技术的日益发展和人们对输卵管肿瘤早期诊断的重视,目前原发性输卵管癌术前诊断率为25%~35%[6]。本院33例输卵管癌术前诊断11例,诊断率为33.3%,术中诊断率为72.7%,也充分体现了这一点。
原发性输卵管癌大多发生在40~60岁女性,中位年龄55岁[7];本组患者年龄43~76岁,中位年龄60岁,与以往报道类似。超过60%的输卵管癌发生于绝经后妇女[8],本组绝经后妇女占68.2%,可见绝经后妇女为发病高危人群,应加强该人群的普查和重视。Inal等[9]研究发现,妊娠和口服避孕药可减少原发性输卵管癌的发病率。也有学者研究发现,原发性输卵管癌的发生与年龄、种族、体质量、教育程度、盆腔炎症疾病、不孕、全子宫切除、子宫内膜炎、耐乳糖综合征和吸烟等因素无关[9-10]。本组患者均曾妊娠,且多位患者产次2~4次,妊娠与该病发生是否相关尚需大样本研究证实。此外输卵管癌、卵巢癌及子宫内膜癌均存在c-crbB-2和p53基因变异,故认为其病因很可能与卵巢癌及子宫内膜癌的一些致病因素相关[6],本组患者中有4例经病理证实合并有子宫内膜癌(占18.2%),提示子宫内膜癌与原发性输卵管癌致病因素可能存在相关性,值得进一步研究。
高丽欣[6]回顾20年文献指出,阴道排液或流血、腹痛是原发性输卵管癌最常见的症状,盆腔包块是其最常见的体征占65%,盆腔包块伴发腹水仅15%。未孕者27.5%,平均产次为1.7次,疼痛表现较突出。洪哲[11]分析原发性输卵管癌26例,其中以盆腔包块最为常见24例 (92.30%),阴道排液l4例(53.84%),腹水7例(26.92%),腹痛5例(19.23%),出血2例(7.69%)。Ajithkumar等[12]研究发现,输卵管癌三联征发生率为15%。本组输卵管癌三联征和二联征发生率也较低,可见输卵管癌临床表现的多样性和不典型性,这也是导致输卵管癌术前难诊断的重要原因。
虽然CA125不是输卵管癌诊断的特异性指标,但>80%的患者术前CA125升高[12]。Gadducci等[13]报道术前CA125>35 U/mL患者占85.3%(Ⅰ~Ⅱ期占68.7%,Ⅲ~Ⅳ期占94.7%)。本组18例患者治疗前检测血清CA125,14例升高占77.8%(Ⅰ期占66.7%,Ⅱ期占50%,Ⅲ期则为100%)。与既往报道类似。因此应重视CA125在该病早期诊断中的作用。
铁蛋白是一种带有铁离子的溶性蛋白,主要分布于肝、脾及骨髓等组织细胞中。许多实体恶性肿瘤,如肝癌、肺癌及卵巢癌等,血清中铁蛋白检测均有一定程度升高。这可能与肿瘤组织在生长过程中变性坏死,贮存于组织中的铁蛋白、肿瘤组织分泌的铁蛋白或异常铁蛋白进入血液循环有关[14-15]。本组患者术前未常规检测铁蛋白,但少数几例检测者中铁蛋白均明显升高。因此铁蛋白对于原发性输卵管癌的早期诊断有一定的作用,具体价值需待临床和实验研究进一步明确。
B超是诊断输卵管癌的主要影像学技术[18],但输卵管癌的超声图像是非特异性的,与输卵管卵巢脓肿、卵巢肿瘤和异位妊娠相似。
分析临床资料,回顾文献后将提高原发性输卵管癌诊断率的重要而确实的途径和方法总结如下:⑴重视血清CA125和铁蛋白的测定,血清CA125和铁蛋白虽无特异性,但可作为诊断的参考指标。⑵细胞涂片检查是最有价值的术前诊断方法,有阴道排液时,取宫腔液或在腹腔镜下于输卵管开口处吸液涂片,如细胞学涂片检查阳性,诊刮又排除子宫内膜癌时,为输卵管癌的诊断成立[17]。有阴道排液者应尽可能作细胞学检查。⑶必要时行腹腔镜检查。腹腔镜可直视盆腔的各脏器,有利于了解输卵管形态,并可做活检。
[1] MONGE A H, PINEDA R P, DEL ROCIO ESTRADA HERNANDEZ M, et al. Fallopian tube primary invasive adenocarcinoma associated with acute in flammatory pelvic disease. Case report and literature review [J]. Ginecol Obstet Mex, 2008, 76(2): 118-124.
[2] DIMITRIOS P, EIRINI P, THEOFANIS E. Fallopian tube carcinoma: a review [J]. Oncologist, 2006, 11: 902-912.
[3] ROBERTS J A, LIFSHITZ S. Primary adenocarcinoma of the fallopian tube [J]. Gynecol Oncol, 1982, 13: 301-308.
[4] RISKA A, LEMINEN A, PUKKALA E. Sociodemographic determinants of incidence of primary fallopian tube carcinoma,Finland 1953-1997 [J]. Int J Cancer, 2003, 104: 643-645.
[5] KOO Y J, KWON Y S, LIM K T, et al. Para-aortic lymphadenectomy for primary fallopian tube cancer [J]. Int J Gynecol Obstet, 2011, 112: 18-20.
[6] 高丽欣.原发性输卵管癌[J]. 国外医学计划生育/生殖健康分册, 2006, 25(2): 99-101.
[7] SEDLIS A. Carcinoma of the fallopian tube [J]. Surg Clin North Am, 1978, 58: 121-129.
[8] FIGO/IGCS妇科恶性肿瘤分期及临床实践指南(五): 输卵管癌 [J]. 国际妇产科学杂志, 2008, 35(5): 389-390.
[9] INAL M M, HANHAN M, PILANCI B, et al. Fallopian tube malignancies: experience of Social Security Agency Aegean Maternity Hospital [J]. Int J Gynecol Cancer, 2004, 14:595-599.
[10] DEMOPOULOS R I, ARONOV R, MESIA A. Clues to the pathogenesis of fallopian tube carcinoma: a morphological and immunohistochemical case control study [J]. Int J Gynecol Pathol, 2001, 20: 128-132.
[11] 洪哲.原发性输卵管癌26例临床分析[J]. 交通医学,2009,23(3): 298-299.
[12] AJITHKUMAR T V, MINIMOLE A L, JOHN M M, et al.Primary fallopian tube carcinoma [J]. Obstet Gynecol Surv,2005, 60: 247-252.
[13] GADDUCCI A, LANDONI F, SARTORI E, et al. Analysis of treatment failures and survival of patients with fallopian tube carcinoma: a cooperation task force (CTF) study [J].Gynecol Oncol, 2001, 81: 150-159.
[14] 李世生. 肿瘤相关糖类抗原CA125、CA153、铁蛋白联合测定对卵巢肿瘤的诊断价值[J]. 广西医科大学学报,2009, 26(6): 889-890.
[15] 肖静坤, 李桂彩. 三种恶性肿瘤血清铁蛋白浓度及阳性率的分析[J]. 湖南医学高等专科学校学报, 2003, 5(4): 42-77.
[16] VAN N J J, HIGGINS R V, DONALDSON E S, et al.Transvaginal sonography as a screening method for ovarian cancer. A report of the first 1000 cases screened [J].Cancer, 1990, 65: 573-577.
[17] 王淑贞. 妇产科理论与实践[M]. 上海: 上海科学技术出版社, 1985: 529.

