HIF-1α、HSP90在胰腺癌组织芯片中的表达及其临床意义
干文娟 冯一中 李峰
1.苏州大学附属第一医院病理科,江苏 苏州 215006;2.苏州大学医学部病理学系,江苏 苏州 215123;3.苏州大学附属第二医院病理科,江苏 苏州 215004
缺氧是实体肿瘤生长过程中普遍存在的一种现象,肿瘤细胞的侵袭性和远处转移性与缺氧有关,介导缺氧反应的主要调节者是缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1),HIF-1由HIF-1α和HIF-1β两个亚基组成。其中HIF-1a是HIF-1的活性亚基,在肿瘤的发生和发展和预后预测中具有重要意义,目前对于HIF-1α在胰腺癌中表达情况的研究国内外还鲜见报道。热休克蛋白(heat shock protein,HSP)是生物体中普遍存在的高度保守的蛋白质,其主要的生物学功能是在应激状态下与靶蛋白形成复合体,以调节靶蛋白的活性和功能,但又不参与靶蛋白的组成。因此,HSP又被称为“分子伴侣”或“伴侣蛋白”。HSP90是分子伴侣中一组较为独特的蛋白质,除了作为分子伴侣参与蛋白质的折叠、运输和合成过程以外,还能和一系列参与肿瘤发生发展的信号转导系统中的激酶分子和突变蛋白质相结合,并调节它们的稳定性,从而影响多种信号转导途径。
HSP90在胰腺癌中的过表达可能参与了胰腺癌的发生、发展和转移[1]。本研究利用组织芯片技术结合免疫组化方法检测胰腺癌组织中HIF-1α、HSP90蛋白的表达及其与胰腺癌临床病理参数之间的关系,探讨HIF-1α、HSP90在胰腺癌发生过程中的作用及对预后的影响。
1 资料和方法
1.1 临床资料
收集本校附属医院及部分外院1993年—2007年胰腺癌手术标本和临床资料齐备者88例,所有患者均未给予术前放疗、化疗,且肿瘤组织均制备组织切片并行HE染色,并由2名病理医师采用双盲法确诊为胰腺导管腺癌,其中位于胰头者64例,胰体尾部者24例;男性59例,女性29例,年龄39~80岁,中位年龄62.50岁;肿瘤直径≤4 cm者45例,>4 cm者43例;按照1997年国际抗癌协会(UICC)制定的TNM临床分期标准进:Ⅰ期29例,Ⅱ期11例,Ⅲ期27例,Ⅳ期21例。组织学分级为:高分化腺癌17例,中分化腺癌50例,低分化腺癌21例;伴有淋巴结转移者39例,无淋巴结转移者49例。88例患者中有53例获得随访资料,随访时间为2个月~6年,平均随访时间为(13.32±10.35)个月。其中死亡数为48例,生存(截尾数据) 数为5例。另外选取11例同时期非肿瘤性胰腺组织手术标本作为对照。
1.2 方法
1.2.1 组织芯片的制作
标本均为4%甲醛溶液固定,常规组织处理、石蜡包埋。采用手工制作组织芯片,所用组织芯片制作仪为Instrumendics公司产品,取样针直径1.5 mm,组织芯间距1.0 mm。组织芯片制作步骤见文献[2]。
1.2.2 免疫组织化学检测
对HIF-1α、HSP90分别采用SABC法、EnVision染色法,染色步骤按产品说明书进行,DAB显色,一抗HIF-1α多克隆抗体(BA-0912)及二抗生物素化羊抗兔IgG抗体均购自Santa Cruz公司,HIF-1α抗体的工作浓度为1∶50,羊抗兔IgG抗体为即用型抗体。HSP90α/β(N-17)多克隆抗体购自美国Santa Cruz公司,工作浓度为1∶100,即用型EnVision试剂(HRP/Rabbit)购于丹麦Dako公司。用PBS代替一抗作为阴性对照,用已知阳性的胰腺癌切片作为阳性对照。
1.2.3 免疫组织化学阳性结果判定
用双盲法由2位有经验的病理医师分别对免疫组化染色结果进行评估。镜检显示胞质或胞核染为淡黄色至棕黄色为阳性细胞标志。HIF-1α蛋白的阳性染色主要定位于细胞质,少数定位于细胞核,HSP90在细胞的胞质及胞核均有表达,以胞核表达为主。在高倍镜(×400)下对每张切片随机选择5个视野,每个视野计数200个细胞,共计1 000个。参照Gustavo等[3]的方法,综合染色强度和阳性细胞占总细胞数的百分比进行半定量处理;根据染色强度的评分标准为:没有染色为0分;弱染色但强于阴性对照为1分;中度染色为2分;强染色为3分;根据阳性细胞数的评分标准为:无阳性细胞数为0分;不足34%阳性细胞数为1分;34%~66%阳性细胞数为2分;>66%阳性细胞数为3分。上述评分结果两项相乘,0~6分为低表达,>6分为高表达。
1.3 统计学处理
统计软件使用SPSS 13.0软件包。HIF-1α、HSP90蛋白在非肿瘤性胰腺组织及胰腺癌各临床参数之间表达差异的比较采用四格表资料的χ2检验。用Spearman秩相关进行HIF-1α、HSP90蛋白表达的相关性分析。对有随访资料的HIF-1α、HSP90的表达作出Kaplan-Meier生存曲线,各组间生存率用log-rank检验进行组间生存率的比较,HIF-1α、HSP90的表达与预后的关系采用单因素Cox回归模型进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 组织芯片
成功制备胰腺癌组织芯片蜡块1个,为11×9点组织列阵,含99个位点,无组织芯脱落(图1A)。组织芯片切片HE染色显示所有位点组织结构保存良好,无明显坏死组织,组织芯片排列整齐(图1B)。
2.2 HIF-1α与HSP90蛋白表达
2.2.1 HIF-1α蛋白表达
胰腺癌组织中HIF-1α蛋白主要定位于癌细胞胞质和胞核,以胞质着色为主(图2A),非肿瘤性胰腺组织均无HIF-1α表达。88例胰腺癌中有67例HIF-1α高表达(76.1%),而对照组胰腺组织中HIF-1α表达阴性,差异具有统计学意义(χ2=25.910,P<0.001)。HIF-1α高表达与肿瘤大小、TNM分期及淋巴结转移相关(P<0.01,表1)。
图1 组织芯片图Fig.1 Tissue microarray
2.2.2 HSP90蛋白表达
胰腺癌组织中HSP90蛋白主要定位于癌细胞胞质和胞核,以胞核着色为主(图2B)。本组患者HSP90蛋白在胰腺癌中高表达率为73.9%,在非肿瘤性胰腺组织中高表达率为18.2%,两组差异有统计学意义(χ2=13.858,P<0.001)。HSP90高表达与肿瘤TNM分期及淋巴结转移相关(P<0.01);而与肿瘤大小、部位、病理分级无关(P>0.05,表1)。
2.2.3 HIF-1α、HSP90在胰腺癌中表达的相关性
Spearman秩相关分析显示,在胰腺癌中,HIF-1α与HSP90表达呈显著正相关(P<0.01,表2)。
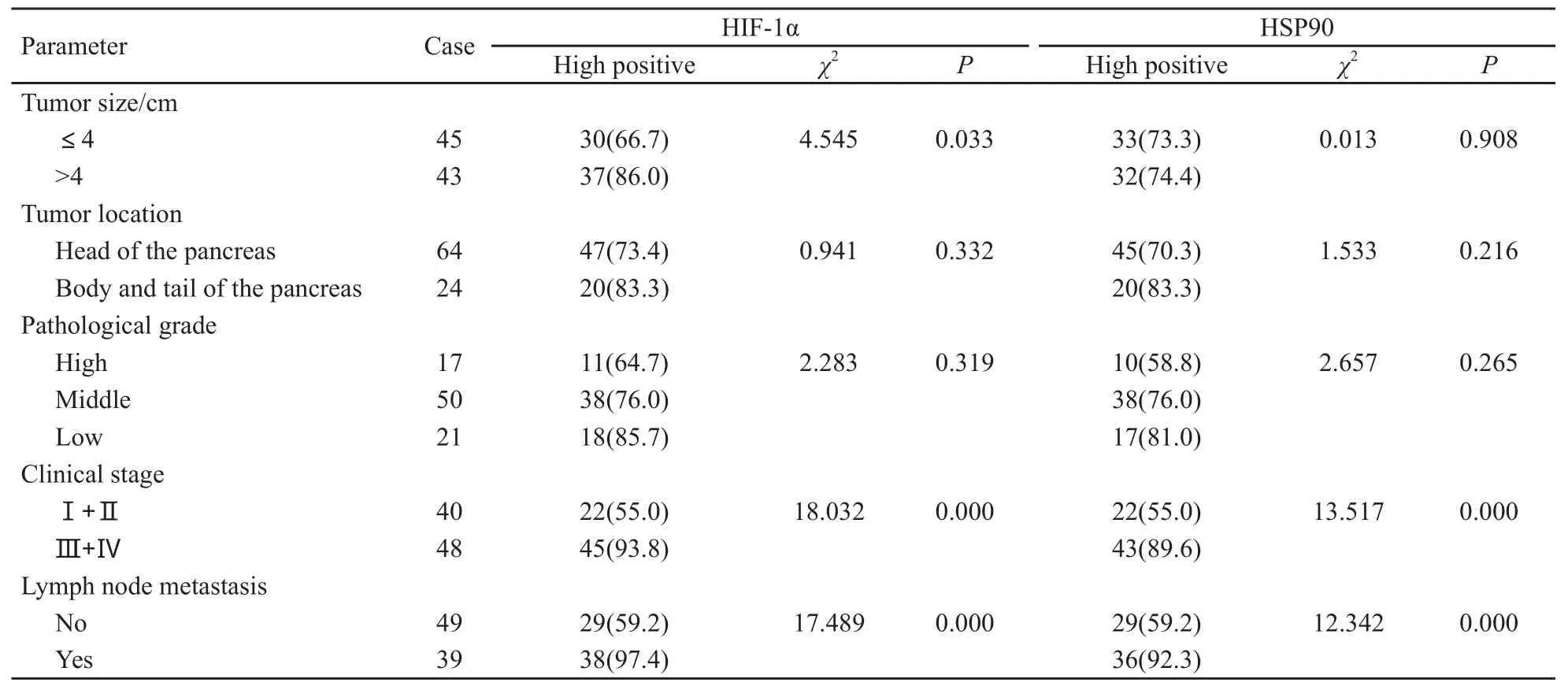
表1 HIF-1α和HSP90的表达与胰腺癌患者临床病理特征之间的关系Tab.1 The relationship between HIF-1α and HSP90 expression and clinical pathological characteristics of pancreatic carcinoma patients[n(%)]
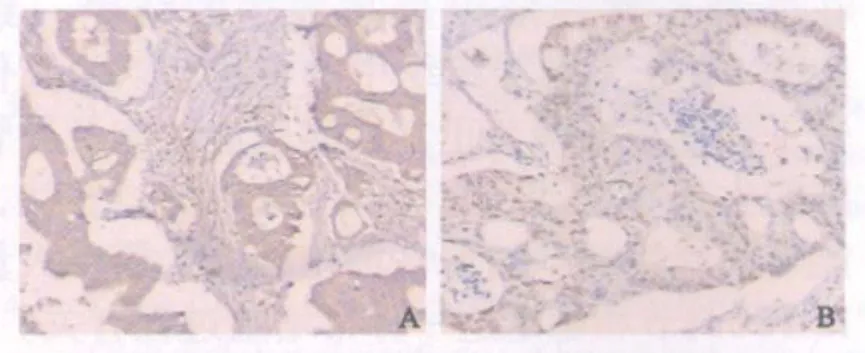
图2 HIF-1α和HSP90在胰腺癌中阳性表达Fig.2 Positive expression of HIF-1α and HSP90 in pancreatic carcinoma

表2 胰腺癌中HIF-1α、HSP90的相关性分析Tab.2 Correlation analysis of HIF-1α and HSP90 in the pancreatic carcinoma
2.3 HIF-1α、HSP90表达与胰腺癌患者生存期的关系
对53例获得随访结果的胰腺癌患者进行Kaplan-Meier生存分析,结果显示HIF-1α低表达组患者的总生存率明显高于各自高表达组,用log-rank检验进行组间生存率检验结果显示,HIF-1α组间生存率差异有统计学意义(χ2=13.098,P<0.001),即HIF-1α高表达与胰腺癌预后不良有关,而HSP90的高表达组与低表达组在Kaplan-Meier曲线中有相交点,log-rank检验组间生存率差异无统计学意义(χ2=3.068,P=0.08,图3、4)。
经Cox比例风险回归模型分析,单因素分析显示,HIF-1α表达可作为评估胰腺癌患者预后的指标(表3)。
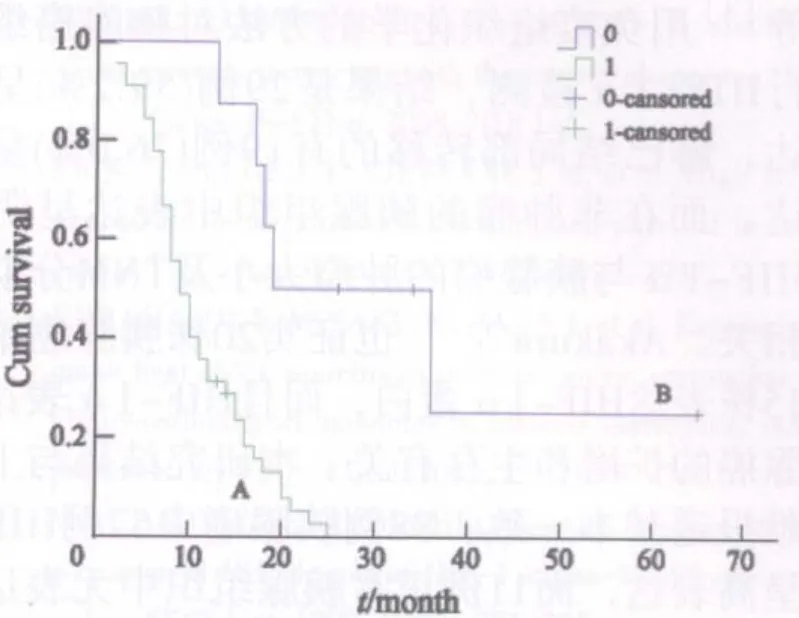
图3 HIF-1α表达与生存期的关系Fig.3 Relationship of HIF-1α expression and life span
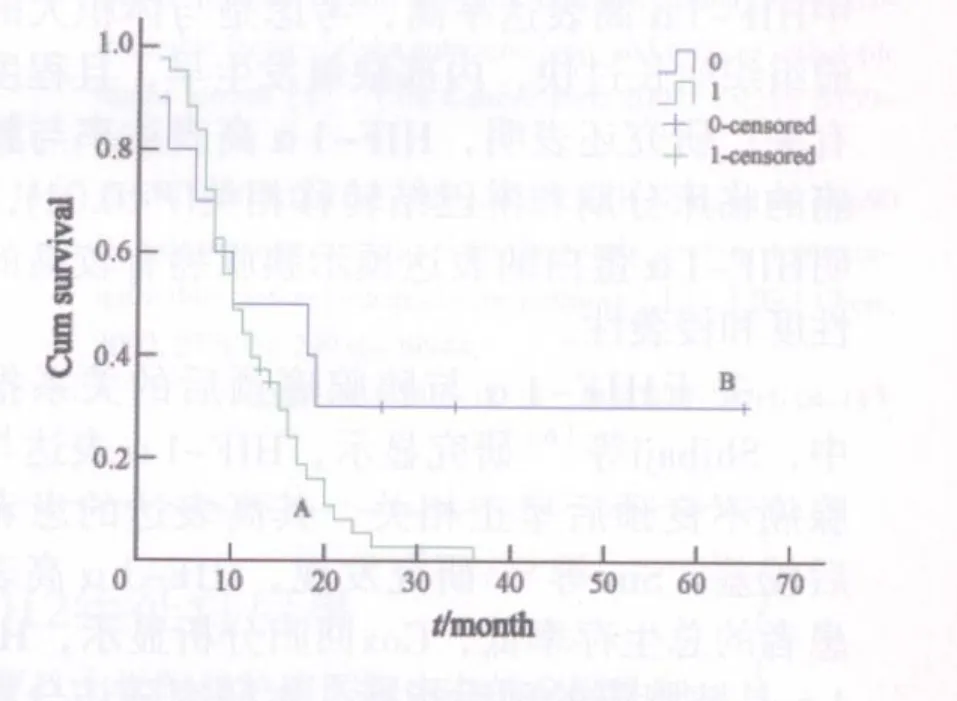
图4 HSP90表达与生存期的关系Fig.4 Relationship of HSP90 expression and life span
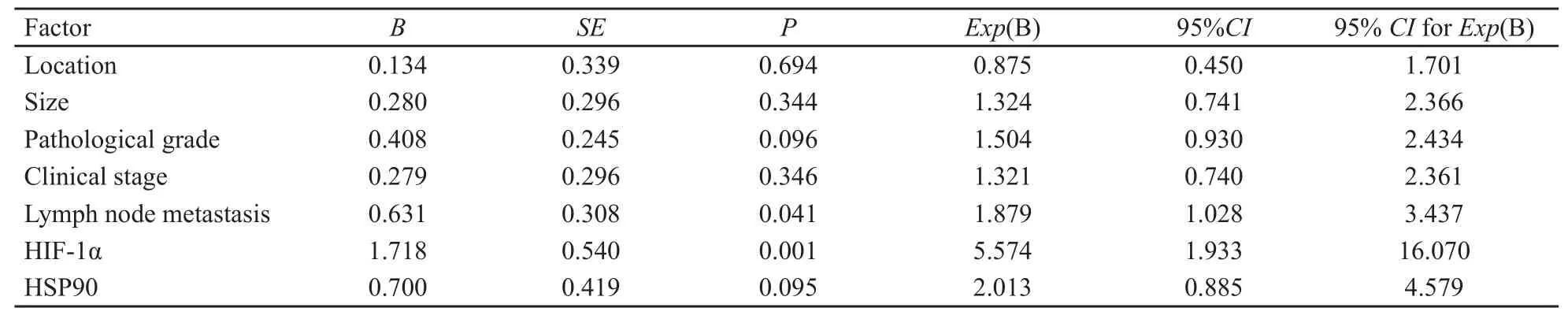
表3 胰腺癌单因素生存(COX比例风险模型分析)结果Tab.3 Univariate survival result of pancreatic carcinoma (Cox rate risk model analysis)
3 讨 论
缺氧是肿瘤微环境的基本特征之一,同时肿瘤细胞的缺氧也是肿瘤发生恶性转化甚至转移的启动因子。HIF-1α是调节细胞内氧代谢的关键因子之一,也是迄今发现的惟一能在特异性缺氧状态下发挥活性作用的转录因子。
HIF-1α在胰腺癌中存在高表达。Kitada等[4]用免疫组织化学的方法对胰腺癌组织进行HIF-1α检测,结果是29例(59.2%)呈过表达,淋巴结局部转移的有19例(76.0%)呈过表达,而在非肿瘤的胰腺组织中表达呈阴性,HIF-1α与胰腺癌的肿瘤大小及TNM分期显著相关。Akakura等[5]也证实20株胰腺癌细胞有15株表达HIF-1α蛋白,而且HIF-1α表达与胰腺癌的扩增和生存有关。本研究结果与上述文献报道基本一致:88例胰腺癌中67例HIF-1α呈高表达,而11例正常胰腺组织中无表达,其差异有统计学意义(P<0.01)。HIF-1α高表达率与胰腺癌的大小相关(P<0.01),即表明大多数胰腺癌组织存在着缺氧,在体积大的肿瘤组织中HIF-1α高表达率高,考虑是与体积大的肿瘤组织生长过快,内部缺氧发生早,且程度重有关;研究还表明,HIF-1α高表达率与胰腺癌的临床分期和淋巴结转移相关(P<0.01),表明HIF-1α蛋白的表达预示胰腺癌有较高的恶性度和侵袭性。
关于HIF-1α与胰腺癌预后的关系报道中,Shibaji等[6]研究显示,HIF-1α表达与胰腺癌不良预后呈正相关,其高表达的患者预后较差。Sun等[7]研究发现,HIF-1α高表达患者的总生存率低,Cox回归分析显示,HIF-1α是胰腺癌的预后指标。本研究随访分析结果显示,HIF-1α高表达者预后较差,HIF-1α高表达与低表达生存曲线差别具有统计学意义(P<0.01),经单因素、多因素Cox比例风险回归模型分析显示,HIF-1α表达具有独立预后意义(P<0.05),即HIF-1α高表达与胰腺癌不良预后有关,本组实验结果与文献报道相一致,由此可见,快速生长的胰腺癌细胞可产生过量的HIF-1α,激活多种靶基因的转录,提高能量代谢及血管形成体系,使之适应这一缺氧环境而继续增殖、浸润和转移。因此,HIF-1α的表达可反映胰腺癌的生物学行为,可以作为判断胰腺癌浸润、转移和预后的有价值指标。
至今已经发现HSP90在多数肿瘤中呈高表达。Ogata等[8]报道胰腺癌中HSP90a呈选择性高表达,且与肿瘤的致癌作用有关。Kim等[9]研究结果表明,HSP90抑制剂选择性阻止了胰腺癌细胞的生长和扩增,可见HSP90与胰腺癌有着密切的联系。本研究结果显示:HSP90在胰腺癌组织中的表达水平显著高于正常胰腺组织(P<0.01),这一结果与各文献中报道的HSP90在多种恶性肿瘤中呈高表达的结论一致。HSP90在正常胰腺组织中的表达,认为其作为分子伴侣参与调节正常胰腺腺泡细胞及导管细胞的生长和增殖;而在胰腺癌中的过表达,可能与胰腺癌细胞的恶性增殖相关,需要大量的HSP90调节和稳定这一异常增殖过程有关。
目前对于HSP90与肿瘤病理参数及预后的关系报道不一。Pick等[10]研究认为,HSP90与乳腺癌的病理分级、肿瘤大小、淋巴结转移相关,是乳腺癌独立的预后指标。而Kurahashi等[11]对172例前列腺标本进行免疫组化检测,发现HSP90与病理分级、淋巴结转移、肿瘤大小无关。本研究结果显示:胰腺癌中临床分期越晚的HSP90表达越高,有淋巴结转移组HSP90表达比无淋巴结转移组高,差异有统计学意义(P<0.01),提示HSP90与胰腺癌的侵袭、转移能力有一定的相关性。本研究结果还显示:HSP90与胰腺癌的病理分级无关,可能与HSP90表达存在着组织差异性有关;HSP90的表达与胰腺癌患者预后无关,可能与HSP90作为分子伴侣的功能有关,其机制有待进一步论证。
有关HIF-1α和HSP90的关系报道不多,Minet等[12]研究认为在缺氧条件下,HSP90与HIF-1α的bHLH-PAS 结构域结合来激活HIF-1α,而且HSP90的活性对于HIF-1α的激活作用是必须的。Lang等[13]研究结果表明,HSP90抑制剂17-AAG阻止了胰腺癌IL-6/STAT3/HIF-1α自分泌环,抑制了肿瘤的生长。Jennifer等[14]使用VHL功能缺失的肾癌细胞株RCC进行实验,发现了HSP90抑制剂的功能:⑴通过氧非依赖E3泛素连接酶促进了HIF-1α降解。⑵减少了HIF-1α转录活性。由此可以推断,HSP90与HIF-1α的降解和转录活性有关。本研究结果显示,HIF-1α和HSP90联合表达与胰腺癌的临床分期、淋巴结转移相关。
随着研究的不断深入,目前已将HIF-1α、HSP90作为治疗各类肿瘤的靶点,如HIF-1α516、格尔德霉素(geldanamycin,GA)等已进入临床试验,本研究结果为研发药物来干预和治疗胰腺癌提供了理论依据。
[1] 刘峰, 干文娟, 冯一中. HSP90在胰腺癌组织芯片中的表达及临床意义[J]. 中国血液流变学杂志, 2009, 19(1): 125-127.
[2] 朱明华.组织微阵列及其在肿瘤病理研究中的应用[J].中华病理学杂志, 2002, 31: 72-74.
[3] GUSTAVO A, TIMOTHY T, GUANG Y, et al. High levels of phosphorylated form of Akt-1 in prostate cancer and nonneoplastic prostate tissues are strong predictors of biochemical recurrence[J]. Clin Cancer Res, 2004, 10: 6572-6578.
[4] KITADA T, SEKI S, SAKAGUCHI H, et al.Clinicopathological significance of hypoxia-inducible factor-1alpha expression in human pancreatic carcinoma[J].Histopathology, 2003, 43(6): 550-555.
[5] AKAKURA N, KOBAVASHI M, HORIUCHI I, et al.Constitutive expression of hypoxia-inducible factor-1 alpha renders pancreatic cancer cells resistant to apoptosis induced by hypoxia and nutrient deprivation[J]. Cancer Res, 2001,61(17): 6548-6554.
[6] SHIBAJI T, NAGAO M, IKEDA N, et al. Prognostic significance of HIF-1 alpha overexpression in human pancreatic[J]. Anticancer Res, 2003, 23(6C): 4721-4727.
[7] SUN H C, QIU Z J, LIU J, et al. Expression of hypoxiainducible factor-1 alpha and associated proteins in pancreatic ductal adenocarcinoma and their impact on prognosis[J].Int J Oncol, 2007, 30(6): 1359-1367.
[8] OGATA M, NAITO Z, TANAKA S, et al. Overexpression and localization of heat shock proteins mRNA in pancreatic carcinoma[J]. J Nippon Med Sch, 2000, 67(3): 177-185.
[9] KIM H L, CASSONE M, JR L O, et al. HIF-1α and STAT3 client proteins interacting with the cancer chaperone Hsp90[J]. Cancer Biol Ther, 2008, 7(1): 1-5.
[10] PICK E, KLUGER Y, GILTNANE J M, et al. High HSP90 expression is associated with decreased survival in breast cancer[J]. Cancer Res, 2007, 67(7): 2932-2937.
[11] KURAHASHI T, MIYAKE H, HARA I, et al. Expression of major heat shock proteins in prostate cancer: correlation with clinicopathological outcomes in patients undergoing radical prostatectomy[J]. J Urol, 2007, 177(2): 757-761.
[12] MINET E, MOTTET D, MICHEL G, et al. Hypoxia-induced activation of HIF-1: role of HIF-1αlpha-Hsp90 interaction[J]. FEBS Lett, 1999, 460(2): 251-256.
[13] LANG S A, MOSER C, GAUMANN A, et al. Targeting heat shock protein 90 in pancreatic cancer impairs insulin-like growth factor-I receptor signaling, disrupts an interleukin-6/signal-transducer and activator of transcription 3/hypoxiainducible factor-1alpha autocrine loop, and reduces orthotopic tumor growth[J]. Clin Cancer Res, 2007, 13(21): 6459-6468.
[14] JENNIFER S I, YUN-JIN J, EDWARD G M, et al. Hsp90 Regulations a von hippel lindau-independent hypoxiainducible factor-1-degradative pathway[J]. J Biol Chem,2002, 277(33): 29936-29944.

