肺结核患者外周血单核细胞中差异表达miRNA的筛选
张立群 孙照刚 高孟秋 马丽萍 吴晓光 刘菲
结核分枝杆菌是导致全球1/3人口感染结核病的致病菌,到目前为止,对它的致病机制还未完全阐明。miRNA是一类广泛存在于真核细胞当中,长度约20nt的高度保守的微小的RNA分子,通过与对应的靶 mRNA 的3′非翻译区(3′untranslated region,3′UTR)的非完全或完全配对结合,阻止其翻译或破坏其稳定性,实现对基因表达的调控。研究表明miRNA在肿瘤、糖尿病和艾滋病等多种疾病中都起着重要作用[1-2]。
而有关miRNA在结核病发病机制中的研究却少有报道。本研究应用miRNAs芯片筛选出肺结核患者和正常人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)中差异表达的miRNA,为进一步研究这些差异表达的miRNA在结核病发病机理中的作用打下基础。
材料和方法
一、研究对象
肺结核患者共10例,痰抗酸杆菌阳性或临床及影像学符合肺结核诊断,其中痰集菌(即收集患者24h痰,离心沉渣涂片抗酸染色找结核分枝杆菌)及培养阳性6例,根据临床和影像学诊断肺结核4例。其中男6例,女4例,年龄18~55岁,平均年龄(35.2±14.4)岁,这10例患者均初次诊断为肺结核并未经过抗结核治疗。正常对照组10名,来自体检正常人群,结核菌素试验(PPD)阴性,其中男6名,女4名,年龄20~55岁,平均年龄(28.5±5.2)岁。
二、实验试剂
miRNA分离试剂盒购自美国应用生物系统公司(Applied Biosystems),miRNA标记及杂交试剂盒、洗脱缓冲液均购于美国安捷伦公司(Agilent),无RNA 酶的 DNA 酶(RNAsae-Free DNase)购自德国凯奇公司(Qiagen),人miRNA芯片采用安捷伦公司产品(型号G4470B)。
三、实验方法
1.RNA抽提和质量检测:采集10例肺结核患者及10名正常对照者外周血5ml/人,枸橼酸钠抗凝。淋巴细胞分离液分离PBMC,分别将肺结核患者组和健康对照组的PBMC混合,加入Trizol裂解,根据RNA提取试剂盒(mirVana RNA Isolation Kit,Ambion)的操作步骤提取总RNA和miRNA,采用吸光度(A)值测定和电泳检测其完整性,紫外分光光度计测定其浓度及纯度。
2.miRNA的标记和纯化:按Agilent公司的miRNA完全标记和杂交试剂盒(miRNA Complete Labeling and Hyb Kit)的说明书进行miRNA荧光标记和纯化。
3.芯片杂交、图像采集和数据处理:芯片检测及分析由美国Agilent公司完成。
4.实时荧光定量PCR验证:从有效的差异表达miRNA中选取3个 miRNA,分别为 hsa-miR-1、hsa-miR-146a与hsa-let-7e,进行实时定量 PCR 验证以确保芯片实验结果的可靠性。选择肺结核患者及健康对照者各5例,再次抽取外周血1ml/人,枸橼酸钠抗凝。加入Trizol裂解,根据RNA提取试剂盒(mirVana RNA Isolation Kit)的操作步骤提取总RNA;利用反转录试剂盒(miScript Reverse Transcription Kit,Qiagen)将 RNA 逆 转 录 为cDNA,反应体系如下:反转录缓冲液 (5×)4μl,反转录酶1μl,无 RNA酶水14μl,模板 RNA 1μl。反应条件如下:37℃1h,95℃5min。实时荧光定量PCR利用miScript SYBR Green PCR kit(Qiagen)进行,反应体系如下:2×QuantiTect SYBR Green PCR混合液10μl,10×QuantiTect引物2μl,无RNA酶的水7.5μl,cDNA模板0.5μl。反应条件如下:95℃15min,然后是40次循环的94℃15s、55℃30s和72℃30s。以小核RNA(small nuclear RNA,snRNA)U6作为内参。最后,miRNA的实时定量PCR产物用非变性琼脂糖凝胶电泳检测。miRNA的相对表达量采用2-△△Ct计算。
四、统计学处理
芯片结果的统计学意义判断标准是校正后的两个样品间杂交信号强度的比值,以比值>2或<0.15代表有明显的表达差异。实时定量PCR结果应用SPSS 13.0统计学软件进行统计学分析,对定量资料进行独立样本t检验,P<0.05为差异有统计学意义。
结 果
一、两组样品总RNA和miRNA质量检测结果
电泳结果显示,两组样品总RNA均可见清晰的18S(S代表沉降系数)和28S条带,样品保存质量较好(图1)。对分离纯化获得的miRNA进行A值测定表明miRNA总量及质量符合miRNA微阵列的检测要求(表1)。
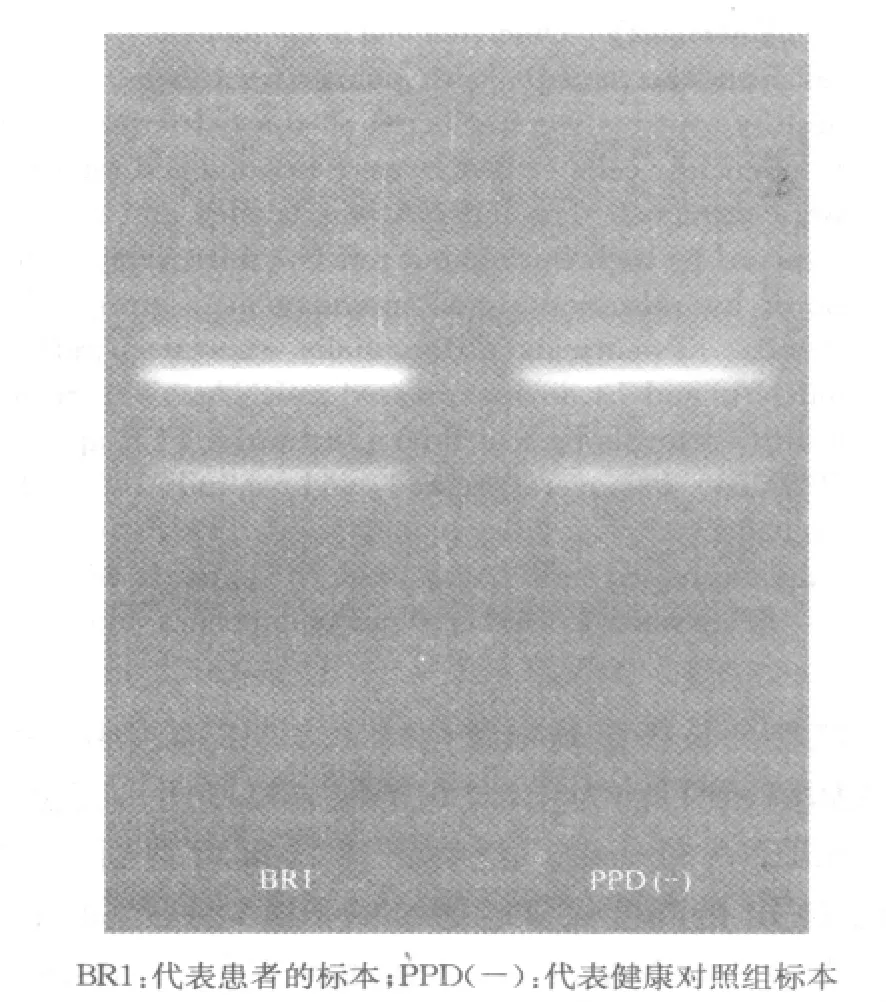
图1 两组样品总RNA电泳图
二、miRNA在肺结核组和对照组中的表达情况
对肺结核患者和健康对照者外周血单核细胞中has-miRNAs表达谱数据进行分析,芯片数据标准化处理后筛选出的26个差异表达的miRNA。在肺结核患者中显著上调表达13个,下调表达的有13个(表2)。

表1 RNA样品基本信息

表2 芯片数据标准化处理后筛选出的26个差异表达的miRNA

表3 肺结核患者和健康对照组中3个miRNA的表达比较(待测miRNA与内参照U6的Ct值之比,x±s)
三、实时定量PCR验证结果
为了验证芯片结果的一致性,选取在芯片筛选中有差异表达的 miRNA:hsa-miR-1、hsa-miR-146a与hsa-let-7e进行实时定量PCR验证。温度曲线、熔解曲线和电泳结果显示,反应过程顺利,特异性良好,没有非特异性扩增,表明实时定量PCR结果可靠。归一化后的结果显示,hsa-miR-1表达上调,hsa-miR-146a与hsa-let-7e表达下调,与芯片结果一致(表3)。
讨 论
RNA曾经被认为仅是DNA和蛋白质之间的“过渡”,但越来越多的证据清楚地表明,RNA在生命进程中扮演的角色远比人们估计的更为重要。近年的研究发现miRNA是一种可调节基因表达、调节生长发育和维持机体正常生理功能的一类重要小分子RNA。miRNA广泛存在于哺乳动物细胞内,具有强大的调控基因表达的作用,miRNA主要采用降解靶mRNA和抑制靶mRNA的翻译两种作用方式调控基因的表达[3]。生物信息学研究发现这些miRNA虽然只占人类基因总数的2%,却调控着人类全基因组中30%以上的基因的表达,而且miRNA水平基因调控机制是全新的[4]。随着新的miRNA的不断发现,以及部分miRNA功能的明朗,使得miRNA的研究倍受关注,成为当前研究的热点之一。对于人类基因组来说,在生长发育、分化和疾病过程中,基因表达的调节极其复杂,通过多系统相互作用来完成。于转录水平的调节往往比蛋白水平的调节更快捷且高效节能。单一miRNA就可以同时调节众多的基因,这使得miRNA成为重要生理机能调节的关键因素,如形态发生、细胞命运、对感染微生物的反应、着丝粒异染色质结构等。经文献检索,国内外尚无关于miRNA在结核感染中作用的研究报道。国内有学者已经开始进行结核患儿循环miRNA表达谱的研究,另有学者正在进行小RNA在潜伏感染到活动性结核病进程中的作用的研究,但尚无阶段性研究结果的报道。
在本次芯片筛选研究中,在肺结核患者组和健康对照组外周血单核细胞中发现26个差异表达的miRNA,其中有13个下调,13个上调。说明肺结核患者和健康对照者之间确实存在miRNAs表达差异。从此次的实验数据可以看到,在肺结核患者中高表达的人类来源的miRNAs有miR-21、miR-340、miR-424、miR-301b、miR-1、miR-627等,低表达的人类来源的 miRNAs有let-7e、miR-146a、miR-552、miR-545、miR-136、miR-199a等。
虽然尚缺少miRNA在结核感染中的研究报道,笔者还不知道上述差异表达的miRNA在结核感染中的作用,但miRNA在免疫和呼吸系统中的研究已有不少报道。在过敏性气道炎症的研究中,Ezzie等[5]通过微阵列方法在多西环素诱导肺特异性IL-13转基因小鼠(过敏性气道炎症)中发现21个miRNA差异表达。其中miR-21过表达、miR-1低表达。在肺癌的研究中,2004年Takamizawa等[6]首先报道了let-7与肺癌病因学有关,在肺癌组织中44%的患者let-7a表达降低,并与术后生存期缩短相关。2009年美国胸科协会(ATS)年会上发表的一篇研究摘要,对不同分期的慢性阻塞性肺疾病(COPD)患者的肺组织进行了miRNA表达的检测,校正年龄和吸烟因素后,结果显示“全球自发性慢性阻塞性肺疾病组织(GOLD)”定义的1~2期COPD患者肺组织中miR-455和miR-199a表达上调,miR-324-5p和 miR-324-3p表达下降,GOLD 定义的2~4期的COPD患者miR-374表达上调,miR-324-3p表达下调,从GOLD 1至GOLD 4期,miR-374和 miR-199a表达上调,miR-324-3p表达下调[7]。使用Ingenuity Pathway分析软件,分析miR-324-3p的靶基因及其相关生物路径反应提示其与分子转运和细胞发育、生长、增殖有关;对miR-199a的分析则提示其与细胞间的信号传递和组织生长有关,研究者认为不同的miRNA表达谱有助于区分不同的GOLD分期的COPD患者,并与COPD的发生发展密切相关[7]。上述研究提示,笔者筛选出的部分差异表达的miRNA参与了细胞间的信号传导和细胞的发育生长和增殖,在结核感染中的作用有待进一步研究。
特别值得注意的是在肺结核患者中hsa-miR-146a的显著低表达。目前的研究表明hsa-miR-146a是与免疫相关的miRNA,在免疫系统中miRNA可通过调节免疫细胞分化、免疫细胞信号转导、固有免疫应答和适应性免疫应答等多个层面对免疫反应各个水平执行较为柔和精细的微调[8]。在固有免疫应答中,Toll样受体(toll like receptor,TLR)家族是一类近年来研究比较热门的病原体相关模式受体,TLR与配体结合后首先导致白介素1受体相关激酶1 (interleukin 1receptor associated kinase 1,IRA K1)和肿瘤坏死因子受体相关因子6(TNF receptor associated factor 6,TRAF6)等接头蛋白的募集,然后进一步向下级联传导信号,最终通过磷酸化的下游转录因子激活包括干扰素在内的大量细胞因子的产生。研究显示miRNA-146a作为一个负调控分子,其可通过互补结合于IRA K1和TRAF6的 3′端非翻 译 区 (untranslated region,UTR),在转录后水平抑制TRAF6和IRA K1的表达,从而对固有免疫应答中细胞内信号转导起一种负反馈调节作用[9]。本研究结果显示 miR-146a表达水平在肺结核患者中明显低于正常对照组,提示miR-146a参与了肺结核病的发生发展的过程。
众所周知,PCR扩增会对芯片结果引入误差[10],且miRNA的量远少于RNA。本研究中,为得到足量的miRNA,笔者每组选取了10例(名)受试者,各抽取5ml空腹静脉血,先将提取的PBMC混合,进而提取总RNA和miRNA,进行芯片实验。混合标本得到的结果消除了miRNA的个体差异,也有利于消除多次芯片实验间的误差。
笔者将在后续实验中针对筛选出来的肺结核差异表达的部分miRNA,在较大的样本中采用实时定量PCR方法加以验证,结合患者的临床病理资料分析其临床意义,并通过体内外实验进一步研究相关miRNA的生物学功能。
[1]Calin GA,Ferracin M,Cimmino A,et al.A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia.N Engl J Med,2005,353 (17):1793-1801.
[2]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers.Nature,2005,435(7043):834-838.
[3]Rana TM.Illuminating the silence:understanding the structure and function of small RNAs.Nat Rev Mol Cell Biol,2007,8(1):23-36.
[4]Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets.Cell,2005,120(1):15-20.
[5]Ezzie ME,Yu L,Batte K,et a1.A distinct microRNA profile distinguishes GOLD stages in COPD.Am J Respir Crit Care Med,2009,179:A2493.
[6]Takamizawa J,Konishi H,Yanagisawa K,et al.Reduced expression of the let-7microRNAs in human lung cancers in association with shortened postoperative survival.Cancer Res,2004,64:3753-3756.
[7]Lu TX,Munitz A,Rothenberg ME.MicroRNA-21is upregulated in allergic airway inflammation and regulates IL-12p35 expression.J Immunol,2009,182:4994-5002.
[8]Rodriguez A,Vigorito E,Clare S,et al.Requirement of bic/microRNA-155for normal immune function.Science,2007,316(5824):608-611.
[9]Taganov KD,Boldin MP,Chang KJ,et al.NF-kappaB-dependent induction of microRNA miR-146,an inhibitor targeted to signaling proteins of innate immune responses.Proc Natl Acad Sci U S A,2006,103(33):12481-12486.
[10]Sarwal MM.Chipping into the human genome:novel insights for transplantation.Immunol Rev,2006,210:138-155.

