基于双单倍体牙鲆挖掘与生长性状连锁的微卫星标记
刘永新,王桂兴,王玉芬,司 飞,孙朝徽,张晓彦,刘海金*
(1.中国水产科学研究院,北京 100141;2.中国水产科学研究院北戴河中心实验站,山东 秦皇岛 066100)
人工诱导雌核发育作为细胞工程育种的一种新技术,是快速建立纯系的有效手段,在鱼类染色体操作、遗传改良以及性别控制等方面都具有潜在的应用价值[1]。有丝分裂雌核发育和减数分裂雌核发育是鱼类雌核发育两种主要形式。有丝分裂雌核发育是经抑制第一次卵裂而形成,其染色体组中一条是以另一条为模板复制而成,遗传组成在理论上为纯合,亦称双单倍体[2-3]。在雄性异配性别决定系统(XX雌性;XY雄性)的鱼类品种中,通过静水压处理经过一代即可获得完全纯合的双单倍体,但是双单倍体的成活率非常低。到目前为止,成功诱导有丝分裂雌核发育获得双单倍体的鱼类仅有20余种[3]。利用有丝分裂雌核发育后代开展的研究主要包括两部分:其一是后代纯合性的检测,只有在全部检测位点均为纯合型的个体才能称之为双单倍体,如牙鲆[4-6]、非洲鲶鱼[7]、欧鲈[8]、斑点叉尾[9]。其二是以纯合的双单倍体为亲本再行诱导减数分裂雌核发育制备克隆系,目前已报道的鱼类克隆有9个品种:斑马鱼[10]、青[11]、香鱼[12]、鲤鱼[13]、虹鳟[14]、石川氏鲑[15]、罗非鱼[16-17]、牙鲆[18]和真鲷[19]。
牙鲆(Paralichthys olivaceus)是分布于我国沿海的重要鲆鲽鱼类之一,在海水养殖中占有重要地位,其年产量约为7 000 t。随着养殖规模的日益扩大,由于累代繁殖和近亲交配引起了种质的明显退化。现在培育的商业化苗种表现出生长速度降低、疾病抵抗力差、抗逆性差等缺点,严重影响了养殖业者的经济效益。因此,培育具有优良经济性状的新品种、新品系已然成为牙鲆养殖的重要任务。传统上采用动物模型BLUP方法结合家系选育技术进行新品种选育研究。随着分子标记技术的蓬勃发展,越来越多的标记技术已经融入于优质品种选育过程中。分子标记技术具有信息量大,不易受环境的影响,选择强度大,选种效率和准确性高等特点,已经引起人们广泛关注[20]。其中,微卫星标记具有多态性丰富、易于检测、进化所受选择压力小等特点,是近年来发展迅速、应用广泛的分子标记之一。如:凡纳滨对虾、中国对虾与生长性状相关的微卫星标记分析[21-22];鲤鱼与抗寒性状相关的微卫星分子标记筛选[23];牙鲆耐高温性状相关的微卫星标记筛选[24]。本研究以中国水产科学研究院北戴河中心实验站2007诱导成功的双单倍体牙鲆群体为材料[6],寻找与生长性状紧密连锁的微卫星标记,以期为牙鲆良种选育研究奠定理论基础。
1 材料与方法
1.1 材料
选择中国水产科学研究院北戴河中心实验站牙鲆选育基础群体中性状优良雌性亲鱼,轻挤雌鱼腹部获得卵子,存储于500 mL烧杯中。轻挤雄性真鲷腹部获得精子,存储于1.5 mL注射器中。真鲷精液用Ringer氏液按照1∶50的比例进行稀释。稀释后的精液在15W×2的紫外线灯管(Toshiba,Japan)下进行照射,照距为28~30 cm,时间为60 s。照射后的精液经显微镜检查活力,确认充分活跃后,将真鲷精液与卵粒均匀混合(精卵体积比1∶10),室温静置2 min,加入14~16℃海水激活,并用玻璃棒轻度搅拌。将受精后1 h的受精卵转移至静水压力机中,施压650 kg·cm-2持续10 min,之后将卵移至14~16℃的海水中孵化,获得双单倍体实验群体。培育群体至三年龄,记录体重(Body weight,BW)、全长(Total length,TL)、体高(Body depth,BD)等主要生长性状数据,选择具有显著差异的个体各30尾,作为快速生长组(Fast growth group,FGG)和慢速生长组(Slow growth group,SGG),每组个体生长性状描述性统计量见表1。同时采集两组相应个体腹面鳍条,保存于-80℃冰箱中待用。
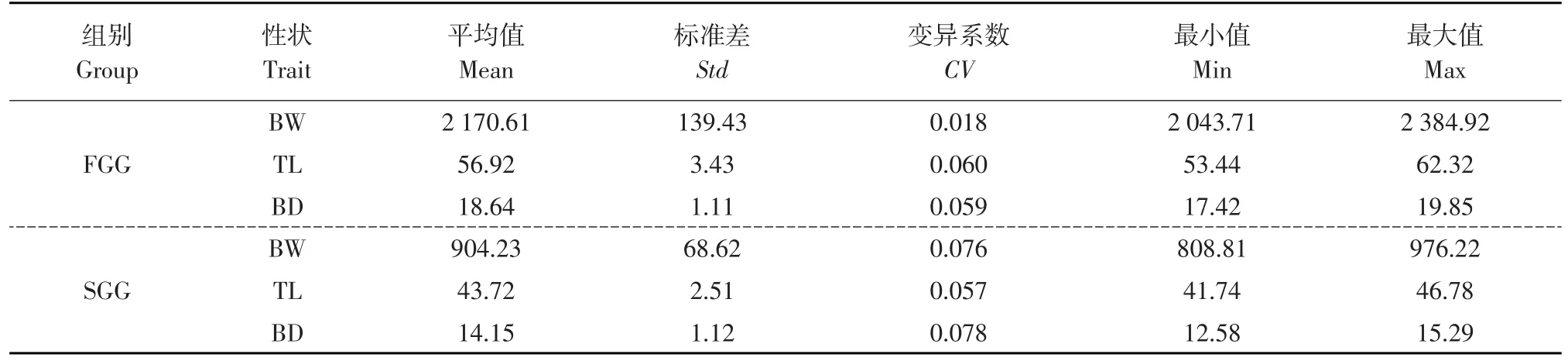
表1 FGG和SGG个体生长性状表型值Table 1 Descriptive statistics of growth traits for FGG and SGG individuals
1.2 基因组DNA提取
将 裂 解 液(50 mmol·L-1NaCl, 30 mmol·L-1Tris-HCl, 200 mmol·L-1EDTA pH 8.0, 1% 的SDS,200 mg·L-1的蛋白酶K)加入剪碎的鳍条中,40℃消化至澄清,等体积的饱和酚∶氯仿∶异戊醇(24∶1∶1)抽提3次。等体积的去离子水稀释,2.5倍体积预冷的无水乙醇沉淀,100 μL的70%乙醇清洗沉淀,TE溶解,-20℃保存待用。
1.3 微卫星引物
40个微卫星标记参考牙鲆遗传连锁图谱获得引物序列[25],由上海生工生物工程技术服务有限公司合成引物,合成规格2.5 OD。引物名称、引物序列、核心序列、退火温度、连锁群、GenBank登录号见表2。
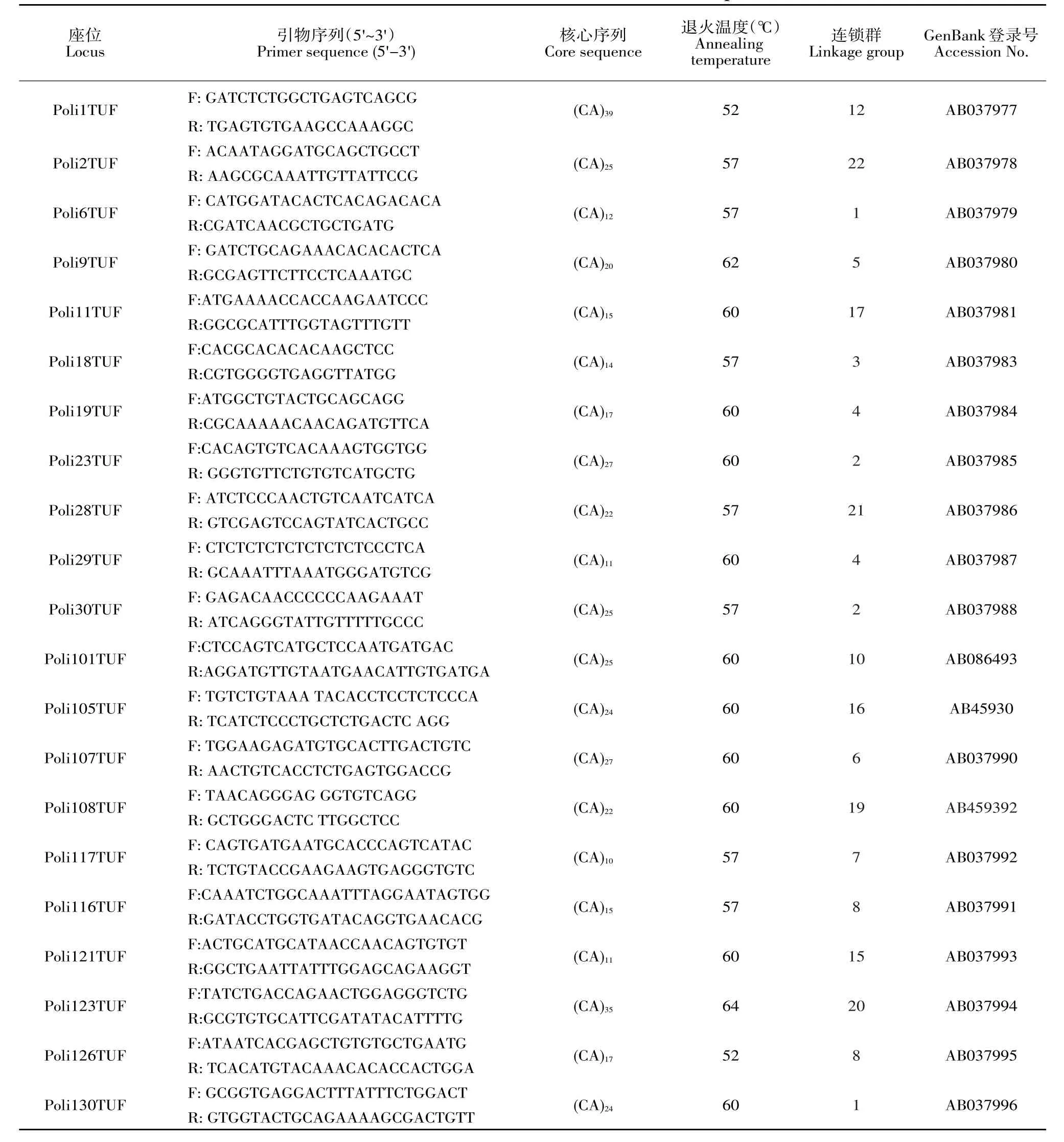
表2 牙鲆微卫星标记信息Table 2 Detailed information on microsatellite markers of Japanese flounder
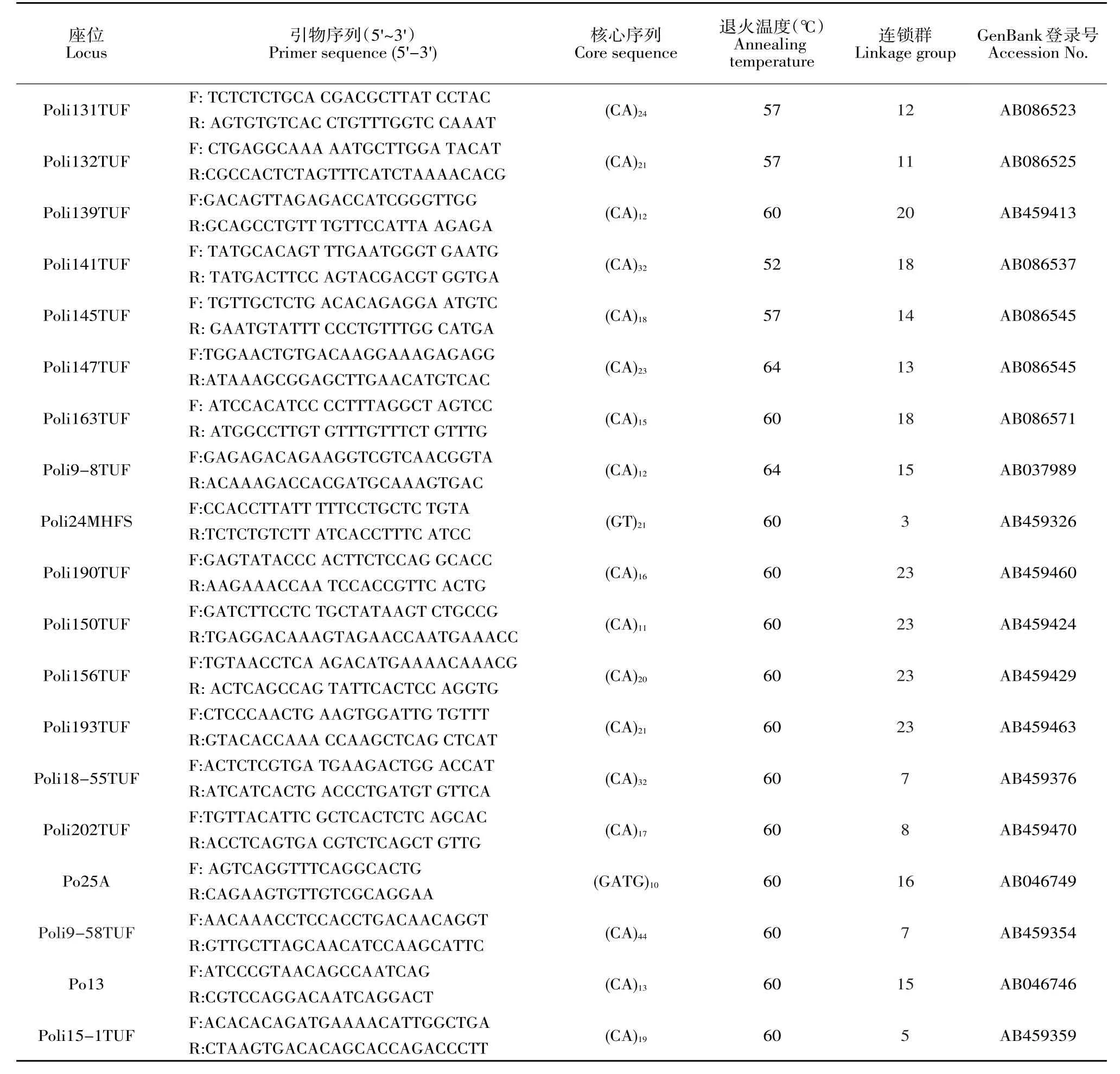
续 表
1.4 PCR反应及电泳
PCR反应体系为25 μL,包括10×的buffer 2.5 μL、Mg2+(25 mmol·L-1)1 μL、dNTPs(各2 mmol·L-1)1 mL、上下游引物(10 mmol·L-1)各1 μL、模板 1 μL(30~50 ng)、Taq DNA 聚合酶 1 U,加适量ddH2O。PCR反应程序包括:94℃30 s,退火30 s,72℃ 30 s,28循环;最后72℃延伸10 min。PCR产物经8%非变性聚丙烯酰胺凝胶电泳检测,电泳后经1%的硝酸银染色10 min,显色液(1%甲醛,2%氢氧化钠,0.04%无水碳酸钠)显色10 min。凝胶在扫描仪上成像,Gel-Pro Analyzer 4.5软件对电泳谱带进行分析。
1.5 统计分析
通过Gel-Pro Analyzer 4.5软件分析电泳图片计算等位基因片段大小,利用SAS8.2软件分析生长性状与微卫星标记的相关性。
2 结果与分析
2.1 微卫星位点差异性等位基因片段筛选
表1中个体主要生长性状表型值范围分别为:FGG,体重(2 043.71~2 384.92)、全长(53.44~62.32)、体高(17.42~19.85);SGG,体重(808.81~976.22)、 全 长(41.74~46.78)、 体 高(12.58~15.29),表明两组个体生长性状存在显著差异。通过Gel-Pro Analyzer 4.5软件分析电泳图片,获得FGG和SGG个体在不同位点的等位基因片段大小。40个微卫星标记扫描FGG和SGG个体基因组结果中,有Poli19TUF、Poli24MHFS、Poli150 TUF、Poli190TUF等4个位点在两组内出现了差异性等位基因片段。
2.2 微卫星位点差异性等位基因片段统计
统计 Poli19TUF、Poli24MHFS、Poli150TUF、Poli190TUF位点在FGG和SGG中个体的扩增情况。表3中,同一标记在不同组别中获得了特异性的等位基因片段。Poli19TUF、Poli24MHFS、Poli190TUF位点在FGG中均有25个左右个体扩增出相应的特异性片段,其出现率为83.33%~86.67%;而在Poli150TUF位点的出现率略低,为66.67%。SGG中Poli150TUF、Poli190TUF位点有23个左右个体扩增出相应的特异性片段,其出现率为73.33%~80.00%;而Poli24MHFS、Poli19TUF位点出现率相对较低,为40.00%~60.00%。
2.3 微卫星位点差异性等位基因片段与生长性状的连锁分析
利用SAS8.2软件的GLM过程进行牙鲆主要生长性状与微卫星标记的相关性分析,统计4个位点差异性等位基因片段在FGG和SGG内个体主要生长性状之间的差异,寻找与性状紧密连锁的标记。同一标记具有特定差异性片段的两组个体,在体重、全长、体高三个性状上表现出显著差异(见表4),表明Poli19TUF、Poli24MHFS、Poli 150TUF、Poli190TUF位点与生长性状具有紧密的连锁性。
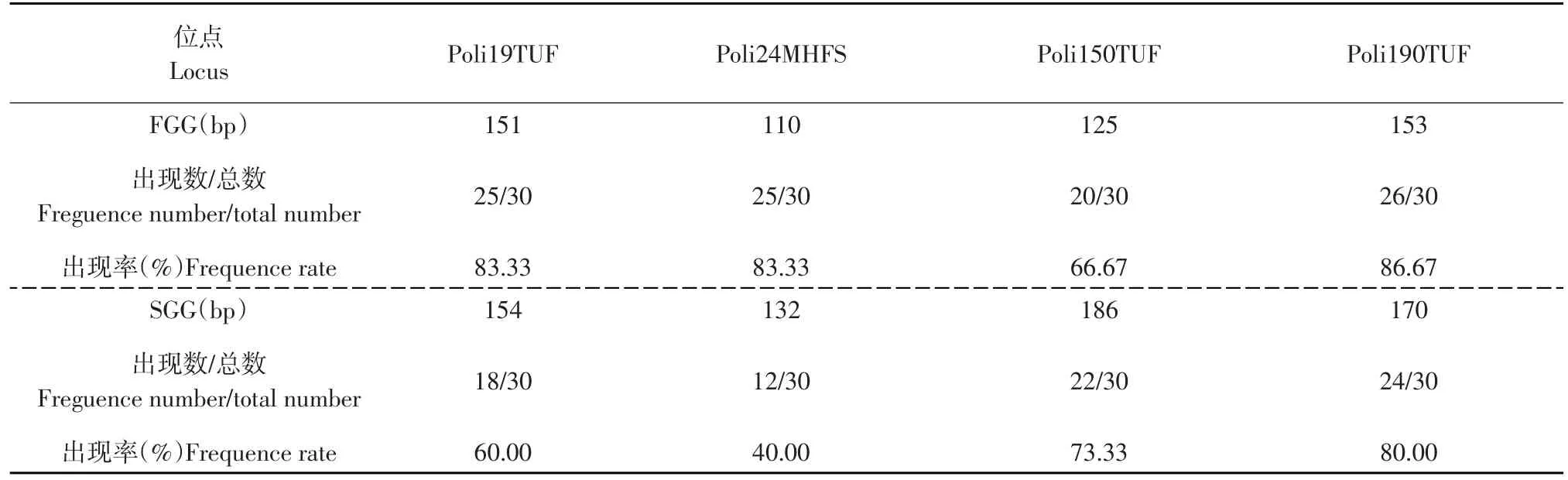
表3 FGG和SGG差异性等位基因片段统计Table 3 Statistics of different banding patterns in FGG and SGG
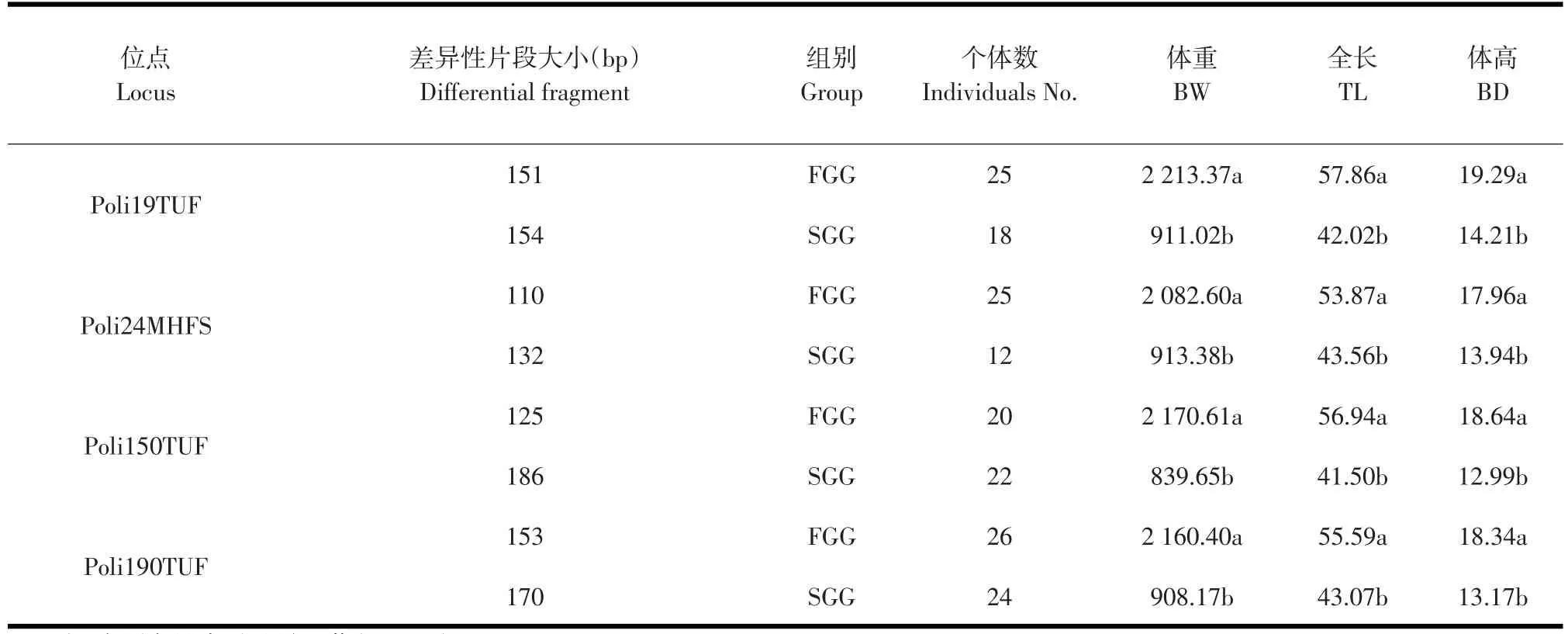
表4 FGG和SGG差异性等位基因片段个体生长性状比较Table 4 Comparison of different banding patterns in FGG and SGG individuals
3 讨论与结论
鱼类的生长性状受多基因控制,遗传基础复杂;且由于生存在海淡水中,较畜牧业品种更加容易受到环境效应的影响。目前,对于主要养殖鱼类经济性状的遗传改良多采取家系选育、人工诱导雌核发育等技术。利用这些方法,近些年先后培育出“夏奥1号”奥里亚罗非鱼、吉鲡罗非鱼、异育银鲫“中科3号”、松浦镜鲤、鲢“鄂丰1号”、加州鲈等优良新品种(系)12个。其中,雌核发育技术在水产动物育种过程中发挥了越来越重要的作用。但是,所利用的多为减数分裂雌核发育技术,以固定母本性状和建立高遗传相似度家系为主要手段。很少以诱导有丝分裂雌核发育获得的双单倍体为亲本培育新品种,用此材料进行分子标记与经济性状的连锁分析也未见报道。
本研究利用已经制备的双单倍体牙鲆按照体重等主要生长性状表型值分成FGG和SGG探索标记与生长性状的相关性,这种分群分离分析法能够快速鉴定与特定基因相连锁的标记[26]。类似方法在其它鱼类中也有报道,如:罗非鱼[27]、鲤鱼[28]、大菱鲆[29]。本研究从Coimbra等发表的遗传连锁图谱上选择了40个高多态性微卫星标记,覆盖了牙鲆24个连锁群中的22个,分析结果表明:4个标记与生长性状显著相关[25]。王桂兴等初步报道了牙鲆与生长性状相关的微卫星标记,找到了8个与生长性状相关标记。其使用材料为随机减数分裂雌核发育家系,在同一位点出现了多种个体基因型,且为杂合态;如Poli123TUF位点出现了6种基因型;这一点不利于标记与性状的连锁分析[30]。在此基础上,本研究首次采用双单倍体牙鲆为材料,其遗传背景完全纯合,在一个位点只有两种基因型,便于更加准确的分析标记与性状的相关性。同时,分析的标记数量也增加到40个;其中,3个相关标记Poli24MHFS、Poli150TUF、Poli190TUF即为新增标记。本试验检测出的4个相关标记分布于3个连锁群,表明控制牙鲆生长性状的基因有多个且位于不同连锁群,这一点与王桂兴等[30]结果相同。此外,本研究分析的3个主要生长性状:体重、全长、体高,三者之间存在高度的表型相关和遗传相关[31-32],若标记与其中1个性状相关,与其余2个性状也应出现相关性,这一推断在本研究结果中得以辅证(4个标记与3个性状均呈显著相关)。当然鱼类品种众多、形态各异,处于不同的发育时期和阶段使得不同生长性状之间的相关性也可能存在不同规律。借助分子标记技术挖掘出与性状紧密连锁的标记,如果将个体标记效应作为随机效应加入到动物模型等遗传评估模型中,能够让性状遗传力和个体育种值估计更加精确,推动具有特定经济性状的新品种或新品系的选育进程,缩短选育周期,提高遗传进展。
分子生物学技术的发展日新月异,从过去的DNA指纹图谱技术、同工酶标记到微卫星、SNP标记也仅仅用了短暂的时间。伴随着鲤鱼全基因组测序的启动,全基因组测序技术在水产动物的应用已经展开,牙鲆、半滑舌鳎、大黄鱼等品种都已经完成测序,处于组装、拼接和注释阶段。未来的品种选育与性状遗传改良必将借助于这些新兴的技术,深入到基因组水平的层次上诠释个体的生长发育过程。因此,在完成挖掘生长相关标记的基础上,本研究将继续利用牙鲆遗传图谱和基因组信息定位目的基因,真正发挥出分子标记技术在育种中的有效性和实用性。
[1] Thorgaard G H.Chromosome set manipulation and sex control in fish,in"Fish Physiology"(ed.by W.S.Hoar,D.J.Randall,and E.M.Donaldson)[M],Academic Press,New York,1983,9:405-434.
[2] Arai K.Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan[J].Aquaculture,2001,197:205-228.
[3] Komen H,Thorgaard G H.Androgenesis,gynogenesis and the production of clones in fishes:A review[J].Aquaculture,2007,269(1-4):150-173.
[4] 朱晓琛,刘海金,孙效文,等.微卫星评价牙鲆雌核发育二倍体纯合性[J].动物学研究,2006,27(1):63-67.
[5] 刘海金,刘永新,侯吉伦,等.牙鲆减数分裂与有丝分裂雌核发育的遗传差异[J].水产学报,2010,34(6):718-724.
[6] 刘海金,陆桂,王晓梅,等.有丝分裂雌核发育牙鲆的微卫星鉴定[J].中国水产科学,2010,17(5):889-894.
[7] Galbusera P,Volckaert F A M,Ollevier F.Gynogenesis in the African catfish Clarias gariepinus(Burchell,1822)Ⅲ.Inductionof endomitosis and the presence of residual genetic variation[J].Aquaculture,2000,185:25-42.
[8] Bertotto D,Cepollaro F,Libertini A,et al.Production of clonal founders in the European sea bass,Dicentrarchus labrax L,by mitotic gynogenesis[J].Aquaculture,2005,246:115-124.
[9] Geoffrey C W,Brian G B,Sylvie M A Q.Production of viable homozygous,doubled haploid channel catfish(Ictalurus punctatus)[J].Marine Biotechnology,2009,12:380-385.
[10] Streisinger G,Walker C,Dower N,et al.Production of clones of homozigous diploid zebra fish(Brachydanio rerio)[J].Nature,1981,291:293-296.
[11] Naruse K,Ijiri K,Shima A,et al.The Production of Cloned Fish in the Medaka(Oryzias ktipes)[J].Experimental Zoology,1985,236:335-341.
[12] Han H S,Taniguchi N,Tsujimura A.Production of clonal ayu by chromosome manipulation and confirmation by isozyme marker and tissue grafting[J].Nippon Suisan Gakkaishi,1991,57:825-832.
[13] Komen J,Bongers A B J,Richter C J J,et al.Gynogenesis in common carp(Cyprinus carpio L.)II.The production of homozygous gynogenetic clones and Flhybrids[J].Aquaculture,1991,92:127-142.
[14] Quillet E,Garcia P,Guyomard R.Analysis of the production of all homozygous lines of rainbow trout by gynogenesis[J].Experimental Zoology,1991,257:367-374.
[15] Kobayashi T,Ide A,Hiasa T,et al.Production of cloned amago salmon Oncorhynchus rhodurus[J].Fishery Science,1994,60:275-281.
[16] Mu¨ller-Belecke A,Ho¨rstgen-Schwark G.Sex determination in tilapia(Oreochromis niloticus)sex ratios in homozygous gynogenetic progeny and their offspring[J].Aquaculture,1995,137:57-65.
[17] Mu¨ller-Belecke A,Ho¨rstgen-Schwark G.Performance testing of clonal Oreochromis niloticus lines[J].Aquaculture,2000,184:67-76.
[18] Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthys olivaceus(Temminck et Schlegel)[J].Aquaculture,1999,173:235-246.
[19] Kato K,Hayashi R,Yuasa D,et al.Production of cloned red sea bream,Pagrus major,by chromosome manipulation[J].Aquaculture,2002,207:19-27.
[20] 鲁绍雄,吴常信.动物遗传标记辅助选择研究及其应用[J].遗传,2002,24(3):359-362.
[21] 陈晓汉,曾地刚,李咏梅,等.凡纳滨对虾生长性状的微卫星DNA标记分析[J].武汉大学学报,2006,52(4):498-502.
[22] 张天时,刘萍,李健,等.中国对虾与生长性状相关微卫星DNA分子标记的初步研究[J].海洋水产研究,2006,27(5):34-38.
[23] 潘贤,梁利群,雷清泉.筛选与鲤鱼抗寒性状相关的微卫星分子标记[J].哈尔滨工业大学学报,2008(8):915-918.
[24] 卢钟磊,池信才,王义权.褐牙鲆耐热性状相关的微卫星分子标记的筛选[J].厦门大学学报:自然科学版,2007(3):396-402.
[25] Coimbra M R M,Kobayashi K,Koretsugu S,et al.A genetic linkage map of the Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2003,220:203-218.
[26] Michelmore R W.Identification of marker linked to diseaseresistance gene by bulked segregant analysis:a rapid method detect marker in specific genomic regions by using segregating populations[J].Proc Natl Acad Sci USA,1991,88:9828-9832.
[27] Cnani A,Halerman E M,Ron M,et al.Detection of a chromosomal region with two quantitative trait loci,affecting cold tolerance and fish size,in an F2tilapia hybrid[J].Aquaculture,2003,223:ll7-l28.
[28] 张义凤,张研,鲁翠云,等.鲤鱼微卫星标记与体重、体长和体高性状的相关性分析[J].遗传,2008,30(5):613-615.
[29] 许可,马爱军,王新安,等.大菱鲆(Scophthalmus maximus)生长性状相关的微卫星标记筛选[J].海洋与湖沼,2008,40(5):577-583.
[30] 王桂兴,刘永新,孙效文,等.牙鲆微卫星分子标记与生长性状的相关性分析[J].东北农业大学学报,2009,40(7):77-84.
[31] 顾宪明,刘永新,王凯,等.应用DF-REML法估计牙鲆性状遗传参数[J].东北农业大学学报,2008,39(11):71-75.
[32] 王凯,刘海金,刘永新,等.牙鲆形态性状对体重的影响效果分析[J].上海水产大学学报,2008,17(6):655-660.

