测定猪肉中土霉素及金霉素残留的HPLC法建立
智若岚,刘中成,李广兴,张瑞莉*
(1.东北农业大学动物医学学院,哈尔滨 150030;2.哈尔滨市兽药饲料监察所,哈尔滨 150040)
近年来,为有效预防和治疗禽畜、鱼类等疾病,兽药及化学药品被广泛地应用做饲料添加剂,以促进其生长速度,控制其生殖周期和繁育能力[1]。土霉素和金霉素是我国应用最广、应用时间最长的动物保健性抗生素,曾经为我国的“菜篮子工程”保驾护航,但是这两种抗生素在动物性食品中的残留不仅危害人体健康,而且更为严重的是动物性食品中残留较低浓度的土霉素、金霉素容易诱导各种致病菌产生耐药性,不利于两种药物对人类和畜禽类疾病的治疗。随着土霉素、金霉素在畜牧养殖业的不断应用,其残留问题已经引起社会及有关部门的高度重视。因此,探究科学、快速的检测动物源性食品中土霉素和金霉素方法对人类健康和畜牧业发展有着重要意义。本试验通过建立高效液相色谱方法,检测猪肉中土霉素和金霉素的残留量,为监控动物源性食品中土霉素和金霉素药物残留提供安全可靠的方法依据。
1 材料与方法
1.1 主要仪器
1525泵高效液相色谱仪:紫外检测器2487、色谱工作站、自动进样器717和柱温箱(美国Waters公司);电子天平(日本岛津公司);高速离心机(上海医用仪器分析厂);超声波清洗器(江苏省昆山市超声仪器有限公司)及抽滤器(天津恒奥特科技发展有限公司)。
1.2 药物与标准品
土霉素对照品(30305-200519,纯度为87.2%)、金霉素对照品(900288,纯度为96.9%),以上两种对照品均由中国兽医药品监察所提供。
土霉素、金霉素(OTC、CTC)标准贮备液:称取土霉素11.47 mg、金霉素10.32 mg,分别用0.1 mol·L-1盐酸溶液、双蒸水溶解并定容至10.00 mL。
土霉素、金霉素(OTC、CTC)标准工作液:精密量取土霉素1.00 mL、金霉素标准贮备液2.00 mL,定容至10.00 mL,摇匀。此溶液中含土霉素0.1 mg·mL-1、金霉素0.2 mg·mL-1。
1.3 空白样品
试验中所用猪肉购自超市。将猪肉切碎,放于组织匀浆机中进行匀浆,作为空白样品,-20℃保存。
1.4 主要试剂及配制
乙腈为色谱纯,5%高氯酸50 mL为样品提取液,盐酸为分析纯,磷酸二氢钠为分析纯。0.01 mol·L-1磷酸二氢钠溶液:称取1.562 g磷酸二氢钠(NaH2PO4·2H2O)溶于蒸馏水中,定容到10.00 mL,过0.45 μm的滤膜,用以配制流动相。5%高氯酸:取70%的高氯酸7.14 mL,加双蒸水至100 mL。
1.5 方法
1.5.1 色谱条件
色谱柱为ODS-C18(4.6 mm×150 mm,5 μm),检测波长:355 nm,柱温:室温,流动相:乙腈+0.01 mol·L-1磷酸二氢钠溶液(pH 2.5用30%硝酸调节35∶65),进样量是 10 μL。
1.5.2 样品处理及分析检测
称取绞匀的猪肉样品5.01 g,置于50 mL锥形烧瓶中,加入25 mL的5%高氯酸,在振荡器上震荡10 min,移入离心管,3 000 r·min-1离心10 min,取上清液,重复两次,进行浓缩后过0.45 μm的滤膜,取10 μL进样,记录峰高,从标准曲线上查出含量。
1.5.3 标准工作曲线的测定
称取猪肉样品7份,每份为5.00 g(精确到±0.01 g),分别加入土霉素、金霉素的工作液0、25、50、100、150、200、250 μL(含土霉素、四环素 各为 0、2.5、5.0、10.0、 15.0、20.0、25.0 μg,含金霉素 0、5.0、10.0、20.0、30.0、40.0、50.0 μg),按“1.5.2样品处理”方法操作,以峰高为纵坐标,以抗生素含量为横坐标,建立标准工作曲线。
1.5.4 残留量计算
试样中土霉素、金霉素的残留量:

式中,X为样品中土霉素、金霉素的残留量(mg·kg-1);M为试样质量(g);H为样品中土霉素、金霉素的峰高。
1.5.5 检测限
取空白猪肉组织,做10个平行,按照“1.5.2”项的方法处理,测得基线噪音值,并求其平均值。按照信噪比S/N≥3确定为检测限(LOD)。
1.5.6 添加回收率和变异系数的测定
称取空白猪肉组织5.01g,置于50 mL离心管中,设高、中、低三个添加水平,按“1.5.2”项的方法处理,取10 μL进样分析,每个浓度重复进样5次。根据峰面积计算添加回收率和变异系数。
2 结果与分析
2.1 色谱选择和分离
样品添加土霉素和金霉素标准溶液的出峰时间为0.581和1.552 min,空白组织样品在该时间处无杂峰干扰(色谱图见图1、2)。

图1 添加土霉素、金霉素标准品的猪肉色谱图Fig.1 Chromatogram of pork with standard preparation of oxytetracycline and chlorotetracycline

图2 空白猪肉色谱图Fig.2 Chromatogram of blank pork without oxytetracycline and chlorotetracycline
2.2 标准工作曲线和线性范围
空白样品中添加土霉素、金霉素标准工作液后的标准曲线 0.1~1.0 μg·mL-1和 0.2~2.0 μg·mL-1呈线性关系,R2依次为0.9997、0.9955。说明本试验中土霉素、金霉素在0.1~1.0 μg·mL-1和0.2~2.0 μg·mL-1范围内线性关系良好,可用于样品的定量检测。回归方程及相关系数见表1。标准曲线见图3。

表1 猪肉空白样品中添加土霉素、金霉素的线性关系Table 1 Standard curve equations and correlative coefficients of HPLC analysis of oxytetracycline and chlortetracyline in pork
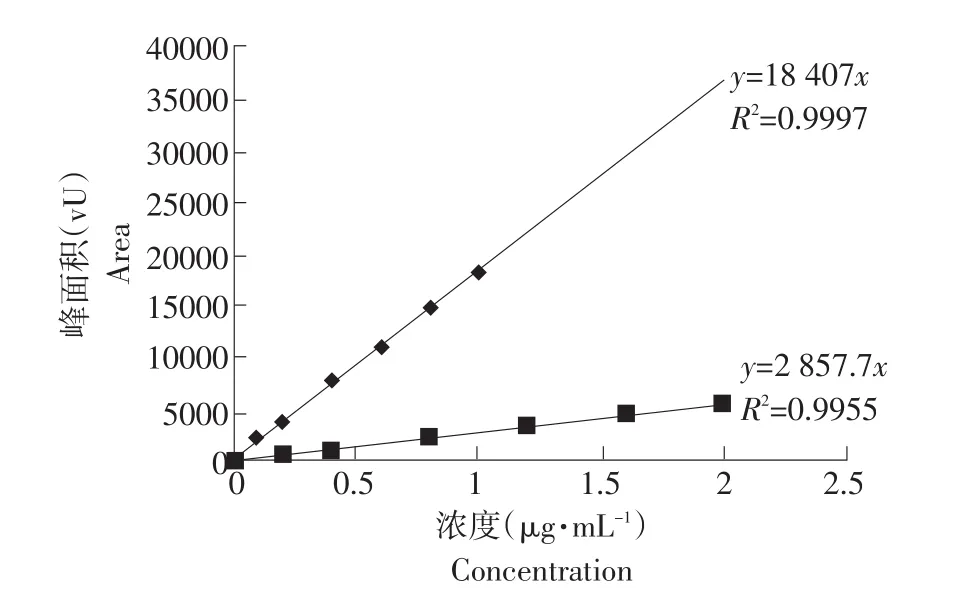
图3 添加土霉素、金霉素猪肉的标准曲线Fig.3 Standard curve of oxytetracycline and chlorotetracycline in pork
2.3 检测限
依据信噪比S/N≥3为检测限,土霉素、金霉素的最低检测限分别为20、10 μg·kg-1。
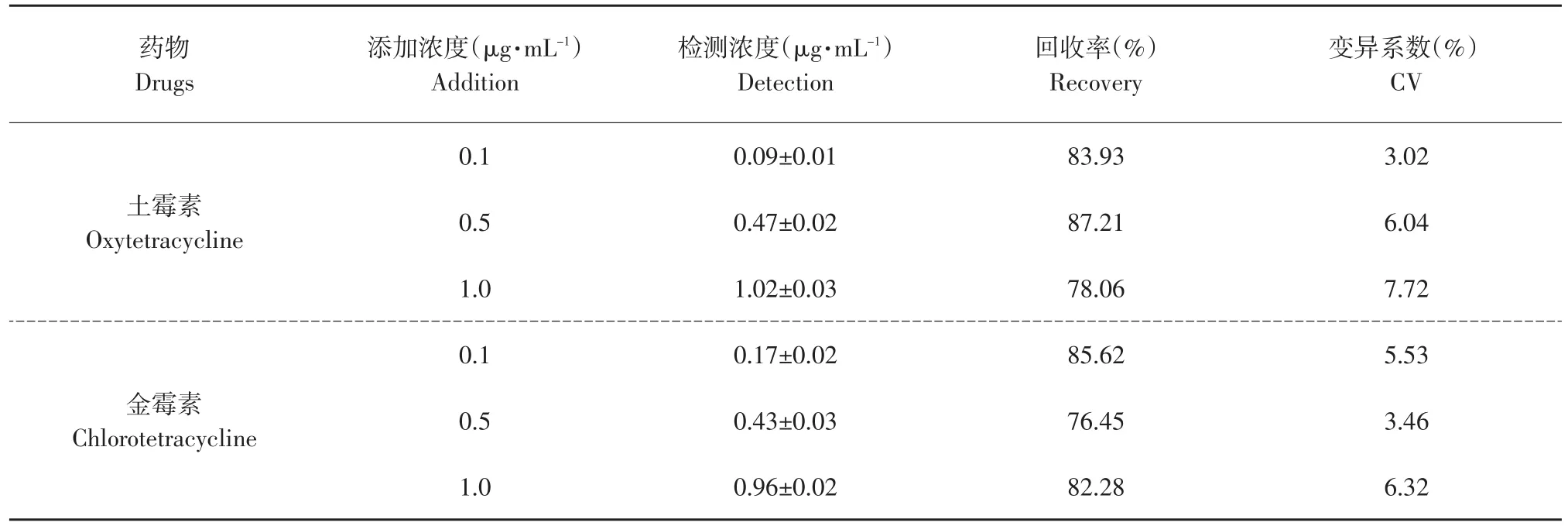
表2 猪肉中土霉素、金霉素的添加回收率和变异系数Table 2 Coefficients of recovery and variability of oxytetracycline and chlorotetracycline in pork(n=5)
2.4 添加回收率和变异系数
猪肉中添加各浓度的土霉素、金霉素的回收率及变异系数见表2。
根据我国农牧发[2003]1号文件规定,对兽药残留检测方法不同添加浓度的回收率原则要求,回收率范围应为70%~110%,动物源性食品中兽药残留实验技术规范要求生物样品,低浓度点的变异系数要小于15%。由表2可以看出,本试验建立的土霉素和金霉素的残留检测方法比较可靠,回收率和变异系数均能达到残留分析的要求。
3 讨论与结论
3.1 国家标准方法检测土霉素及金霉素
已有很多文献报道应用HPLC法检测土霉素、金霉素在动物组织中的残留量,根据色谱条件不同,标准曲线不同,检测的结果也不一致[2-6]。在本试验中,根据我国国家标准检测方法,在此工作条件下测定土霉素及金霉素的残留量方法较好,但检测中仍存在一定的问题(如标准曲线的浓度配制应范围更广、流动相的配制比例还要更精确),有待于进一步的调整。
3.2 猪肉样品的处理
本试验的样品处理采用的是国家标准检测的方法,用5%的高氯酸来进行样品提取,能够把猪肉中土霉素、金霉素很好的分离出来,离心时把变性的蛋白和脂类沉淀分离。并根据国标检测方法,样品与标准品溶液同时进行检测,采用乙腈和0.01 mol·L-1磷酸二氢钠做流动相,发现样品与标准品溶液均无干扰峰,分离较好。
3.3 回收率、变异系数、检测限试验
回收率可以看出从样品的处理到检测的一系列过程中药物的损失程度,是衡量试验方法是否可靠的一个标准,回收率越高则表明试验方法越可靠。本试验通过不同浓度添加水平的重复测定,在线性范围内测定土霉素和金霉素均得到较好的回收;变异系数也是考察试验过程中的损失情况,但不同于回收率的是,其反映生物样本从制备、保存到测样各个环节的总误差,本试验的回收率和变异系数结果说明本试验的检测方法可行[7]。
在兽药残留分析中,可以根据动物性食品中兽药的最高残留限量来规定检测方法的检测限,一般来说,检测方法的检测限必须低于相应的最高残留限量标准。我国规定了四环素类抗生素在动物源食品中的最高残留限量(MRL)为肌肉组织100 μg·kg-1[8-9]。本试验的检测限低于最高残留限量(MRL),说明本试验方法可行。
[1] 李利东,宓晓黎,囊建若,等.酶联免疫检测试剂盒应用于牛奶中四环素残留的测定[J].乳液科学与技术,2004,107(2):52-54.
[2] Verdon E,Fuselier R,Couedor P.Stability of penicillin antibiotic residues in meat during storage[J].Journal of Chromatography A,2000,882:135-143.
[3] Dubois M,Fluchard D,Sior E.Identification and quantification of five macrolide antibiotics in several tissues,eggs and milk by liquid chromatography electrospray tandem mass spectrometry[J].Journal of Chromatography B,2001(753):189-202.
[4] Meyera M T,Bumgarnerb J E,Jerry L.Use of radioimmunoassay as a screen for antibiotics in confinedanimal feeding operations and confirmation by liquid chromatography mass spectrometry[J].Science of the Total Environment,2000,248:181-187.
[5] 徐冬梅,刘广深,常新.高效液相色谱法测定动物组织中3种抗生素残留量[J].中国公共卫生,2002(18):233-234.
[6] 李俊锁,邱月明,王超.兽药残留分析[M].上海:上海科学技术出版社,2002.
[7] 刁彩霞.禽用抗病灵口服液的血浆药代动力学与安全性实验[D].哈尔滨:东北农业大学,2007:6.
[8] 任一平,徐威,黄百芬.用柱后衍生荧光测定法检测食品中土霉素和四环素残留[J].浙江技学院学报,2003(S1):50-53.
[9] 畜禽肉中土霉素、四环素、金霉素残留量的测定(高效液相色谱法)[S].北京:中国标准出版社.GB/T5009,2009,116-2003.

