民猪PGD和LDHA基因的表达与冷诱导研究
张冬杰,刘 娣,汪亮,王文涛,杨国伟
(黑龙江省农业科学院,哈尔滨 150086)
葡萄糖-6-磷酸脱氢酶(Glucose-6-phosphate dehydrogenase,G6PDH)与6-磷酸葡萄糖酸脱氢酶(6-phosphaogluconate dehydro-genase, 6PGDH)是植物戊糖磷酸途径中的两个关键酶。G6PDH的胞质基因与动物和真菌等真核生物具有共同的祖先;6PGDH的胞质酶和质体酶基因都起源于原核生物的内共生[1]。在甜杨上的研究结果表明,低温下G6PDH的活性会显著的提高[2]。在人医上主要是研究该酶在红细胞内活性降低和(或)酶性质改变而导致的溶血性疾病。猪的PGD基因(6-phosphogluconate dehydrogenase)最初是从肝脏组织的cDNA文库分离获得的,并通过原位杂交的方法定位在6q2.5-2.7[3],而后的研究认为它与肌肉的硬度也存在一定的相关性[4]。
乳酸脱氢酶(Lactate dehydrogenase,LDH)是动物体内参与糖酵解的重要酶类,能催化丙酮酸与乳酸的相互转变。LDH为四聚体,由M、H两个亚基组成(分别由A和B基因编码),共有5种同工酶形式LDH1~LDH5[5]。目前有关LDH的研究已较多,涉及到基因定位和蛋白质晶体结构以及基因表达调控等方面[6-8]。在分子进化方面,Holland等初步研究了LDH对温度的适应性[9];Glenn和Peter等通过对几种不同的冷水鱼在不同温度下LDHA的氨基酸序列以及酶动力学研究发现[10-11],抗冷与不抗冷品种之间,在氨基酸序列上仅存在1~4个点突变,但这些点突变位于活性区域内,通过精细的构象改变,改变蛋白质的氢键网络,影响蛋白质的静电分布或构象弹性,从而导致蛋白质功能的改变。在综合分析了PGD和LDHA基因已有的生物学功能研究报道,本研究将其作为可能影响民猪抗寒特性的候选基因进行了研究。
1 材料与方法
1.1 材料
75日龄民猪3窝共计12头,将每窝个体随机分成2组即常温组和低温组,每组各6头,均购自黑龙江省农科院畜牧研究所。2009年12月25日到2010年1月6日期间,将常温组置于正常舍内饲养,温度控制在10℃左右,低温组在舍外半敞式大棚内饲养,平均温度为-20℃,两组均饲喂相同的饲料。处理结束后,屠宰,取大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏各10 g左右,液氮带回实验室,-80℃冰箱冻存。
1.2 方法
1.2.1 RNA的提取与反转录
按照TRIZOL试剂的操作手册进行大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏组织的RNA提取,获得RNA后,进行质量和浓度的测定,随后参照反转录试剂盒说明书进行cDNA的合成,合成后-20℃储存备用。
1.2.2 引物的设计与合成
根据GenBank上已公布的猪的PGD基因(X16638)、LDHA基因(AK236433)和β-actin基因(AK240355)序列设计引物,引物序列如下:PGDF: 5'GTGTTCCTGGGCAAGATAAA 3', PGDR:5'AGAAGGAGAGGGCAGTGGT 3';LDHAF:5'TGT GGCTTGGAAGATAAG 3', LDHAR: 5'GAGACAC CAGCAACATTTA 3'; actinF: 5'CGGGACCTGACC GACTACCT 3',actinR:5'GGGCCGTGATCTCCTTC T G 3'。送交上海生工合成。
1.2.3 Real-time PCR反应体系与反应条件
反应体系:上、下游引物各0.8 μL,Mix 10 μL,模板0.8 μL,H2O 7.6 μL,共计20 μL。反应程序如下:95℃10 min,95℃30 s,60℃1 min,40 个循环。试验结果表示为 2-△△ct,其中ΔΔCt=(Ct,的基因-Ct,管家基因)试验组-(Ct,目的基因-Ct,管家基因)对照组。
反应条件:95℃10 min,40个循环:95℃15 s,60℃1 min,循环终止,加熔解曲线。
1.2.4 PGD和LDHA基因组织表达谱的构建
将常温组不同个体的大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏组织的cDNA分别混合,获得了7个cDNA池,分别以这7个cDNA池为模板,进行PCR扩增,PCR产物使用1%琼脂糖凝胶电泳检测。
1.2.5 PGD和LAHDA基因冷诱导后表达变化
将常温组和低温组不同个体的腿肌的cDNA分别混合,获得2个cDNA池,分别为常温民猪(CM)和低温民猪(DM)组。以这2个cDNA池为模板,进行Real-time PCR反应,每个反应重复3次。
2 结果与分析
2.1 民猪PGD基因的组织表达谱
民猪的PGD基因在不同组织内扩增的PCR结果见图1。从图1可见,PGD基因在所检测的7个组织内均有表达,而且表达水平均较高。
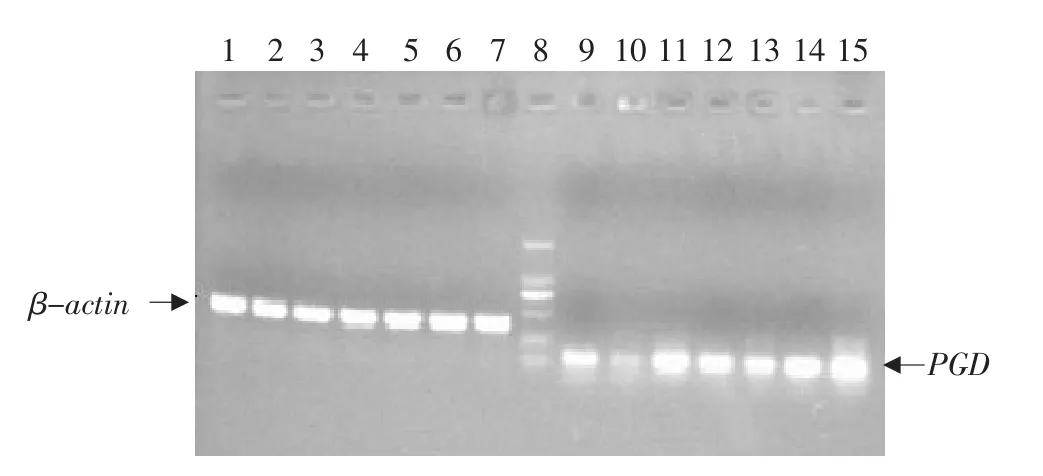
第1~7泳道:β-actin基因在大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏组织的表达水平;第8泳道:DL2000 Marker;第9~15泳道:PGD基因在大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏组织的表达水平Lane 1-7:The expression of β-actin gene in large intestine,leg muscle,lung,fat,heart,spleen and liver;Lane 8:DL2000 marker;Lane 9-15:The expression of PGD gene in large intestine,leg muscle,lung,fat,heart,spleen and liver
2.2 民猪LDHA基因的组织表达谱
民猪的LDHA基因在不同组织内扩增的PCR结果见图2。从图2可见,基因在所检测的7个组织内均有表达,在肺和肝脏的表达水平略高。

图2 LDHA基因的组织表达谱Fig.2 Expression pattern of LDHA
2.3 冷诱导后PGD和LDHA基因的表达变化
利用Real-time PCR方法对PGD和LDHA基因在常温民猪(CM)和低温民猪(DM)的腿肌内的表达变化进行了检测,PGD和LDHA基因的扩增曲线和熔解曲线见图3和图4。检测结果如图5和图6所示,采用配对样本T检验统计分析后发现,PGD基因在民猪的常温组和低温组之间差异显著(P<0.05)。可见,民猪的PGD基因在低温冷诱导后表达显著增加;而LDHA基因在低温冷诱导后表达显著降低(P<0.05)。

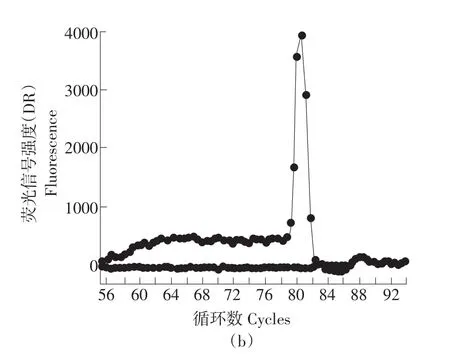
图3 PGD基因的扩增曲线和溶解曲线Fig.3 Amplification plots and dissociation curve of PGD
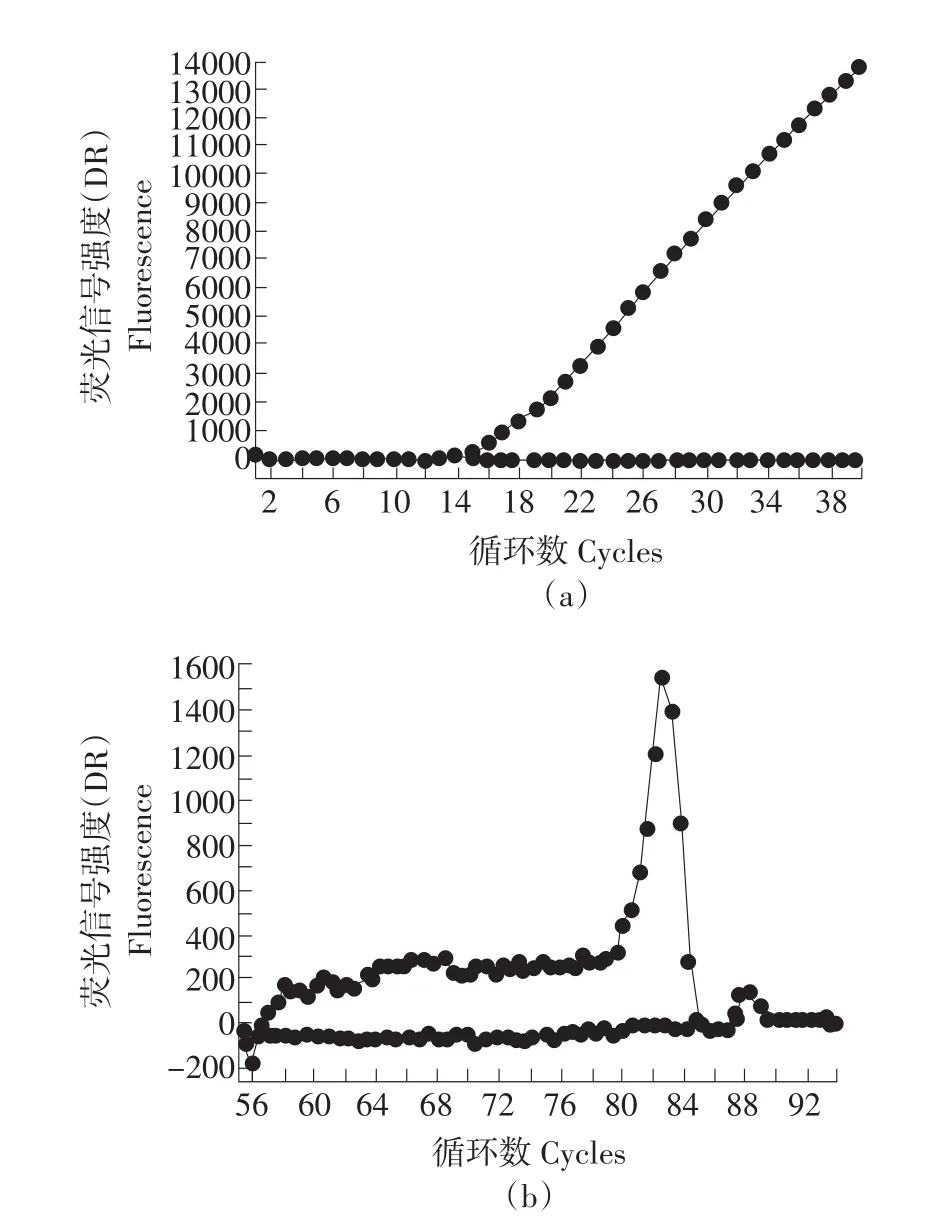
图4 LDHA基因的扩增曲线和溶解曲线Fig.4 Amplification plots and dissociation curve of LDHA
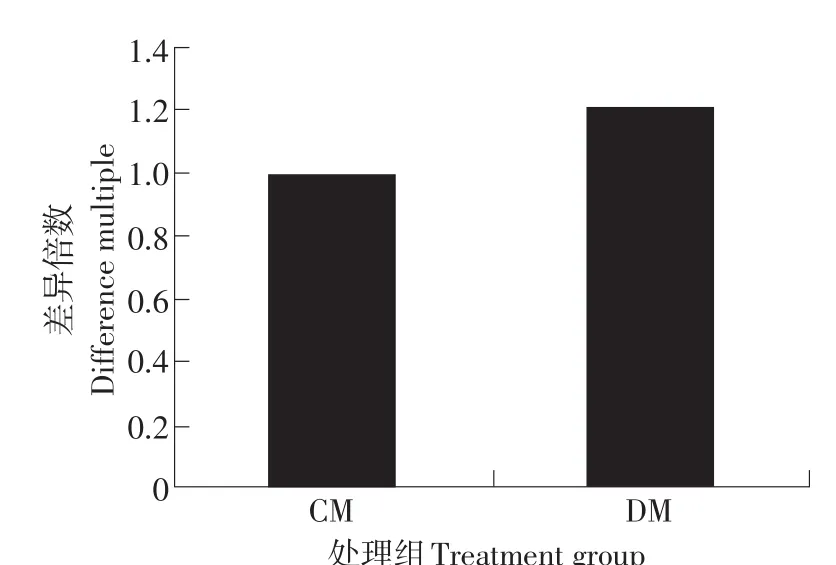
图5 低温诱导后PGD基因的表达变化Fig.5 Expression of PGD gene after cold-induced

图6 低温诱导后LDHA基因的表达变化Fig.6 Expression of LDHA gene after cold-induced
3 讨论与结论
PGD基因广泛表达于哺乳动物、植物和微生物。该酶位于动物细胞的胞质溶胶和线粒体上,位于植物的叶绿体上。它广泛的表达于所有组织和血细胞内,是一种看家酶[12],是磷酸戊糖旁路代谢的起始酶,它提供戊糖用于核酸合成,提供还原型辅酶Ⅱ(NADPH),用于各种生物合成及维持血红蛋白和红细胞膜的稳定性[13]。血细胞中缺乏PGD,临床上通常会表现为溶血性贫血。本试验所检测的大肠,腿肌、肺、脂肪、心脏、脾脏和肝脏组织内,该基因均高水平表达,这一点与其他已知的看家酶特点相符,说明该基因在民猪上的表达并不存在组织特异性。但马建岗在家鸡上的研究显示PGD在家鸡胚胎期和未成年之前不显示明显的同工酶区带[14],成年之后仅在部分组织中出现活性带;任立杰等也发现PGD在奶牛泌乳7 d时的活性要显著高于其他时间点[15],这说明PGD基因的表达在不同物种间还是存在一定差异的。在本研究中,民猪经低温冷诱导后,肌肉组织中的PGD基因的表达水平显著升高。因为该基因在猪上以及其他哺乳动物上的相关研究报道非常少,主要都集中在对人的PGD缺乏症的筛查、治疗和机理研究上[16-17]。但是在植物上关于该基因的研究报道较多,所以我们参考了在植物上的相关研究结果。2009年林元震等报道了杨树G6PDH基因启动子区序列,他们发现该序列除了具有启动子的基本元件TATA-box、CAAT-box外,还包含多个胁迫诱导元件,如低温诱导元件LTR,抗冻、缺水、脱落酸、抗寒元件MYB和MYC,以及光响应元件L-box、G-box、3AF-1、TC丰富区等[18]。而且该基因的超表达,可以显著提高烟草的抗寒冻性[19]。但由于目前猪的PGD基因序列还不全,还无法进行更深入的研究,但从本结果来看,将其作为一个影响民猪抗寒特性的候选基因进行研究具有一定的理论基础和实际意义。
脱氢酶类是生物体内氧化还原反应中重要的催化剂之一,在生物体内的氧化产能、解毒以及某些生理活动中起着十分重要的作用,在生产实践中也有广泛的应用。在不同的组织中各种组分的含量和比例有所不同,它是各组织生化代谢特点的反映[20]。L-乳酸脱氢酶(E.C.1.1.1.27)是由基因分别位于第11号染色体上的M亚基、第12号染色体上的H亚基形成的多肽链所构成的四聚体,由于各亚基在不同的组织中各种组分的含量和比例不同,形成了 LDH1(H4),LDH2(H3M1),LDH3(H2M2),LDH4(H1M3)和LDH5(M4)等5种同功酶[21]。本研究所选择的LDHA也就是编码M亚基的基因,因此,它也被称作LDH-M。本研究中,LDHA基因在肺和肝脏组织的表达水平略高于所检的其他5个组织,艾晓杰等在对白香猪的研究中发现,肺、脾和肝脏组织中M亚基与H亚基相比略高或相同,而在肾脏和大肠中,均是H亚基占优势[22-24]。可见,民猪与白香猪相比,LDHA的表达模式基本一致。
乳酸脱氢酶是一个较为公认的与生物个体抗寒性有关的酶类,其在关键铰链区的一个氨基酸替换就可以显著改变生物个体的抗寒性[25]。本研究将其作为一个可能为影响民猪抗寒性的候选基因进行了研究,结果表明,民猪在被冷诱导后,肌肉组织内的LDHA基因的mRNA水平出现了显著的下降。这一结果与史福胜等人在对不同海拔地区的牦牛组织中LDH的活性研究结果基本一致[26]。LDH不仅能够催化丙酮酸和乳酸之间的相互转化,而且还能够调节烟酰胺腺嘌呤二核苷酸(NAD)和烟酰胺腺嘌呤二核苷酸磷酸(NADH)的比率,因而对细胞内的一系列生化反应起调节控制作用[27]。可见,当民猪处于低温环境时,它通过下调LDHA基因的转录来达到抵御寒冷的目的。
综上所述,葡萄糖-6-磷酸脱氢酶在民猪的肌肉组织中受到低温冷诱导后,mRNA的表达水平显著增加,而乳酸脱氢酶A表达水平显著下降,二者均可以考虑作为影响民猪抗寒特性的候选基因进行研究。
[1] 黄骥,候夫云,王建飞,等.高等植物葡萄糖-6-磷酸脱氢酶与6-磷酸葡萄糖酸脱氢酶基因的不同进化起源[J].植物学通报,2005,22(2):138-146.
[2] 林元震.甜杨葡萄糖-6-磷酸脱氢酶基因克隆及结构分析与功能鉴定[D].北京:北京林业大学,2006:3-5.
[3] Harbitz I,Chowdhary B,Chowdhary R,et al.Characterization and chromosomal assignment of a partial cDNA for porcine 6-phosphogluconate dehydrogenase[J].Hereditas.1990;112(1):83-88.
[4] Clamp P A,Beever J E,Fernando R L,et al.Detection of linkage between genetic markers and genes that affect growth and carcass traits in pigs[J].J Anim Sci,1992,70:2695-2706.
[5] 郑玉才,司晓辉,贺庆华,等.牦牛乳酸脱氢酶A的分离纯化、酶学性质及其基因的克隆[J].中国农业科学,2008,41(5):1470-1475.
[6] Ryttman H,Thebo P,Gustavsson I,et al.Further data on chromosomal assignments of pig enzyme loci LDHA,LDHB,MPI,PEPB and PGM1,using somatic cell hybrids[J].Anim Genet,1986,17(4):323-333.
[7] Adams M J,Ford G C,Koekoek R,et al.Structure of lactate dehydrogenase at 2-8 Å resolution[J].Nature,1970,227:1098-1103.
[8] Qiu H,Xu X,Fan B,et al.Investigation of LDHA and COPB1 as candidate genes for muscle development in the MYOD1 region of pig chromosome 2[J].Mol Biol Rep,2010,37(1):629-636.
[9] Holland L Z,McFall-Ngai M,Somero G N.Evolution of lactate debydrogenase-a bomologs of barracuda fishes(Genus sphyraena)from different thermal environments:Differences in kinetic properties and thermal stability are due to amino acid substitutions outside the active site[J].Biochemistry,1997,36(11):3207-3215.
[10] Glenn C J,George N S.Evolutionary convergence in adaptation of proteins to temperature:A4-Lactate dehydrogenases of pacific damselfishes(Chromis spp.)[J].Mol Biol Evol,2004,21(2):314-320.
[11] Peter A F,George N S.Hot spots in cold adaptation:Localized increases in conformational flexibility in lactate dehydrogenase A4 orthologs of Antarctic notothenioid fishes[J].Proc Natl Acad Sci,1998,95(19):11476-11481.
[12] Vedat T,Sinan A,Mehmet C,et al.Purifcation and characterization of glucose 6-phosphate dehydrogenase from sheep liver[J].Turk J Chem,2003,(27):395-402.
[13] 郑敏,罗建明.葡萄糖-6-磷酸脱氢酶基因突变的研究进展[J].医学综述,2005,11(3):266-268.
[14] 马建岗.LDH、MDH、G6PD同工酶与家鸡能量代谢特征[J].厦门大学学报:自然科学版,1995,34(2):271-275.
[15] 任立杰,佟慧丽,李庆章,等.奶牛乳腺发育与泌乳过程中能量代谢的变化[J].东北农业大学学报,2010,41(2):86-90.
[16] 王也飞,夏文权,倪培华,等.G6PD缺陷症基因型分析:一种新的错义突变[J].上海交通大学学报:医学版,2010,30(6):698-702.
[17] 钟丹妮,高宗燕,刘悠南,等.广西南宁地区G6PD基因突变与新生儿黄疸的关系[J].中国当代儿科杂志,2009,11(12):970-972.
[18] 林元震,张志毅,郭海,等.杨树葡萄糖-6-磷酸脱氢酶(G6PDH)基因启动子的克隆与分析[J].基因组学与应用生物学,2009,28(3):445-449.
[19] 林元震,张志毅,郭海,等.甜杨PsG6PDH基因超表达对提高烟草抗寒冻性的影响[J].西北农林科技大学学报:自然科学版,38(3):125-131.
[20] 詹新贵,金宏,刘艳卉,等.猪组织中乳酸脱氢酶同工酶的分离与测定[J].湖南农业大学学报:自然科学版,2003,29(5):426-427.
[21] Hames B D,Hooper N M,Houghton J D.Instant notesi biochemistry[M].BIOS:Scientific Publishers Limited,1997:63-64.
[22] 刘泽军.同工酶的分子生物学研究进展[J].陕西医学检验,2000,15(1):58-59.
[23] 艾晓杰,杨丽娥,程美蓉,等.白香猪内脏器官乳酸脱氢酶同功酶的比较研究[J].西南农业大学学报,2003,25(2):108-110.
[24] 艾晓杰,杨丽娥,程美蓉,等.白香猪消化器官乳酸脱氢酶同功酶的比较研究[J].四川畜牧兽医,2005(8):23-24.
[25] Glenn C J,George N S.Evolutionary convergence in adaptation of proteins to temperature:A4-lactate dehydrogenases of pacific damselfishes(Chromis spp.)[J].Mol Biol Evol,2004,21(2):314-320.
[26] 史福胜,车发梅,孙旭红,等.不同海拔地区牦牛血浆和组织中乳酸脱氢酶的比较[J].中国兽医杂志,2007,43(2):24-25.
[27] 侯若冰,陈志达,卞江,等.L-乳酸脱氢酶催化反应机理的理论研究进展[J].化学通报,2000,63(1):15-21.

